载脂蛋白A-I模拟肽L-4F减轻过氧化氢诱导的小鼠骨髓内皮祖细胞损伤*
2016-07-05展恩欣范昊昌陈晓凤孙玉兰杜云塞黄文秀杨娜娜秦树存
展恩欣, 范昊昌, 陈晓凤, 孙玉兰, 杜云塞, 黄文秀, 杨娜娜△, 秦树存△
(泰山医学院 1山东省高校动脉粥样硬化重点实验室,动脉粥样硬化研究所, 2护理学院,山东 泰安 271016; 3新泰市人民医院,山东 泰安 271200)
▲并列第1作者
载脂蛋白A-I模拟肽L-4F减轻过氧化氢诱导的小鼠骨髓内皮祖细胞损伤*
展恩欣1,2▲,范昊昌1▲,陈晓凤1,2,孙玉兰3,杜云塞1,黄文秀1,杨娜娜1△,秦树存1,2△
(泰山医学院1山东省高校动脉粥样硬化重点实验室,动脉粥样硬化研究所,2护理学院,山东 泰安 271016;3新泰市人民医院,山东 泰安 271200)
[摘要]目的: 研究载脂蛋白A-I模拟肽L-4F是否减轻过氧化氢(hydrogen peroxide,H2O2)诱导的小鼠骨髓来源内皮祖细胞(endothelial progenitor cells,EPCs)氧化应激损伤及其机制。方法: 通过密度梯度离心法分离小鼠骨髓单个核细胞,条件培养基EGM-2MV诱导分化培养EPCs。对培养EPCs先以PI3K/AKT抑制剂LY294002(30 μmol/L)干预2 h后加入L-4F(75 mg/L)4 h,再加入100 μmol/L H2O2 24 h。MTT 法检测细胞活力,试剂盒检测各实验组培养基超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)含量,以评价细胞氧化与抗氧化平衡及脂质过氧化程度;流式细胞术Annexin V/PI双染法检测细胞凋亡;免疫印迹法检测p-AKT蛋白水平。结果: L-4F预处理显著抑制了H2O2诱导的细胞活力降低、SOD活性下降、MDA含量增加及细胞凋亡。H2O2下调p-AKT的蛋白水平,L-4F呈浓度依赖性地上调p-AKT的蛋白水平。LY294002抑制了L-4F减轻EPCs损伤的作用。结论: 载脂蛋白A-I 模拟肽L-4F部分通过PI3K/AKT通路减轻H2O2诱导的EPCs氧化应激损伤。
[关键词]动脉粥样硬化; 载脂蛋白A-I 模拟肽; 内皮祖细胞; 过氧化氢; 氧化应激
心脑血管疾病的主要病理基础——动脉粥样硬化(atherosclerosis,AS)严重危害人类健康。研究表明,血管内膜内皮细胞损伤及功能异常是导致AS发生的起始环节,因此受损内皮细胞的修复对于抑制AS病变的发生发展至关重要。内皮祖细胞(endothelial progenitor cells,EPCs)作为内皮细胞的前体细胞,可定向诱导分化为内皮细胞。众多研究表明,EPCs可以迁移到内皮受损部位,介导内皮的再生、促进损伤血管的再内皮化及缺血病变区的新生血管形成,在内皮维护和修复中起必不可少的作用[1-3]。许多病理状态下机体血管活性氧含量增加,产生严重的氧化应激反应,导致内皮受损;同时严重影响EPCs的数量和功能[4],使内皮修复受损,进而引起AS性心血管疾病的发生发展[5]。因此保护EPCs免受氧化应激损伤对抑制AS性心血管疾病的发生发展至关重要。
高密度脂蛋白(high-density lipoprotein,HDL)血浆水平与AS性心血管疾病呈负相关,是抗AS的重要靶点。HDL具有促进胆固醇逆转运、抗炎、抗氧化、保护血管内皮等减轻AS发生发展的功能。HDL抗AS的作用与其主要结构性蛋白载脂蛋白A-I(apolipoprotein A-I,ApoA-I)密切相关。L-4F是一种ApoA-I 模拟肽,研究证实L-4F通过促进巨噬细胞胆固醇外排抑制AS的发生发展[6];也可通过减少内皮细胞超氧阴离子的生成保护内皮功能[7],但L-4F对内皮细胞前体细胞——EPCs的作用尚未明确。本文通过H2O2诱导的EPCs氧化应激损伤模型,研究ApoA-I 模拟肽L-4F减轻EPCs氧化应激损伤的作用及机制。
材料和方法
1材料与试剂
人淋巴细胞分离液(TBD);人纤维连接蛋白(BD);Dulbecco′s PBS(Gibco);DiI标记的乙酰化低密度脂蛋白(DiI-labelled acetylated low-density lipoprotein,DiI-Ac-LDL)和FITC-UEA-I(BTI);EBM-2培养基(Lonza);M199培养基(Thermo);L-4F(中科亚光多肽服务公司);四甲基偶氮唑蓝 [3-(4,5-dime-thylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide, MTT]购自Sigma;二甲基亚砜(dimethyl sulfoxide, DMSO)购自Gibco;超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)测定试剂盒(南京建成生物工程研究所);Annexin/V-FITC/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒(南京凯基公司);增强化学发光试剂盒(Pierce); PVDF 膜(Millipore);β-actin(北京中杉金桥);AKT(Sigma);p-AKT(Abcam),其余试剂均为分析纯产品。
2方法
2.1小鼠骨髓来源EPCs的分离培养4周龄小鼠麻醉后断颈处死,75%乙醇浸泡15 min;剪刀剪取股骨,用预冷的PBS溶液反复冲洗骨髓腔,直到冲洗液变为清亮;反复吹打冲洗液,将混匀的冲洗液用100 μmol/L滤网过滤成单细胞悬液,置于离心管中,再缓慢加入人淋巴细胞分离液(冲洗液与人淋巴细胞分离液体积比为1∶1),20 ℃下2 000 r/min离心20 min;离心管中间乳白色云雾状为单个核细胞,将其轻轻吸取到新的离心管中,用PBS溶液洗细胞沉淀2次;完全培养基重悬细胞后反复吹打成单细胞悬液,进行细胞计数;接种于预先用人纤维连接蛋白包被的6孔板或培养瓶中,密度为1×106/cm2;3 d后更换培养基,去除非贴壁细胞,随后每隔2 d更换含10%血清的EGM-2MV条件培养基 1 次。
2.2EPCs的双荧光染色鉴定将爬片的EPCs与DiI-Ac-LDL(2.5 g/L)于37 ℃孵育2 h;然后用多聚甲醛(1%~2%)固定细胞,5 min后用PBS浸洗,再加入FITC标记的荆豆凝集素(10 mg/L)于37 ℃孵育1 h,PBS洗去多余染料后,中性甘油封片,用荧光显微镜或激光共聚焦观察;显示黄色荧光的为DiI-Ac-LDL阳性,显示绿色荧光的为FITC-UEA-I阳性,两者双染色阳性细胞被认为是正在分化的EPCs。
2.3实验分组EPCs培养7 d后,用0.25% 胰酶消化细胞制成细胞悬液,以同等数量细胞接种于孔板中,实验前将含10%血清的EGM-2MV培养基换为不含血清的M199培养基,随机分为:正常对照组:常规培养;L-4F组:培养基中分别加入10、25、50、75和100 mg/L的L-4F 24 h;H2O2组:培养基中加入100 μmol/L的H2O224 h;L-4F+ H2O2组:培养基先加入25、50和75 mg/L的L-4F预处理4 h后,再加入100 μmol/L的H2O224 h;LY294002+L-4F+ H2O2组:培养基先加入LY294002 2 h预处理后,再加入75 mg/L的L-4F 4 h,最后加入100 μmol/L 的H2O224 h。
2.4MTT法检测细胞活力将细胞以同等数量(1×104)接种于96孔板中, 按实验分组处理细胞后,每孔加入20 μL MTT(5 g/L),于细胞培养箱中继续培养, 4 h后弃去上清,每孔加入DMSO 200 μL,摇床振荡摇匀10 min,于波长490 nm 处测定各孔吸光度(A)。以对照组细胞活力为100%,其余各组细胞活力以其A值占对照组A值的百分比表示。
2.5细胞上清液总超氧化物歧化酶活力的测定收集各组细胞培养上清液,按照说明书依次加液,37 ℃下水浴40 min;加入显色液并混匀,室温放置10 min,于波长550 nm处,1 cm光径比色杯,蒸馏水调零,测各组吸光度值,每组重复测 1 次。根据吸光度值计算实验各组总SOD 活力。以对照组SOD活力为 100%,其余各组SOD活力以其占对照组的百分比表示。
2.6细胞上清液丙二醛含量的测定收集各组细胞培养上清液,按照说明书依次加液,95 ℃下水浴40 min,取出后流水冷却,离心10 min(3 500~4 000 r/min)。取上清,于波长532 nm处,1 cm光径比色杯,蒸馏水调零,测各组吸光度值,每组重复测 1 次。根据吸光度值计算MDA含量。以对照组MDA含量为 100%,其余各组MDA含量以其占对照组的百分比表示。
2.7Annexin V-FITC/PI双染流式细胞术分析细胞凋亡率收集各组细胞,于4 ℃离心5 min,1 200 r/min,冷PBS漂洗细胞2次。弃上清,将细胞重悬于100 μL binding buffer,各加入 5 μL Annexin V-FITC和PI,混匀后室温避光孵育15 min,再加入400 μL binding buffer,上流式细胞仪(Becton-Dickinson) 检测细胞凋亡情况。
2.8免疫印迹法检测p-AKT蛋白水平按照RIPA蛋白提取试剂盒说明书提取各组细胞蛋白,BCA 法进行蛋白定量;加入4×上样缓冲液,沸水浴5 min 使蛋白变性。进行SDS-PAGE(10%分离胶)后电转印至PVDF膜,3%脱脂奶粉封闭1~2 h后,分别用兔抗p-AKT(1∶300)、AKT(1∶2 000)和β-actin 抗体(1∶2 000)多克隆抗体4 ℃过夜,洗膜后用辣根过氧化物酶标记的相应Ⅱ抗室温孵育1~2 h。增强化学发光法显示免疫条带,暗室曝光, Image-Pro Plus软件分析蛋白条带A值。
3统计学处理
实验数据以均数±标准差(mean±SD)表示,采用SPSS 17.0 进行统计学分析,多组间比较应用单因素方差分析,组间均数比较应用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1EPCs的表型及鉴定
EPCs培养至第7天,倒置显微镜下显示为针样细胞,荧光显微镜下见DiI-Ac-LDL染色阳性细胞发橙黄色荧光,FITC-UEA-I染色阳性细胞发绿色荧光,二者双染阳性细胞为正在分化的EPCs,双阳性率大于80%,与国内外文献报道一致,见图1。
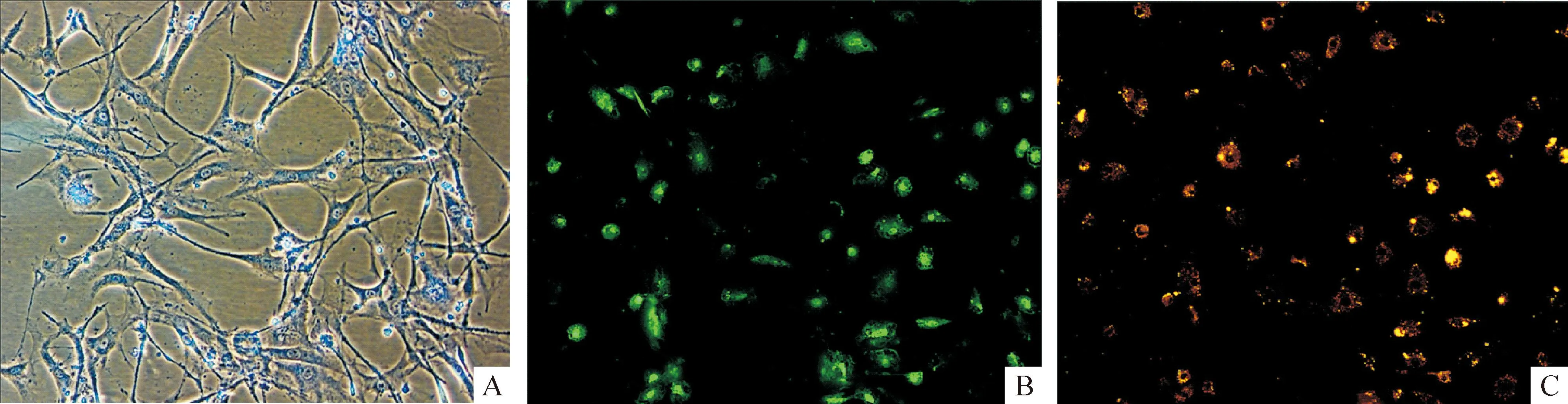
Figure 1.Identification of EPCs derived from rat bone marrow.MNCs isolated from mouse bone marrow showed the characteristics of EPCs. A: EPCs exhibiting spindle morphology cultured for 7 d in EGM-2MV medium (×20); B: EPCs binding FITC-UEA-I (×10); C: EPCs taking DiI-Ac-LDL (×10).
图1小鼠骨髓来源EPCs的表型及鉴定
2L-4F对内皮祖细胞细胞活力的影响
与对照组比较,L-4F呈浓度依赖性上调EPCs细胞活力(P<0.05);同时L-4F可减轻H2O2诱导的EPCs损伤,细胞活力明显增加(P<0.05),尤以75 mg/L L-4F组更为明显(P<0.01);但LY294002预处理明显抑制了L-4F减轻H2O2诱导的EPCs细胞活力损伤的作用,与正常对照组比较差异有统计学意义(P<0.01),见图2。

Figure 2.The effects of L-4F on the viability of EPCs. The viability of cells under different treatments was measured by MTT assay and expressed as the percentage of control. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsH2O2group.
图2L-4F对EPCs细胞活力的影响
3L-4F对培养基SOD和MDA水平的影响
如图3所示,以75 mg/L L-4F 处理细胞24 h,与对照组相比,培养基中SOD活性显著升高(P<0.05),MDA含量有所降低,但不明显;H2O2组培养基中SOD活性明显降低,MDA含量明显升高;与正常对照组比较差异有统计学意义(P<0.01);而与H2O2组相比,L-4F预处理组SOD活力明显升高,MDA含量明显降低(P<0.05),尤以75 mg/L L-4F组更为明显(P<0.01)。而LY294002预处理组与H2O2组比较差异无统计学意义,但与正常对照组相比差异有统计学意义(P<0.01)。

Figure 3.The effects of L-4F on the levels of SOD and MDA in the culture medium.Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsH2O2group.
图3L-4F对培养液SOD和MDA 水平的影响
4L-4F抑制H2O2诱导的内皮祖细胞凋亡
结果显示,75 mg/L L-4F处理细胞24 h,总细胞凋亡率较正常对照组降低了23.9%(P<0.01);100 μmol/L的H2O2处理EPCs 24 h 后,总细胞凋亡率明显增加,为对照组的1.43倍(P<0.01);而给予75 mg/L L-4F预处理4 h,则显著减少H2O2所诱导的细胞凋亡,其总细胞凋亡率较H2O2处理组降低了26.1%(P<0.01);LY294002预处理则明显抑制了L-4F的这种作用,与正常对照组相比差异有统计学意义(P<0.01),见图4。

Figure 4.L-4F restored H2O2-induced apoptosis in EPCs. The ratio of apoptotic cells stained with Annexin V-FITC and PI was detected by flow cytometry analysis.Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsH2O2group.
图4L-4F减少H2O2诱导的EPCs 凋亡
5L-4F 抑制H2O2诱导p-AKT表达下调
与对照组比较,L-4F显著上调p-AKT蛋白表达,尤以75 mg/L L-4F组更为明显(P<0.01),见图5。

Figure 5.The effect of L-4F on p-AKT protein expression in EPCs. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图5L-4F对p-AKT蛋白表达的影响
H2O2可明显下调EPCs p-AKT的蛋白水平(P<0.01),而L-4F显著抑制H2O2所诱导的p-AKT蛋白水平下调,并且呈浓度依赖性(P<0.05),见图6。

Figure 6.The effect of L-4F on H2O2-induced p-Akt protein decrease in EPCs. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsH2O2group.
图6L-4F对H2O2所诱导的p-AKT蛋白表达的影响
LY294002预处理则显著抑制L-4F诱导的p-AKT蛋白水平上调,与正常对照组相比差异具有统计学意义(P<0.01),见图7。

Figure 7.LY294002 inhibits L-4F-induced up-regulation of p-AKT in the EPCs. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsH2O2group.
图7LY294002抑制L-4F诱导的p-AKT蛋白水平的上调
讨论
内皮细胞受损导致的内皮功能障碍与AS的发病密切相关[8],因此保护内皮功能可以延缓AS的发生发展。自1997年Asahara等[9]首次分离出EPCs,人们对其进行了大量研究。EPCs可分化为成熟内皮细胞,具有增殖、迁移、黏附和成血管等功能,内膜受损伤时循环中的EPCs可归巢到损伤部位修复受损内膜,进而减慢AS 的进程[10]。然而许多血管疾病状态下机体氧化应激水平升高,导致EPCs数量的减少和功能的受损,在AS 病人中,EPCs 的数量与AS 严重程度呈负相关[11]。
HDL通过逆转运胆固醇、抗脂质氧化、抗炎、抗血栓形成、保护内皮细胞等功能发挥其抗AS 作用。近年来的研究发现了HDL抗AS的新机制——调节干、祖细胞的功能。HDL通过PI3K/AKT通路促进EPCs的增殖[12]、增加NO产量及促进端粒酶激活[13]来延缓EPCs的凋亡发挥抗AS的作用。重组HDL能够促进EPCs分化为内皮细胞及缺血部位新血管生成[14]。ApoA-I作为HDL的主要蛋白成分,在其抗AS过程中发挥重要作用。但由于ApoA-I分子量较大,需要通过静脉给药;且制造困难、成本高昂。因此,分子量较小、生物活性相似的ApoA-I模拟肽成为近年来心血管疾病治疗领域的热点。由18个氨基酸肽链片段合成的ApoA-I模拟肽L-4F和D-4F,因较高的生物活性及有利的理化特性,成为目前研究最为广泛的ApoA-I模拟肽。ApoA-I模拟肽Rev-D4F抑制ApoE敲除鼠AS的发展[15];且D-4F抑制巨噬细胞内脂质蓄积[16]。Zhang等[17]的研究显示ApoA-I 模拟肽D-4F通过eNOS/NO通路促进EPCs增殖、迁移、黏附。我们课题组研究发现Rev-D4F通过PI3K/AKT/eNOS通路提高EPCs的生物学功能[18]。
本研究以L-4F为研究对象,在H2O2诱导EPCs氧化应激损伤模型基础上,采用MTT、流式细胞术、SOD及MDA检测试剂盒、免疫印迹法检测L-4F对氧化损伤后EPCs凋亡、释放 SOD、MDA及p-AKT蛋白水平的影响。研究结果发现,以L-4F处理EPCs,显著增加了EPCs细胞活力及培养基SOD活力,减少了凋亡比例,但对MDA的释放无明显影响;H2O2处理细胞24 h,EPCs细胞活力、培养基SOD活力显著降低,MDA的释放及凋亡比例显著增加;L-4F预处理则明显减轻了H2O2诱导的EPCs损伤。说明L-4F能有效拮抗H2O2诱导的EPCs氧化应激损伤。同时L-4F明显上调EPCs p-AKT蛋白表达,且呈浓度依赖性;L-4F预处理也显著抑制H2O2诱导的EPCs p-AKT的蛋白水平的下调。而在加入PI3K/AKT抑制剂LY294002后明显抑制了L-4F减轻H2O2诱导的EPCs氧化应激损伤及上调H2O2诱导的p-AKT蛋白表达降低的作用。提示L-4F的这种保护作用部分通过PI3K/AKT通路实现。
综上所述,ApoA-I 模拟肽L-4F部分通过PI3K/AKT通路减轻H2O2诱导的EPCs氧化应激损伤。EPCs对许多疾病状态下血管内皮损伤的修复至关重要,因此,L-4F对延缓内皮损伤导致的AS性心血管疾病的发生发展具有一定的临床应用价值,为临床抗AS治疗提供了新的研究思路。
[参考文献]
[1]Xu JY, Lee YK, Wang Y, et al. Therapeutic application of endothelial progenitor cells for treatment of cardiovascular diseases[J]. Curr Stem Cell Res Ther, 2014, 9(5):401-414.
[2]杨娜娜,张良,丁国勇,等. 单个核细胞分化的命运与动脉粥样硬化[J]. 中国病理生理杂志, 2010, 26(5):1015-1019.
[3]崔斌,黄岚,武晓静,等.内皮祖细胞移植对血管内膜修复的影响[J]. 中国病理生理杂志,2007,23(4):625-628.
[4]Liu Y, Wei J, Chang M, et al. Proteomic analysis of endothelial progenitor cells exposed to oxidative stress[J]. Int J Mol Med, 2013, 32(3):607-614.
[5]Peng J, Liu B, Ma QL, et al. Dysfunctional endothelial progenitor cells in cardiovascular diseases: role of NADPH oxidase[J]. J Cardiovasc Pharmacol, 2015, 65(1):80-87.
[6]Xie Q, Zhao SP, Li F. D-4F, an apolipoprotein A-I mimetic peptide, promotes cholesterolefflux from macrophages via ATP-binding cassette transporter A1[J]. Tohoku J Exp Med,2010, 220( 3):223-228.
[7]Ou Z, Ou J, Ackerman AW, et al. L-4F, an apolipoprotein A-1 mimetic, restores nitric oxide and superoxide anion balance in low-density lipoprotein-treated endothelial cells[J].Circulation, 2003, 107(11):1520-1524.
[8]Schwartz BG, Economides C, Mayeda GS, et al. The endothelial cell in health and disease: its function,dysfunction, measurement and therapy[J]. Int J Impot Res, 2010, 22( 2):77-90.
[9]Asahara T, Murohara T, Sullivan A, et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science, 1997, 275(5302):964-967.
[10]Sen S, McDonald SP, Coates PT, et al. Endothelial progenitor cells: novel biomarker and promising cell therapy for cardiovascular disease[J]. Clin Sci (Lond), 2011, 120(7):263-283.
[11]Zhang X, Huang Z, Xie Y, et al. Lower levels of plasma adiponectin and endothelial progenitor cells are associated with large artery atherosclerotic stroke[J]. Int J Neurosci, 2016, 126(2):121-126.
[12]Zhang Q, Yin H, Liu P, et al. Essential role of HDL on endothelial progenitor cell proliferation with PI3K/Akt/cyclin D1 as the signal pathway[J]. Exp Biol Med (Maywood), 2010, 235(9):1082-1092.
[13]Pu DR, Liu L. HDL slowing down endothelial progenitor cells senescence: a novel anti-atherogenic property of HDL[J]. Med Hypotheses, 2008, 70(2):338-342.
[14]Tso C, Martinic G, Fan WH, et al. High-density lipoproteins enhance progenitor-mediated endothelium repair in mice[J]. Arterioscler Thromb Vasc Biol, 2006, 26(5):1144-1149.
[15]Qin S, Kamanna VS, Lai JH, et al. Reverse D-4F, an apolipoprotein-AI mimetic peptide, inhibits atherosclerosis inApoE-null mice[J]. J Cardiovasc Pharmacol Ther, 2012,17(3):334-343.
[16]赵莉,姚树桐,陈军,等.载脂蛋白 A-I模拟肽D-4F对巨噬细胞源性泡沫细胞清道夫受体 A1 的抑制作用[J]. 中国病理生理杂志,2014,30(10):1742-1747.
[17]Zhang Z, Qun J, Cao C, et al. Apolipoprotein A-I mime-tic peptide D-4F promotes human endothelial progenitor cell proliferation, migration,adhesion though eNOS/NO pathway[J]. Mol Biol Rep, 2011, 39(4):4445-4454.
[18]Yang N, Yao S, Wang M, et al. Apolipoprotein A-I mimetic peptide reverse D-4F improves the biological functions of mouse bone marrow-derived late EPCs via PI3K/AKT/eNOS pathway[J]. Mol Cell Biochem, 2013, 377(1-2):229-236.
(责任编辑: 卢萍, 罗森)
Apolipoprotein A-I mimetic peptide L-4F reduces hydrogen peroxide-induced injury of mouse bone marrow-derived EPCs
ZHAN En-xin1, 2, FAN Hao-chang1, CHEN Xiao-feng1, 2, SUN Yu-lan3, DU Yun-sai1, HUANG Wen-xiu1, YANG Na-na1, QIN Shu-cun1, 2
(1KeyLaboratoryofAtherosclerosisinUniversitiesofShandong,InstituteofAtherosclerosis,2CollegeofNursing,TaishanMedicalUniversity,Taian271016,China;3XintaiPeople’sHospital,Taian271200,China.E-mail:shucunqin@hotmail.com;benben1980@126.com)
[ABSTRACT]AIM: To investigate the protective effect and underlying mechanism of apolipoprotein A-I mimetic peptide L-4F on mouse bone marrow-derived endothelial progenitor cells (EPCs) injured by hydrogen peroxide (H2O2). METHODS: The bone marrow-derived mononuclear cells of C57 mice were isolated by density gradient centrifugation and cultured in EGM-2MV medium. EPCs were pretreated with a PI3K inhibitor LY294002 (30 μmol/L) for 2 h, and then incubated with L-4F (75 mg/L) for 4 h, followed by the treatment with 100 μmol/L H2O2 for 24 h. MTT assay and flow cytometry with Annexin V/PI staining were used to detect cell viability and apoptosis. The extracellular superoxide dismutase (SOD) andmalondialdehyde (MDA) levels were measured to characterize the balance between oxidation and antioxidation, and lipid peroxidation. The protein level of phosphorylated AKT (p-AKT) was analyzed by Western blot. RESULTS: L-4F restored H2O2-induced decrease in EPCs cell viability and apoptosis, and inhibited H2O2-induced decrease in SOD activity and increase in MDA level in culture medium. In addition, H2O2inactivated p-AKT, which was significantly restored by L-4F. However, LY294002 inhibited the restoration of L-4F on EPCs impaired by H2O2. CONCLUSION: Apolipoprotein A-I mimetic peptide L-4F significantly reduced H2O2-induced mouse bone marrow-derived EPC injury partially through stimulating the PI3K/AKT signaling pathway.
[KEY WORDS]Atherosclerosis; Apolipoprotein A-I mimetic peptide; Endothelial progenitor cells; Hydrogen peroxide; Oxidative stress
[文章编号]1000- 4718(2016)01- 0001- 07
[收稿日期]2015- 07- 20[修回日期] 2015- 10- 21
*[基金项目]国家自然科学基金资助项目(No. 30971098);山东省自然科学基金资助项目(No. Z2008C03; No. ZR2012HL18);山东省教育厅科技计划(No. J14LK03)
通讯作者△秦树存 Tel: 0538-6222986; E-mail: shucunqin@hotmail; 杨娜娜 Tel: 0538-6225275; E-mail: benben1980@126.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.001
·论著·
