地西他滨对K562/A02细胞阿霉素耐药性的影响*
2016-07-05王立新
熊 鸣, 王立新
(中国人民解放军海军总医院 1基础医学研究中心, 2血液科,北京 100048)
地西他滨对K562/A02细胞阿霉素耐药性的影响*
熊鸣1,王立新2△
(中国人民解放军海军总医院1基础医学研究中心, 2血液科,北京 100048)
[摘要]目的: 观察地西他滨(DAC)对人慢性粒细胞白血病耐药细胞株K562/A02阿霉素(ADR)耐药性的影响,探讨其作用的可能机制。方法: 分别或联合应用不同浓度ADR和DAC作用于K562/A02细胞和其亲本细胞株K562,采用CCK-8法检测药物细胞毒性,Sequenom MassARRAY系统结合比色法评价DNA甲基化程度,流式细胞术检测K562/A02细胞细胞周期分布和细胞凋亡率。结果: K562/A02细胞较K562细胞具有显著ADR耐药性,前者ADR作用24 h的IC50约为后者的50倍。而对DAC,在0.5~8 μmol/L作用浓度范围内,K562/A02细胞则较K562细胞更敏感。在相同ADR作用浓度(4.31和17.24 μmol/L)下,联合1 μmol/L DAC处理24 h能显著提高K562/A02细胞对ADR的敏感性,细胞存活率下降(P<0.05)。DAC和ADR均能影响K562/A02细胞的细胞周期进程和细胞凋亡率。1 μmol/L DAC的影响与作用时间相关,在作用24 h时以S期阻滞与细胞早期凋亡率升高为主,48 h时以G2/M期阻滞与细胞晚期凋亡和坏死率升高为主。ADR则主要表现为浓度依赖性G2/M期阻滞并诱导细胞晚期凋亡和坏死。两者联用使ADR对细胞周期分布的作用进一步加强,即表现为G2/M期阻滞更加明显,但对细胞凋亡率的影响并无显著差异。而在基因组甲基化程度上,2种细胞没有显著差异,DAC作用前后也没有显著改变。结论: DAC能增强K562/A02细胞对ADR的敏感性,具有逆转耐药作用,其机制可能与调节K562/A02细胞细胞周期进程、促进细胞凋亡和坏死有关。
[关键词]地西他滨; 阿霉素; K562/A02细胞; 耐药性
白血病是一种严重危害人类健康的血液系统恶性肿瘤,肿瘤细胞耐药性的产生是其治疗失败和复发的重要原因。DNA甲基化在白血病中广泛存在,启动子CpG岛超甲基化导致的抑癌基因失活与白血病的发生和肿瘤细胞化疗药物抵抗密切相关[1]。地西他滨(decitabine,DAC)是目前研究较多的甲基化抑制剂,已被证实能使一些耐药肿瘤细胞株(包括实体瘤细胞株)重新对化疗药物恢复敏感[2-5]。本研究以人慢性粒细胞白血病耐药细胞株K562/A02为研究对象,观察地西他滨对K562/A02细胞阿霉素(adramycin,ADR)耐药性的影响,并探讨其作用的可能机制,为建立新的临床治疗模式提供理论依据。
材料和方法
1细胞
K562细胞和K562/A02细胞由中国医学科学院血液学研究所提供。细胞接种于含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基,置于37 ℃、5% CO2、饱和湿度培养箱中培养。每1~3 d传代 1 次。K562/A02细胞培养体系中另加入终浓度为0.86 μmol/L的ADR以维持其耐药性,实验前2周更换为无ADR培养液培养。取对数生长期细胞用于实验,并且每次实验使用的K562/A02细胞ADR作用24 h的半数抑制浓度(half maximal inhibitory concentration,IC50)维持在(90.91±8.66) μmol/L,约为K562细胞的50倍。
2主要试剂
DAC为Pharmachemie B.V.产品,用灭菌注射用水配制成1 mmol/L的终浓度,分装后储存于-80 ℃冰箱中,2个月内有效;ADR为浙江海正药业股份有限公司产品,用灭菌注射用水配制成1.724 μmol/L终浓度,分装后储存于-20 ℃冰箱中;RPMI-1640培养基和胎牛血清为Gibco产品;细胞增殖/毒性检测试剂CCK-8为Dojindo产品;细胞凋亡检测试剂Annexin Ⅴ-FITC Kit和细胞周期检测试剂Cycletest Plus DNA Reagent Kit为BD产品。DNA甲基化定量检测试剂MethylFlash Methylated DNA Quantification Kit为Colorimetric产品。
3主要方法
3.1实验分组根据预实验结果,实验分为ADR单独处理组(ADR作用终浓度分别为0、2.16、4.31、8.62、17.24和34.48 μmol/L)、DAC单独处理组(DAC作用终浓度分别为0、0.12、0.25、0.50、1.00和2.00 μmol/L)和1 μmol/L DAC+ADR联合处理组(ADR作用终浓度分别为0、2.16、4.31、8.62、17.24和34.48 μmol/L),作用24 h,药物细胞毒性分析检测细胞存活率,验证K562/A02的耐药性,观察DAC对其ADR耐药性的影响;1 μmol/L DAC+4.31 μmol/L ADR和1 μmol/L DAC+17.24 μmol/L ADR联合处理组,分别作用24 h和48 h,流式细胞术检测K562/A02细胞的凋亡率和细胞周期,观察两药不同时相联合效应。同时,设置不同浓度药物对照(含药物的培养基,无细胞)和空白对照组(仅含培养基)。
3.2CCK-8法检测药物细胞毒性取对数生长期K562细胞和K562/A02细胞,调整密度为1×108/L,接种于96孔板中(每孔100 μL)。根据实验分组加入不同作用终浓度的药物,每组设4个平行复孔,于37 ℃、5% CO2条件下孵育24 h,加入CCK-8试剂,继续培养2 h,酶标仪测定450 nm吸光度(A)。按公式计算细胞存活率,并绘制剂量效应曲线。细胞存活率(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%
3.3细胞DNA甲基化检测取正常培养的对数生长期K562细胞和K562/A02细胞,由上海欧易生物医学科技有限公司采用Sequenom MassARRAY系统检测DNA甲基化通用标志物LINE-1的甲基化程度。每组2个样本。LINE-1是一种广泛分布于人类基因组中的重复序列核元件,占人类基因组的17%。正常情况下LINE-1是高度甲基化的。定量检测LINE-1的甲基化程度可作为全基因组甲基化程度的参考指标。同时,采用DNA甲基化定量检测试剂盒(比色法)对上述结果进行验证,并进一步对比检测1 μmol/L DAC处理24 h前后K562/A02细胞DNA甲基化程度的改变。实验操作按照说明书进行,包含DNA提取、DNA键合、甲基化DNA捕获、信号检测和数据分析4个主要步骤。由于这种检测方法只对5-甲基化胞嘧啶(5-mC)具有高度特异性,对未甲基化和羟甲基化的胞嘧啶无特异性。因此,可通过检测基因组5-mC 的含量(5-mC%)判断DNA甲基化程度。
3.4流式细胞术检测细胞周期取对数生长期的K562/A02细胞,调整细胞密度为2×108/L,按每孔4 mL接种于6孔板,根据实验分组加入不同浓度的药物(对照组加入等量1×PBS)分别培养24 h和48 h后,按照Cycletest Plus DNA Reagent Kit说明书操作,简述如下:收集各组细胞,离心去上清液,加入250 μL A液,室温静置10 min,加入200 μL B液,室温静置10 min,加入200 μL C液,4 ℃避光静置10 min,50 μmol/L尼龙网膜过滤,轻轻混匀后上机检测。实验重复3次,结果取平均值。
3.5流式细胞术检测细胞凋亡率取对数生长期的K562/A02细胞,调整细胞密度为2×108/L,按每孔4 mL接种于6孔板,根据实验分组加入不同浓度的药物(对照组加入等量1×PBS)分别培养24 h和48 h后,按照Annexin Ⅴ-FITC Kit说明书操作,简述如下:收集各组细胞,离心去上清液,4 ℃预冷的PBS洗涤2次,加入500 μL结合缓冲液重悬,加入Annexin Ⅴ-FITC 5 μL混匀,室温避光孵育15 min后,加入5 μL 碘化丙锭(propidium iodide,PI),轻轻混匀后上机检测。实验重复3次,结果取平均值。
4统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),各组均数间两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结果
1K562和K562/A02细胞对ADR和DAC的敏感性
2种细胞分别经不同浓度ADR和DAC单独作用24 h,CCK-8法检测细胞存活率,绘制剂量效应曲线如图1所示。结果显示K562细胞对ADR较敏感,在2.16~34.48 μmol/L ADR作用浓度范围内,其细胞存活率呈剂量依赖性降低,由(57.69±3.81)%下降到(2.17±1.63)%。与之相比,K562/A02细胞则显示出对ADR较强的耐药性,即使ADR达到最高作用浓度34.48 μmol/L,其存活率仍有(74.33±3.71)%。计算ADR作用24 h的IC50,K562细胞为(2.07±0.13) μmol/L,K562/A02细胞为(90.91±8.66)μmol/L,后者约为前者的50倍,证明与K562细胞相比,K562/A02细胞确实具有显著ADR耐药性(P<0.01),见图1A。
而对DAC,在0.5~8 μmol/L作用浓度范围内,K562/A02细胞则较K562细胞更敏感。DAC作用浓度为1 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L时,K562细胞存活率分别为(97.89±2.74)%、(96.10±3.57)%、(93.76±4.47)%和(85.95±4.56)%,K562/A02细胞存活率则分别为(87.15±3.41)%、(82.13±4.36)%、(80.45±5.86)%和(70.31±4.73)%,各DAC作用浓度下两两比较差异均有统计学意义(P<0.05),见图1B。

Figure 1.Dose response curves of K562 cells and K562/A02 cells treated with ADR (A) or DAC (B) alone for 24 h.Mean±SD.n=3.*P<0.05,**P<0.01vsK562.
图1K562和K562/A02细胞经ADR或DAC单独作用24 h的药物剂量效应曲线
2DAC对K562/A02细胞ADR耐药性的影响
根据前述结果和DAC临床用药剂量原则[6-7],实验选取1 μmol/L作为DAC作用浓度。K562/A02细胞经不同浓度ADR单独或联合1 μmol/L DAC处理24 h,CCK-8法检测细胞存活率,绘制剂量效应曲线如图2所示。结果显示在相同ADR作用浓度下,联合1 μmol/L DAC处理使K562/A02细胞存活率明显降低。其中,ADR作用浓度为4.31 μmol/L和17.24 μmol/L时,联合1 μmol/L DAC处理分别使K562/A02细胞存活率下降,两者差异有统计学意义(P<0.05),说明1 μmol/L DAC能提高K562/A02细胞对ADR的敏感性,具有逆转耐药作用。
3DAC对K562/A02细胞DNA甲基化程度的影响
采用Sequenom MassArray系统检测正常培养的K562/A02细胞LINE-1甲基化程度,并与其亲本细胞株K562进行对比,结果如图3所示。2种细胞LINE-1甲基化程度差异无统计学意义(P>0.05)。进一步通过DNA甲基化定量检测,结果显示,K562/A02细胞DNA甲基化程度为(2.29±0.40)%,K562细胞的为(2.65±0.40)%,两者差异无统计学显著性(P>0.05),见图4。2种检测方法结果一致,说明2种细胞在基因组整体甲基化程度上无显著差异。同时,通过DNA甲基化定量检测对比了K562/A02细胞在1 μmol/L DAC处理24 h前后基因组甲基化程度的变化,结果亦未发现显著差异。
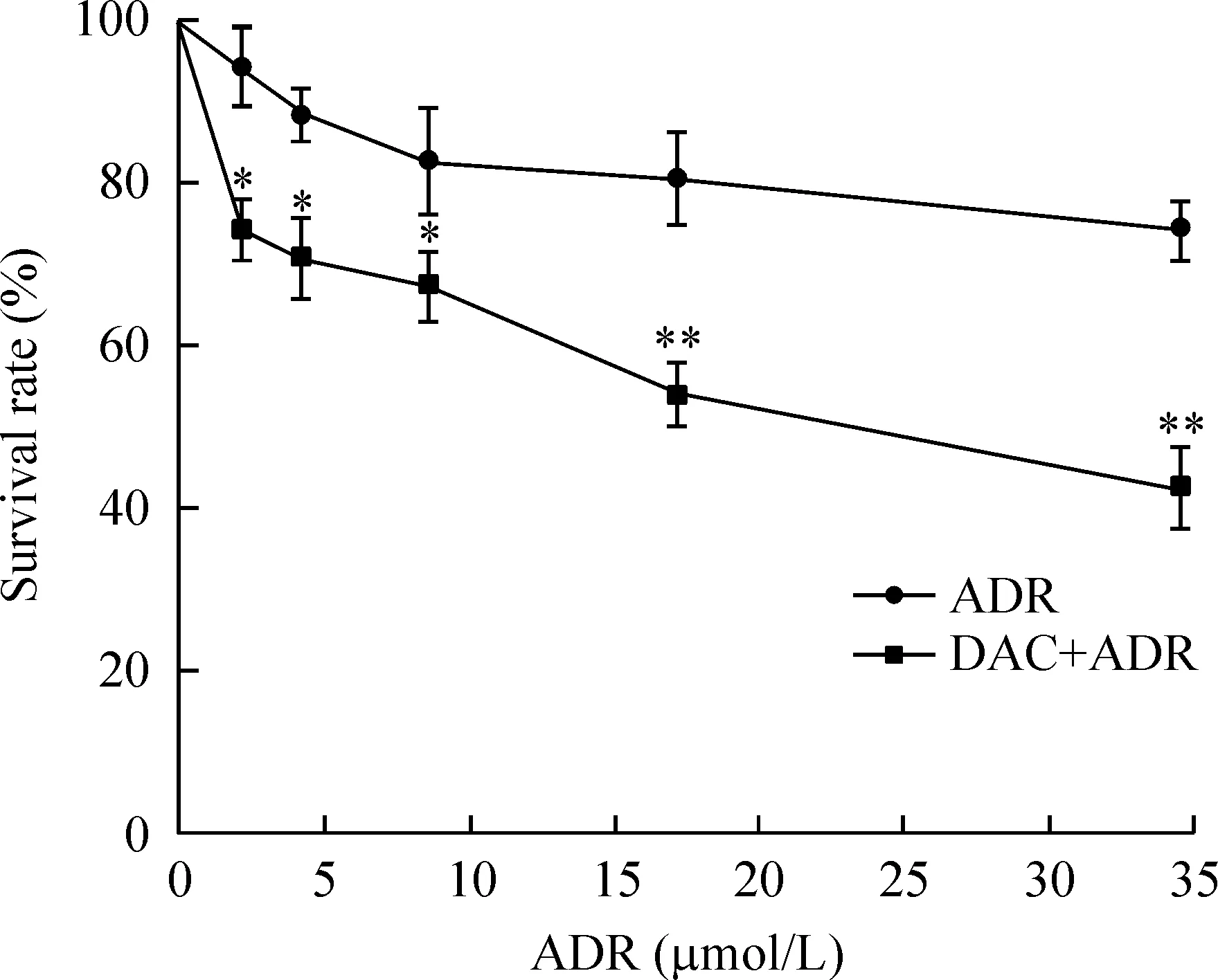
Figure 2.Dose response curves of K562/A02 cells treated with ADR alone or DAC+ADR for 24 h. Mean±SD.n=3.*P<0.05,**P<0.01vsADR group.
图2K562/A02细胞经ADR单独作用或DAC与ADR联用24 h的药物剂量效应曲线

Figure 3.Methylation degree of LINE-1 in the 2 cell lines.
图32种细胞中LINE-1甲基化程度

Figure 4.The effect of DAC on DNA methylation degree of the 2 cell lines.
图4DAC对2种细胞DNA甲基化程度的影响
4DAC联合ADR作用对K562/A02细胞细胞周期分布的影响
以17.24 μmol/L作为ADR作用的高浓度(ADR-H)和4.31 μmol/L作为ADR作用的低浓度(ADR-L),分别单独或联合1 μmol/L DAC处理K562/A02细胞24和48 h,流式细胞术检测细胞周期,结果如图5、表1所示。DAC和ADR均能影响K562/A02细胞的细胞周期进程。与正常对照组相比,1 μmol/L DAC作用后,24 h时主要表现为处于S期的细胞显著增多(P<0.01),显示S期阻滞;48 h时主要表现为处于G2/M期的细胞显著增多(P<0.01),显示G2/M期阻滞,同时伴随处于G0/G1期的细胞随作用时间进行性降低。ADR作用后,细胞周期中处于G0/G1期的细胞显著降低(P<0.01),处于G2/M期的细胞显著增高(P<0.01),显示G2/M期阻滞,且呈ADR浓度依赖性。与1 μmol/L DAC联用,使ADR对细胞周期分布的上述作用进一步加强,即与相应浓度ADR单独作用组相比,联用组的G2/M期阻滞更加明显(P<0.05)。

Figure 5.The effect of DAC combined with ADR on cell cycle distribution in K562/A02 cells.
图5DAC联合ADR作用对K562/A02细胞细胞周期分布的影响

表1 DAC联合ADR作用对K562/A02细胞细胞周期分布的影响
**P<0.01vscontrol group;▲P<0.05,▲▲P<0.01vsADR-L group;#P<0.05,##P<0.01vsADR-H.
5DAC联合ADR作用对K562/A02细胞凋亡的影响
以17.24 μmol/L作为ADR作用的高浓度(ADR-H)和4.31 μmol/L作为ADR作用的低浓度(ADR-L),分别单独或联合1 μmol/L DAC处理K562/A02细胞24 h、48 h,流式细胞术检测细胞凋亡,结果如图6、表2所示。DAC和ADR均可引起K562/A02细胞凋亡和坏死的比率升高,但ADR作用更强。与正常对照组相比,1 μmol/L DAC作用组在24 h时主要以细胞早期凋亡率升高(P<0.05)为主,作用48 h则主要表现为细胞晚期凋亡和坏死率显著升高(P<0.01)。ADR作用组在低浓度作用24 h时即能引起95%以上细胞发生晚期凋亡和坏死,在高浓度和作用48 h时晚期凋亡和坏死率几乎均达到100%。与相应浓度ADR单独作用组相比,DAC+ADR联用组虽然在作用24 h时细胞晚期凋亡和坏死率略有升高,但两组差异并无统计学显著性(P>0.05)。

Figure 6.The effect of DAC combined with ADR on the apoptosis of K562/A02 cells.
图6DAC联合ADR作用对K562/A02细胞凋亡的影响

表2 DAC联合ADR作用对K562/A02细胞凋亡的影响
*P<0.05,**P<0.01vscontrol group.
讨论
化疗是白血病最重要和最基本的治疗手段,提高化疗药物敏感性、克服肿瘤细胞耐药的产生一直是白血病研究关注的重点[8]。DNA甲基化修饰与白血病的发生和肿瘤细胞化疗药物抵抗密切相关,且具有潜在的可逆性,因此是药物治疗的良好靶点[1]。
DAC作为特异性DNA甲基化转移酶(DNA methyltransferases,DNMT)抑制剂,经磷酸化后,可降低DNMT的生物活性,从而在DNA复制过程中抑制DNA的甲基化;同时,能够重新激活因异常超甲基化沉默的多种抑癌基因、修复基因、细胞周期调控基因的表达,抑制恶性肿瘤细胞增殖、促进细胞分化或诱导其凋亡[5, 9]。已有研究报道,DAC对多种白血病细胞株具有诱导凋亡的作用,并能使一些耐药肿瘤细胞株(包括实体瘤细胞株)重新对化疗药物敏感[8-9]。
K562/A02细胞是以药物浓度递增方式对人慢粒急性红白血病变细胞株K562通过长期ADR诱导和克隆筛选而建立的耐药细胞株,其ADR耐药倍数至少为K562细胞的30倍[10-11]。实验中药物细胞毒性分析结果显示,K562/A02细胞对ADR的耐药倍数约为K562细胞的50倍。而更为值得注意的是,对于DAC,在0.5~8 μmol/L作用浓度范围内,K562/A02细胞则较K562细胞更敏感,为其发挥逆转耐药作用提供了有利基础。Charlet等[2]在DAC增加神经母细胞瘤(neuroblastoma,NBL)细胞对化疗药物敏感性的研究中也有类似发现,即耐药性最强的NBL细胞株对DAC最敏感。
根据前述结果和DAC临床用药剂量原则,本实验选取1 μmol/L作为DAC作用浓度。K562/A02细胞经不同浓度ADR单独或联合1 μmol/L DAC处理24 h,观察DAC对K562/A02细胞ADR敏感性的影响。结果显示,在相同ADR作用浓度下,联合1 μmol/L DAC处理使K562/A02细胞存活率明显降低,说明1 μmol/L DAC能提高K562/A02细胞对ADR的敏感性,具有逆转耐药的作用。
为初步探讨DAC逆转耐药作用的可能机制,本实验首先对比检测了K562细胞及其耐药细胞株K562/A02的DNA甲基化程度。结果发现两者并无显著性差异。同时,通过DNA甲基化定量检测发现K562/A02细胞在1 μmol/L DAC处理前后DNA甲基化程度亦无显著改变,说明DAC对K562/A02细胞基因组甲基化程度并无显著影响。而DAC作为去甲基化药物,甲基化调控通常是其发挥作用的主要方式。由于基因组甲基化程度反映的是细胞整体甲基化水平,因此,我们推测,DAC是否是作用于特定的甲基化位点从而影响耐药细胞药物敏感性?
进一步,实验观察了1 μmol/L DAC联合高浓度(17.24 μmol/L)和低浓度(4.31 μmol/L)ADR作用对K562/A02细胞的细胞周期分布和细胞凋亡的影响。结果显示DAC和ADR均能影响K562/A02细胞的细胞周期分布。1 μmol/L DAC的影响与作用时间相关,在作用24 h时以S期阻滞为主,48 h时以G2/M期阻滞为主。ADR则主要表现为浓度依赖性G2/M期阻滞作用。两者联用使ADR对细胞周期分布的作用进一步加强,即表现为G2/M期阻滞更加明显。而肿瘤细胞长时间阻滞于G2/M期,一方面能够抑制肿瘤细胞增殖,另一方面使肿瘤细胞累积DNA损伤而触发凋亡或直接导致坏死[12-14],这就部分解释了DAC能够增强K562/A02细胞ADR敏感性、发挥逆转耐药作用的原因。该结论在随后的细胞凋亡结果中也得到了证实。流式细胞术凋亡分析结果显示,1 μmol/L DAC作用组在24 h时主要以细胞早期凋亡率升高为主,作用48 h则主要表现为细胞晚期凋亡和坏死率显著升高。ADR作用组在低浓度作用24 h时即能引起95%以上细胞发生晚期凋亡和坏死,在高浓度和作用48 h时晚期凋亡和坏死率几乎均达到100%。因此,两者联用组虽然在作用24 h时细胞晚期凋亡和坏死率略有升高,但与相应浓度ADR单独作用组相比,差异并无显著性。
综上所述,本研究结果证实DAC能增强K562/A02细胞对ADR的敏感性,具有部分逆转耐药作用,其机制可能与调节K562/A02细胞细胞周期进程、促进细胞凋亡和坏死有关。Valdez等[14]也发现,DAC能通过去甲基化作用调节细胞周期(尤其是G2/M期)检查点和凋亡相关基因表达,使白消安耐药髓系白血病细胞重新致敏。因此,对于DAC作用的具体分子机理,我们推测是否也可通过类似的机制,改变耐药K562/A02细胞甲基化模式和程度,使一些失活基因尤其是细胞周期和凋亡相关基因被重新激活,从而引起细胞耐药性的改变,抑或还存在某些未知机制,有待在后续实验中进一步探讨。
[参考文献]
[1]Gnyszka A, Jastrzebski Z, Flis S. DNA methyltransferase inhibitors and their emerging role in epigenetic therapy of cancer[J]. Anticancer Res, 2013, 33(8):2989-2996.
[2]Charlet J, Schnekenburger M, Brown KW, et al. DNA demethylation increases sensitivity of neuroblastoma cells to chemotherapeutic drugs[J]. Biochem Pharmacol, 2012, 83(7):858-865.
[3]Hackanson B, Daskalakis M. Decitabine[J]. Recent Results Cancer Res, 2014, 201:269-297.
[4]Kurimoto M, Matsuoka H, Hanaoka N, et al. Pretreatment of leukemic cells with low-dose decitabine markedly enhances the cytotoxicity of gemtuzumab ozogamicin[J]. Leukemia, 2013, 27(1):233-235.
[5]Nie J, Liu L, Li X, et al. Decitabine, a new star in epigenetic therapy the clinical application and biological mechanism in solid tumors[J]. Cancer Lett, 2014, 354(1):12-20.
[7]Christman JK. 5-Azacytidine and 5-aza-2′-deoxycytidine as inhibitors of DNA methylation: mechanistic studies and their implications for cancer therapy[J]. Oncogene, 2002, 21(35):5483-5495.
[8]Estey EH. Epigenetics in clinical practice: the examples of azacitidine and decitabine in myelodysplasia and acute myeloid leukemia[J]. Leukemia, 2013, 27(9):1803-1812.
[9]Mirza S, Sharma G, Pandya P, et al. Demethylating agent 5-aza-2-deoxycytidine enhances susceptibility of breast cancer cells to anticancer agents[J]. Mol Cell Biochem, 2010, 342(1-2):101-109.
[10]Xin H, Kong Y, Jiang X, et al. Multi-drug-resistant cells enriched from chronic myeloid leukemia cells by doxorubicin possess tumor-initiating-cell properties[J]. J Pharmacol Sci, 2013, 122(4):299-304.
[11]嘉红云,李娟,王忠英,等. Src激酶抑制剂ZD6474对白血病细胞系K562/A02细胞增殖的影响及其作用机制探讨[J]. 中华血液学杂志, 2012, 33(3):220-224.
[12]黄伟,张瑶珍,周剑锋,等. 顺铂和阿霉素对K562细胞周期及凋亡影响的研究[J]. 中国病理生理杂志, 2005, 21(3):537-540.
[13]Yao TT, Mo SM, Liu LY, et al. 5-Aza-2′-deoxycytidine may influence the proliferation and apoptosis of cervical cancer cells via demethylation in a dose- and time-dependent manner[J]. Genet Mol Res, 2013, 12(1):312-318.
[14]Valdez BC, Li Y, Murray D, et al. 5-Aza-2′-deoxycytidine sensitizes busulfan-resistant myeloid leukemia cells by regulating expression of genes involved in cell cycle checkpoint and apoptosis [J].Leuk Res, 2010, 34(3):364-372.
(责任编辑: 陈妙玲, 罗森)
Effect of decitabine on resistance of K562/A02 cells to adriamycin
XIONG Ming1, WANG Li-xin2
(1CenterofBasicMedicalScience,2DepartmentofHematology,NavyGeneralHospitalofChinesePLA,Beijing100048,China.E-mail:wanglixin1991@sohu.com)
[ABSTRACT]AIM: To investigate the effect of decitabine (DAC) on the resistance of human chronic myeloid leukemia cell line K562/A02 to adriamycin (ADR), and to explore the possible mechanism. METHODS: The K562/A02 cell line and its parental cell line K562 were treated with different concentrations of ADR or DAC alone, or in combination. The cytotoxic effects of these 2 agents were determined by CCK-8 assay. The degree of DNA methylation was evaluated by Sequenom MassARRAY system and colorimetric method. The cell cycle distribution and the apoptotic rate were determined by flow cytometry. RESULTS: K562/A02 cells were more significantly resistant to ADR than K562 cells.The half maximal inhibitory concentration of ADR for 24 h of the K562/A02 cells was about 50 times higher than that of the K562 cells. To DAC, in the concentration range of 0.5~8 μmol/L, K562/A02 cells were more sensitive than K562 cells. As compared with the same concentrations (4.31 μmol/L and 17.24 μmol/L) of ADR alone, the combination with 1 μmol/L DAC significantly improved the sensitivity of K562/A02 cells to ADR. Both DAC and ADR affected the cell cycle progression and apoptotic rate of K562/A02 cells. DAC (1 μmol/L) treatment mainly showed S phase arrest and increased early apoptotic rate for 24 h, and G2/M phase arrest and increased late apoptosis and necrosis for 48 h in a time-related manner. ADR treatment showed G2/M phase arrest and increased late apoptosis and necrosis in a concentration-dependent manner. In combination with 1 μmol/L DAC, the effect of ADR on the cell cycle distribution was further enhanced, showing more obvious G2/M phase arrest, but no significant difference of the apoptotic rate was observed. The degree of methylation in the genome had no significant difference between the 2 cells, and it before and after DAC treatment had no significant change. CONCLUSION: DAC enhances the sensitivity of K562/A02 cells to ADR, showing drug resistance-reversing potential. The mechanism may be related to regulating cell cycle progression and promoting apoptosis and necrosis of K562/A02 cells.
[KEY WORDS]Decitabine; Adriamycin; K562/A02 cells; Drug resistance
[文章编号]1000- 4718(2016)01- 0069- 07
[收稿日期]2015- 07- 09[修回日期] 2015- 09- 29
*[基金项目]国家自然科学基金专项基金资助项目(No. 81350004); 海军总医院创新培育基金资助项目(No. cxpy201302)
通讯作者△Tel: 010-66957676; E-mail: wanglixin1991@sohu.com
[中图分类号]R730.23; R733.7
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.012
