Cripto-1基因沉默对人肝癌MHCC-97H细胞侵袭、迁移能力的影响*
2016-07-05李绍强郭奕展付顺军彭宝岗梁力建
黄 涛, 李绍强, 郭奕展, 付顺军, 彭宝岗, 梁力建
(中山大学附属第一医院肝外科,广东 广州 510080)
Cripto-1基因沉默对人肝癌MHCC-97H细胞侵袭、迁移能力的影响*
黄涛,李绍强△,郭奕展,付顺军,彭宝岗,梁力建
(中山大学附属第一医院肝外科,广东 广州 510080)
[摘要]目的: 探讨Cripto-1蛋白在人肝癌组织和肝癌细胞系中的表达,研究沉默Cripto-1基因后对肝癌细胞MHCC-97H侵袭和迁移能力的影响及可能的机制。方法: 采用Western blot检测11对肝癌组织及相应的癌旁组织和不同肝癌细胞株中Cripto-1蛋白的表达;收集80例肝癌石蜡标本,免疫组织化学方法检测Cripto-1蛋白的表达情况;Cripto-1 siRNA转染肝癌细胞MHCC-97H细胞后,real-time PCR和Western blot分别检测转染效率;Transwell迁移和侵袭实验分别检测细胞的迁移和侵袭能力;Western blot分别检测基质金属蛋白酶(MMP)-2、MMP-9蛋白的表达。结果: Western blot检测结果显示肝癌组织中Cripto-1蛋白的表达明显高于对应的癌旁组织,Cripto-1蛋白在各肝癌细胞系中均有表达,且表达量高于对照细胞,其中高侵袭性肝癌细胞MHCC-97H表达量最高;免疫组织化学结果显示Cripto-1蛋白在88.7%的肝癌组织中表达;Cripto-1 siRNA转染MHCC-97H细胞后能显著降低Cripto-1 mRNA和蛋白的表达水平,并且能降低其侵袭和迁移能力;Western blot结果表明,Cripto-1基因沉默后能抑制MMP-2和MMP-9蛋白的表达。结论: Cripto-1在肝细胞癌中的高表达可能与肝癌的发生发展密切相关,下调Cripto-1的表达可以抑制肝癌细胞侵袭和迁移能力,其机制可能与下调MMP-2、MMP-9的表达有关。
[关键词]肿瘤侵袭; 肿瘤转移; 小干扰RNA; Cripto-1基因; 肝细胞癌
肝细胞癌(hepatocellular carcinoma,HCC)是世界上常见的恶性肿瘤,我国HCC的死亡率已升至恶性肿瘤的第2位。目前肝癌的治疗方法很多,但是效果大多不理想,即使是小于2 cm的小肝癌,治愈性切除术后的5年复发和转移率高达70%[1],侵袭转移和术后复发是大多数HCC患者死亡的主要原因。然而其具体的机制尚不明确。研究、阐明HCC侵袭转移的机制,并针对性地设计相应的治疗对策,对提高HCC临床治疗效果和改善患者的预后更具意义。
Cripto-1,又称畸胎瘤衍生生长因子-1 (teratocarcinoma-derived growth factor-1,TDGF-1),是表皮生长因子(epidermal growth factor,EGF)-Cripto-1/成纤维细胞生长因子相关配体1(fibroblast growth factor-related ligand-1,FRL-1)/Cryptic家族的成员。Cripto-1作为胚胎发育过程中发挥重要作用的基因,在成人组织中仅有极少部分器官低度表达[2]。研究发现Cripto-1在肿瘤形成过程中会再次出现高表达,并且能促进肿瘤细胞的增殖、迁移、侵袭和血管生成[3-4]。目前研究已经证实Cripto-1在乳腺癌[5]、恶性黑色素瘤[6]、胰腺癌[7]、膀胱癌[8]、结肠癌[9]等肿瘤中高表达,但在肝细胞癌中是否表达却少有报导。因此我们检测肝癌细胞和组织中Cripto-1的表达,并用Cripto-1 siRNA转染Cripto-1表达量最高的肝癌MHCC-97H细胞,研究Cripto-1表达下调后对肝癌细胞的侵袭和迁移能力的影响及可能的机制。
材料和方法
1主要材料和试剂
人肝癌细胞株MHCC-97H、MHCC-97L、PLC/PRF/5、SMMC-7721、Bel-7402、Huh7及对照细胞株LO2(中国科学院上海细胞库);人肝癌组织及相应癌旁组织、肝癌组织石蜡切片(中山大学附属第一医院);高糖DMEM培养基、RPMI-1640培养基、胎牛血清、胰酶和磷酸盐缓冲液(Gibco);GAPDH抗体(北京博奥森);Cripto-1兔抗人多克隆抗体(Abcam);基质金属蛋白酶(matrix metalloproteinases,MMP)-2抗体、MMP-9抗体、山羊抗兔IgG Ⅱ抗(CST);Cripto-1 siRNA和control siRNA(广州锐博);Matrigel基质胶(BD);Transwell小室(Corning);Lipofectamine 3000(Invitrogen);引物合成、RNA逆转录试剂盒、PCR扩增试剂盒(TaKaRa);全蛋白提取试剂盒、免疫组织化学染色试剂盒(南京凯基);BCA蛋白定量试剂盒(北京康为世纪)。
2方法和步骤
2.1肝癌组织及癌旁组织中Cripto-1蛋白的表达收集中山大学附属第一医院手术室切下的新鲜的原发性肝癌组织及相应的癌旁组织11对,低温快速运输到实验室,分别剪碎后置于液氮中碾磨成粉状,加入RIPA及PMSF、蛋白酶抑制剂、磷酸酶抑制剂,按照蛋白提取试剂盒说明书步骤提取总蛋白液,BCA法测定蛋白浓度,Western blot法检测Cripto-1蛋白的表达量。
2.2细胞株中Cripto-1蛋白的表达将复苏的MHCC-97H、MHCC-97L、PLC/PRF/5、SMMC-7721、Bel-7402、Huh7和LO2细胞分别置于含10%胎牛血清的培养基中,在37℃、5%CO2的培养箱中培养和传代,待细胞状态稳定后提取蛋白。Western blot法检测7株细胞中Cripto-1蛋白的表达量。
2.3免疫组织化学染色将取自中山大学附属第一医院病理科的80例石蜡标本各制成4 μm厚切片,经过二甲苯脱蜡、梯度乙醇脱水后,置于柠檬酸盐缓冲液中行微波抗原修复15 min。冷却至室温后,以3%双氧水封闭内源性过氧化物酶,山羊血清封闭30 min后滴加Cripto-1抗体(1∶100稀释)覆盖切片上的组织,放置于湿盒内4 ℃过夜。PBS漂洗干净后滴加II抗30 min,显微镜下DAB显色,苏木素复染细胞核,梯度乙醇二甲苯脱水后,中性树胶封片。
2.4转染及分组挑选Cripto-1蛋白表达量最高的MHCC-97H细胞用于转染Cripto-1 siRNA。转染前24 h,选取生长状态良好的MHCC-97H细胞按4×105个细胞接种于6孔板里,培养24 h后,待细胞汇合度达到70%左右,按照Lipofectamine 3000说明书操作步骤分别将Cripto-1 siRNA(针对靶序列5’-GGAATTTGCTCGTCCATCT-3’设计)和control siRNA转染至MHCC-97H细胞。实验分为Cripto-1 siRNA组和control siRNA组。
2.5Real-time PCR验证转染效率转染48 h后,TRIzol法提取各组细胞RNA,按照逆转录试剂盒说明书逆转录成cDNA。SYBR Green染料法进行实时荧光定量PCR反应,以β-actin为内参照。Cripto-1的上游引物序列为5’-TCTACGGACGGAACTGTGAGC-3’,下游引物序列为5’-CTTCTTGGGCAGCCAGGTGT-3’,产物80 bp;β-actin的上游引物序列为5’-CACCCAGCACAATGAAGATCAAGAT-3’,下游引物序列为5’-CCAGTTTTTAAATCCTGAGTCAAGC-3’,产物317 bp。反应条件为95℃10 min;95℃15 s,60℃ 60 s,40个循环。
2.6Western blot法检测蛋白的表达转染后72 h收集各实验组细胞,加入RIPA及PMSF、磷酸酶抑制剂,按照蛋白提取试剂盒说明书步骤提取总蛋白液,BCA法测定蛋白浓度,将总蛋白液与上样缓冲液按4∶1的比例混合,煮沸5 min后制成蛋白质样品。配置5%浓缩胶和15%分离胶,每组各取40 μg蛋白样品加入泳道,进行SDS-PAGE,浓缩胶60 V 30 min,分离胶100 V 90 min。再将电泳产物恒压90 V 100 min转至PVDF膜上。含5% BSA的TBST摇床上封闭1 h后,分别加入稀释好的Cripto-1、MMP-2、MMP-9、GAPDH(稀释比均为1∶1 000)抗体中,置于摇床4℃孵育过夜。次日,TBST漂洗缓冲液洗膜3次,每次10 min。加入山羊抗兔IgG II抗(稀释比1∶3 000),室温孵育1 h,TBST漂洗缓冲液洗膜3次,每次10 min;配制ECL化学发光液,滴加到PVDF膜上,放入化学发光成像系统中成像,获得蛋白条带图片。
2.7Transwell实验检测细胞侵袭和迁移能力侵袭实验按1∶8将Matrigel胶稀释于无血清DMEM培养基中,Transwell小室置于24孔板中,每个小室加入上述稀释液100 μL后置于37 ℃恒温箱1 h,待胶凝结后,下室加入700 μL 10%胎牛血清的DMEM培养基,上室加入200 μL含2%胎牛血清的细胞(7×104个)悬液,置于细胞培养箱中。36 h后吸去上室培养液,4%多聚甲醛固定20 min后0.1%结晶紫溶液染色15 min,PBS清洗干净,棉签擦拭上室,置于显微镜下观察小室下面穿过的细胞数量。随机选取5个视野,细胞计数并记录。迁移实验则无需在小室中加入Matrigel,培养时间为24 h,其它步骤同侵袭实验。
3统计学处理
采用统计学软件SPSS 16.0分析,数据以均数±标准差(mean±SD)表示,两组之间均数比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结果
1肝癌组织及肝癌细胞系中Cripto-1蛋白的表达
11对肝癌组织中有10对Cripto-1蛋白的表达明显高于相应的癌旁组织(P<0.05),见图1。6株肝癌细胞系均有Cripto-1蛋白表达,除SMMC-7721外,其余5株与正常对照细胞LO2相比差异均有统计学意义(P<0.05),并且高侵袭性的MHCC-97H细胞表达量最高,见图2。

Figure 1.The expression of Cripto-1 in 11 samples of tumor and paracancerous tissues.T: tumor tissues; P: parcancerous tissues. Mean±SD.n=11.*P<0.05vsP.
图1Cripto-1蛋白在肝癌组织和癌旁组织中的表达

Figure 2.The protein expression of Cripto-1 in the HCC cell lines.The expression of Cripto-1 in HCC cells was significantly higher than that in the control cell line LO2.Mean±SD.n=3.*P<0.05,**P<0.01vsLO2.
图2Cripto-1蛋白在肝癌细胞株中的表达
2免疫组织化学染色结果
对80例肝癌组织石蜡切片进行免疫组织化学方法染色,结果显示其中71例有Cripto-1蛋白的表达,9例无表达,阳性率88.7%,典型表达图片见图3。
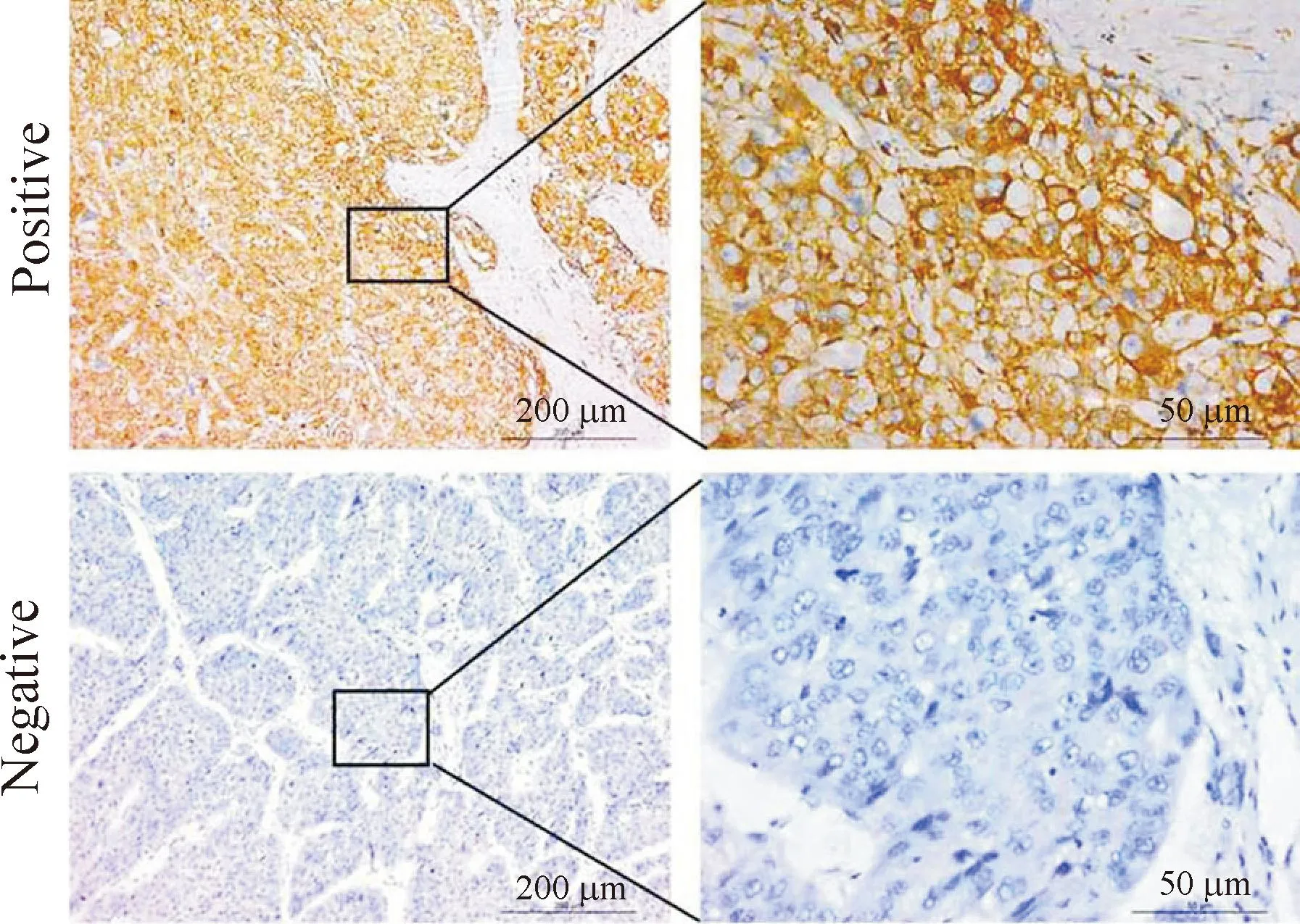
Figure 3.Representative immunohistochemical images showing the expression of Cripto-1 in the HCC tissues.
图3Cripto-1蛋白在原发性肝癌组织中表达的免疫组化典型图片
3Cripto-1 siRNA降低MHCC-97H细胞Cripto-1 mRNA和蛋白的表达
Real-time PCR 和Western blot实验结果显示,与对照组相比,Cripto-1基因沉默组中Cripto-1 mRNA水平和蛋白的水平明显下降(P<0.05),表明Cripto-1 siRNA对MHCC-97H细胞的Cripto-1基因沉默有效,见图4、5。
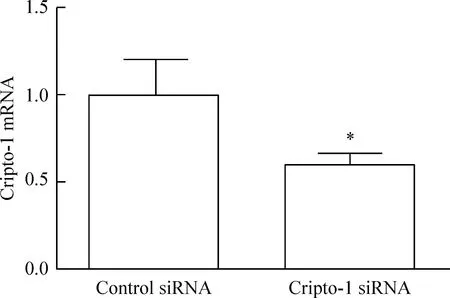
Figure 4.The mRNA expression of Cripto-1 in the MHCC-97H cells transfected with Cripto-1 siRNA.Mean±SD.n=3.*P<0.05vscontrol siRNA group.
图4mRNA水平检测 Cripto-1 siRNA转染效率
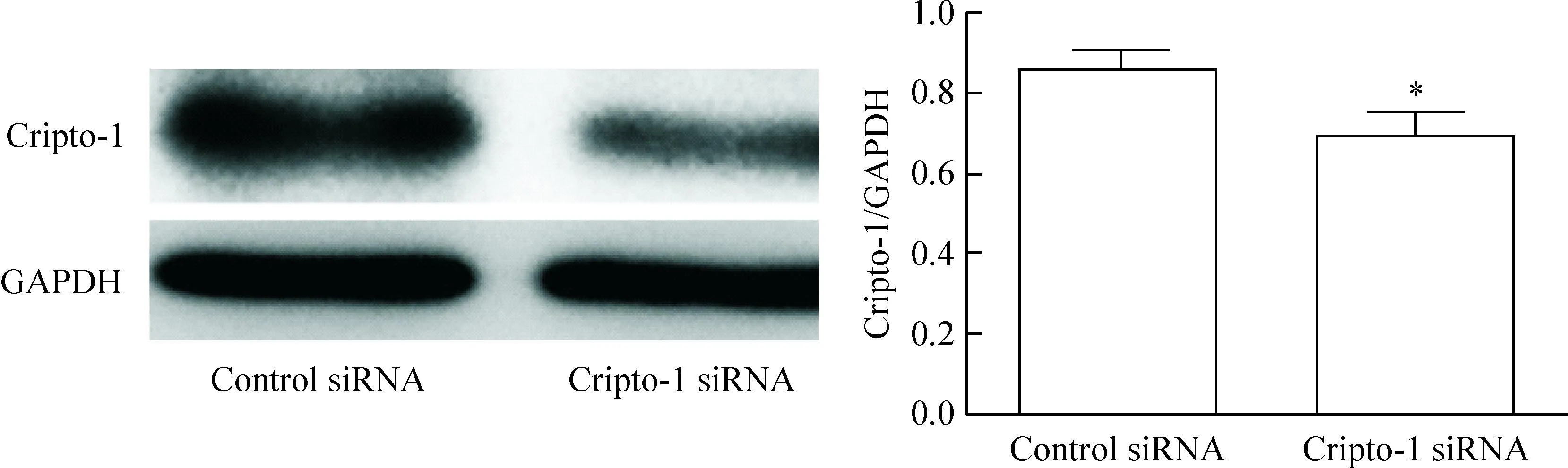
Figure 5.The protein expression of Cripto-1 in the MHCC-97H cells transfected with Cripto-1 siRNA.Mean±SD.n=3.*P<0.05vscontrol siRNA group.
图5蛋白水平检测Cripto-1 siRNA转染效率
4下调Cripto-1可以抑制MHCC-97H细胞的侵袭和迁移能力
沉默Cripto-1基因后的MHCC-97H细胞与对照组细胞相比,侵袭和迁移的细胞数目明显减少(P<0.01),说明沉默Cripto-1基因会降低MHCC-97H细胞的侵袭和迁移能力,见图6。
Figure 6.The migration and invasion abilities of MHCC-97H cells transfected with Cripto-1 siRNA decreased significantly(×100).Mean±SD.n=5.**P<0.01vscontrol siRNA group.
图6沉默Cripto-1基因对MHCC-97H细胞侵袭和迁移能力的影响
5下调Cripto-1可以减少MMP-2和MMP-9的表达
与对照组相比,Cripto-1 siRNA组的MMP-2和MMP-9的表达下调(P<0.01),说明沉默Cripto-1基因后会抑制MMP-2和MMP-9的表达,见图7。

Figure 7.The protein expression of MMP-2 and MMP-9 in the MHCC-97H cells transfected with Cripto-1 siRNA.Mean±SD.n=3.**P<0.01vscontrol siRNA group.
图7沉默Cripto-1基因后MMP-2和MMP-9蛋白的表达
讨论
肝细胞癌是世界上常见的恶性肿瘤之一,而中国又是肝细胞癌高发地区。近年来,肝癌的治疗手段日益增多,但是治疗效果却并不理想,肿瘤的复发和转移时有发生,降低了患者生存率。肝癌的发生发展、侵袭、转移是多因素综合影响的过程,研究肝癌细胞在这个过程中的作用机制并设计针对性的干预措施显得尤为重要。
Cripto-1是一种细胞膜锚定蛋白,它的结构包括N端信号序列、EGF样结构域、富含半胱氨酸的CFC序列以及一段较短的C端序列,分子量为21 kD。除了表达于细胞膜表面,Cripto-1还可以作为可溶性蛋白表达[10]。已有研究发现Cripto-1蛋白或者mRNA在多种恶性肿瘤中高表达;而在正常组织中不表达或低表达,并且能促进肿瘤细胞的侵袭和转移[11-13],这提示Cripto-1可能与肿瘤发生发展密切相关。本研究中,我们发现Cripto-1在肝癌组织中的表达明显高于癌旁组织,不同肝癌细胞株中均有Cripto-1的表达,并且高于对照细胞,这也提示我们在肝癌的发生发展中Cripto-1可能扮演者重要的角色。而肝癌细胞的侵袭转移是一个多步骤、多因素的过程,其机制也十分复杂,而其中一个重要的过程就是肿瘤细胞降解细胞外基质和基底膜从而向远处转移。这个过程中MMPs发挥了重要作用,作为MMPs家族中的重要成员,MMP-2和MMP-9已被学者证实在肝癌中高表达并且能促进癌细胞侵袭和转移[14-15]。本研究沉默Cripto-1基因后发现,肝癌MHCC-97H细胞的侵袭、迁移能力明显减弱。基于此,我们检测MMP-2和MMP-9的表达,发现其表达随着Cripto-1基因的沉默而受到抑制,因此我们推测Cripto-1可能通过调控MMP-2和MMP-9的表达来促进肝癌细胞的侵袭转移能力。而具体的调控机制还有待进一步的研究。
综上所诉,本实验通过对Cripto-1在肝癌组织和肝癌细胞系中的蛋白表达水平研究发现Cripto-1可能与肝癌的发生发展有关,体外实验也表明Cripto-1能促进肝癌的侵袭转移。因此,Cripto-1基因可能成为肝癌治疗的潜在靶点,干预Cripto-1可能为肝癌的治疗提供新思路。
[参考文献]
[1]Roayaie S, Obeidat K, Sposito C, et al. Resection of hepatocellular cancer ≤2 cm:results from two Western centers[J].Hepatology, 2013, 57(4):1426-1435.
[2]Schier AF, Talbot WS. Nodal signaling and the zebra fish organizer[J]. Int J Dev Biol, 2001, 45(1):289-297.
[3]Bianco C, Rangel MC, Castro NP, et al. Role of Cripto-1 in stem cell maintenance and malignant progression[J]. Am J Pathol, 2010, 177(2):532-540.
[4]Rangel MC, Karasawa H, Castro NP,et al. Role of Cripto-1 during epithelial-to-mesenchymal transition in development and cancer[J]. Am J Pathol, 2012, 180(6):2188-2200.
[5]Strizzi L, Bianco C, Normanno N, et al. Epithelial mesenchymal transition is a characteristic of hyperplasias and tumors in mammary gland from MMTV-Cripto-1 transgenic mice[J]. J Cell Physiol, 2004, 201(2):266-276.
[6]Strizzi L, Abbott DE, Salomon DS, et al. Potential for Cripto-1 in defining stem cell-like characteristics in human malignant melanoma[J]. Cell Cycle, 2008, 7(13):1931-1935.
[7]Lonardo E, Hermann PC, Mueller MT, et al. Nodal/Activin signaling drives self-renewal and tumorigenicity of pancreatic cancer stem cells and provides a target for combined drug therapy[J]. Cell Stem Cell, 2011, 9(5):433-446.
[8]Wei B, Jin W, Ruan J, et al. Cripto-1 expression and its prognostic value in human bladder cancer patients[J]. Tumour Biol, 2015, 36(2):1105-1113.
[9]Baldassarre G, Tucci M, Persico MG, et al. A truncated form of teratocarcinoma-derived growth factor-1 (Cripto-1) mRNA expressed in human colon carcinoma cell lines and tumors[J]. Tumour Biol, 2001, 22(5): 286-293.
[10]Nagaoka T, Karasawa H, Castro NP, et al. An evolving web of signaling networks regulated by Cripto-1[J]. Growth Factors, 2012, 30(1):13-21.
[11]Bianco C,Castro NP,Baraty C,et al.Regulation of human Cripto-1 expression by nuclear receptors and DNA promo-ter methylation in human embryonal and breast cancer cells[J].J Cell Physiol,2013,228(6):1174-1188.
[12]Bianco C, Strizzi L, Normanno N, et al.Cripto-1: an oncofetal gene with many faces[J].Curt Top Dev Biol,2005,67:85-133.
[13]Strizzi L,Bianco C,Normanno N,et al.Cripto-1:a multifunctional modulator during embryogenesis and oncogenesis[J].Oncogene,2005,24(37):5731-5741.
[14]胡劲松,翟为溶,张月娥,等.基质金属蛋白酶及组织抑制因子在肝癌中的表达及与预后的关系[J].中华消化杂志,2001,21(8):461-464.
[15]李明意,姚金科,周晓华,等.MKK-4、MMP-9基因的表达与原发性肝癌肿瘤侵袭转移的关系[J].中国病理生理杂志,2006,22(8):1480-1483.
(责任编辑: 卢萍, 余小慧)
Effects of Cripto-1 gene silencing on invasion and migration of hepatocellular carcinoma cell line MHCC-97H
HUANG Tao, LI Shao-qiang, GUO Yi-zhan, FU Shun-jun, PENG Bao-gang, LIANG Li-jian
(DepartmentofHepatobiliarySurgery,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:lisq@medmail.com.cn)
[ABSTRACT]AIM: To investigate the expression of Cripto-1 in hepatocellular carcinoma (HCC) and the effects of Cripto-1 gene silencing on the invasion and migration of MHCC-97H cells. METHODS: The protein expression of Cripto-1 in the tumor tissues, paracancerous tissues and different HCC cell lines was detected by Western blot. The hepatocellular carcinoma paraffin-embedded specimens (n=80) were collected. The protein expression of Cripto-1 was detected by immunohistochemical method. The Cripto-1 siRNA or control siRNA was transfected into the MHCC-97H cells. The expression of Cripto-1 at mRNA and protein levels was detected by real-time PCR and Western blot, respectively. Transwell migration and invasion experiments were performed to measure the migration and invasion abilities. Finally, the protein expression of matrix metalloprotein-ase (MMP)-2 and MMP-9 in the MHCC-97H cells transfected with Cripto-1 siRNA was detected by Western blot. RESULTS: The protein expression of Cripto-1 in the tumor tissues was significantly higher than that in the paracancerous tissues. Meanwhile, the protein expression of Cripto-1 in the HCC cell lines (highest in MHCC-97H cells) was higher than that in the control cell line. The results of immunohistochemistry show the positive rate of Cripto-1 in HCC was 88.7%. Compared with control group, the expression of Cripto-1 at mRNA and protein levels was notably down-regulated in the MHCC-97H cells transfected with Cripto-1 siRNA, so was the expression of MMP-2 and MMP-9. In addition, the migration and invasion abilities of MHCC-97H cells transfected with Cripto-1 siRNA were decreased. CONCLUSION: Over-expression of Cripto-1 may be closely associated with the occurrence and development of HCC. Cripto-1 gene silencing decreases the migration and invasion abilities of MHCC-97H cells, which may act via inhibiting the expression of MMP-2 and MMP9.
[KEY WORDS]Neoplasm invasiveness; Neoplasm metastasis; Small interfering RNA; Cripto-1 gene; Hepatocellular carcinoma
[文章编号]1000- 4718(2016)01- 0089- 06
[收稿日期]2015- 09- 23[修回日期] 2015- 11- 25
*[基金项目]国家自然科学基金资助项目(No. 81472254)
通讯作者△Tel:020-87755766; E-mail: lisq@medmail.com.cn
[中图分类号]R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.015
