丝瓜络多糖对3T3-L1前脂肪细胞分化的影响*
2016-07-05刘紫萍朱伟杰
刘紫萍, 李 菁△, 朱伟杰
(暨南大学1医学院病理生理学系,2生命科学技术学院, 广东 广州 510632)
丝瓜络多糖对3T3-L1前脂肪细胞分化的影响*
刘紫萍1,李菁1△,朱伟杰2
(暨南大学1医学院病理生理学系,2生命科学技术学院, 广东 广州 510632)
[摘要]目的: 分离提纯丝瓜络多糖,观察其对3T3-L1前脂肪细胞分化的影响,并探讨其作用机制。方法:采用热水浸提法和DEAE-cellulose柱层析法对丝瓜络多糖进行初步分离和提纯,并对分离组分进行红外光谱分析。运用油红O染色法,观察丝瓜络多糖对3T3-L1前脂肪细胞分化的影响,并通过RT-qPCR观察3T3-L1前脂肪细胞分化时CCAAT增强子结合蛋白β(CCAAT/enhancer binding protein β,C/EBPβ)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptors γ,PPARγ)和CCAAT增强子结合蛋白α(C/EBPα)mRNA的表达情况。结果:经DEAE-cellulose柱层析法分离得到2个多糖组分,丝瓜络提取物Ⅰ(RLFⅠ)和丝瓜络提取物Ⅱ(RLFⅡ),红外光谱分析结果表明2个组分均为多糖类物质。RLFⅠ具有显著抑制3T3-L1前脂肪细胞分化及甘油三酯合成的作用(P<0.05),RLFⅡ则无显著效应。与对照组相比,RLFⅠ处理组3T3-L1前脂肪细胞C/EBPβ、PPARγ和C/EBPα的mRNA表达水平明显降低(P<0.05)。结论:丝瓜络多糖RLFⅠ具有显著抑制3T3-L1前脂肪细胞分化的能力,其作用机制可能与下调脂肪细胞分化转录因子C/EBPβ、PPARγ和C/EBPα有关。
[关键词]丝瓜络; 3T3-L1前脂肪细胞; 细胞分化
丝瓜络(Retinervusluffaefructus,RLF)是葫芦科植物丝瓜老熟后去皮和去籽后的维管束,中药方剂中常用于治疗气血阻滞的胸肋疼痛、筋骨酸痛、乳汁不通、乳痈中通、乳腺炎、水肿等。现代药理学研究表明丝瓜络具有心脏保护、抗炎、抗过敏、抗氧化、降血脂等功能[1-4]。多年来,天然丝瓜的药用成分、药用价值一直受到国内外学者的重视,我们前期研究发现丝瓜络具有降脂、抑制体重增加和抗氧化的功能,但丝瓜络调控脂代谢的分子机制尚不清楚。因此,本研究利用阴离子交换柱层析法分离提纯丝瓜络多糖,并观察丝瓜络多糖对3T3-L1前脂肪细胞分化的影响,为丝瓜络药用价值的深度开发和利用提供科学依据。
材料和方法
1材料、试剂与仪器
3T3-L1 前脂肪细胞株(中科院上海细胞库);丝瓜络(广州康乐医药连锁店);DEAE-cellulose(北京鼎国昌盛生物);3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine, IBMX)、地塞米松(dexamethasone,Dex)、胰岛素(insulin)和油红O均购自Sigma;DMEM高糖培养基、胰蛋白酶(Gibco);胎牛血清(四季青);RNAiso Plus及RT-qPCR试剂盒(TaKaRa);引物由上海生工生物公司合成。T6新锐可见光分光光度计(北京普析通用仪器有限责任公司);傅里叶变换红外光谱仪(BRVKER); CFX96实时荧光定量PCR仪(Bio-Rad)。
2方法
2.1丝瓜络多糖的提取丝瓜络去皮后60 ℃干燥,搅碎成粉末,备用。称取丝瓜络干粉1 kg,以1∶40料液比,90 ℃双蒸水浸提6 h,过滤;滤液减压浓缩,加入3倍体积的无水乙醇,混匀后4 ℃静置过夜,1 800 ×g离心20 min取沉淀,依次用无水乙醇、丙酮洗涤沉淀,冷冻干燥,得粗多糖。
2.2苯酚-硫酸法测定丝瓜络多糖含量用葡萄糖标准品按照苯酚-硫酸法配制标准液[5],于波长490 nm处测定吸光度值。以葡萄糖标准液浓度C(mg/L)为横坐标,其A值为纵坐标,绘制葡萄糖标准曲线,并得到线性回归方程y=0.053 6x+0.007 6,R2=0.999 6,线性范围为0~25 mg/L。

2.3DEAE-cellulose柱层析分离粗多糖将DEAE-cellulose预处理后,装柱(柱长30cm,直径2.5cm),蒸馏水平衡3~5个柱体积。称取100mg粗多糖,溶于10mL蒸馏水,0.45μm滤膜过滤后,上样。先用300mL蒸馏水冲洗柱子,再用500mL0~1mol/LNaCl溶液梯度洗脱,最后用500mL1mol/LNaCl溶液冲洗。每10mL接1管,流速为1.0mL/min,采用苯酚-硫酸法检测多糖含量。根据洗脱峰合并洗脱液,透析除盐,减压浓缩,冷冻干燥后,得到丝瓜络提取物Ⅰ(RLFⅠ)和丝瓜络提取物Ⅱ(RLFⅡ)。
2.4丝瓜络多糖提取物红外光谱分析分别取1mg的RLFⅠ和RLFⅡ样品,干燥,与适量溴化钾(KBr)粉末研磨混合均匀,压片,采用红外光谱仪于4 000~400cm-1范围内扫描。
2.53T3-L1前脂肪细胞的培养及诱导分化以含10% 胎牛血清的DMEM作为基础培养液,将3T3-L1前脂肪细胞置于37 ℃、5%CO2恒温培养箱中培养,待细胞生长至不超过80%培养瓶时,传代培养。诱导分化方法:取对数生长期的3T3-L1前脂肪细胞,以每孔2×104的密度接种于24 孔板,待细胞长满孔底,换液后接触抑制48h,开始加入诱导液A(0.5μmol/LIBMX、1nmol/LDex、10mg/Linsulin及含10% 胎牛血清的DMEM)培养48h,换诱导液B(10mg/Linsulin及含10% 胎牛血清的DMEM)培养48h,此后,每隔48h换基础培养液继续培养,直至约80%的前脂肪细胞分化成脂肪细胞。
2.6丝瓜络多糖提取物对3T3-L1前脂肪细胞分化的影响取3T3-L1前脂肪细胞以每孔2×104的密度接种于24 孔板,按照2.5方法进行诱导分化。实验分组为空白组:细胞不进行诱导分化,其它培养条件同阴性对照组;阴性对照组:细胞进行正常诱导分化;RLFⅠ组和RLFⅡ组:自诱导开始,分别加入终浓度为31.1mg/L、500mg/L和1 000mg/L的RLFⅠ,以及终浓度为250mg/L、500mg/L和1 000mg/L的RLFⅡ。
用油红O染色观察成熟脂肪细胞内甘油三酯的含量[6],油红O具有很强脂溶性,能与甘油三酯结合。待细胞分化至第8天进行油红O染色,拍照,并采用ImageJ软件对脂肪细胞进行定量分析。异丙醇处理已染色细胞,将洗脱液的着色程度进行比色,570nm处检测吸光度值,分析细胞的分化程度。
2.7RT-qPCR检测脂肪分化相关转录因子水平的变化取3T3-L1前脂肪细胞以每孔1×105接种于6孔板,样品处理方法同2.5,待分化至第8天,RNAisoPlus试剂抽提细胞总RNA,按试剂盒说明书对RNA进行纯化,在紫外分光光度计上进行RNA定量,用A260/A280比值确定RNA的纯度,认为比值在1.8~2.1之间符合纯度要求。配置30μLRNA逆转录体系,逆转录合成cDNA后,以GAPDH为内参照,进行荧光定量PCR。PCR反应条件为95 ℃ 30s;95 ℃10s,60 ℃ 10s,72 ℃ 10s,40个循环。采用2-ΔΔCt法对PCR结果进行分析。引物序列见表1。
3统计学处理
数据以均数±标准差(Mean±SD)表示,用SPSS13.0软件进行统计分析。多组间差异采用单因素方差分析,方差齐用SNK法,方差不齐用Tamhane’sT2法,以P<0.05为差异有统计学意义。
结果
1DEAE-cellulose柱层析分离粗多糖
上样后,依次用蒸馏水、0~1 mol/L NaCl溶液和1 mol/L NaCl溶液冲洗层析柱,得到2个洗脱峰,收集合并洗脱液,透析,浓缩,冷冻干燥后,得到丝瓜络提取物RLFⅠ和RLFⅡ。如图1,峰1为蒸馏水洗脱峰,峰2为0~1 mol/L NaCl溶液的梯度洗脱峰,1 mol/L NaCl溶液洗脱时,未出现明显的洗脱峰。
Figure 1.The DEAE-cellulose elution curve of polysaccharides from RLF. The saccharides contents were detected by phenol-sulfuric acid method. RLFⅠwas eluted by distilled water, and RLFⅡwas eluted by 0~1 mol/L NaCl solution.
图1丝瓜络多糖的DEAE-cellulose洗脱曲线
2丝瓜络提取物的红外光谱分析结果
多糖物质的特征吸收峰分布于3 600~3 200 cm-1、3 000~2 800 cm-1、1 400~1 200 cm-1和1 200~1 000 cm-1这4个吸收区域。3 600~3 200 cm-1为O-H伸缩振动峰,3 000~2 800 cm-1吸收峰由C-H伸缩振动引起,1 400~1 200 cm-1的吸收峰由C-H的变角振动引起,1 200~1 000 cm-1是C-O的伸缩振动峰。
RLFⅠ和RLFⅡ的红外光谱结果如图2显示,在4个特征吸收区域都出现了吸收峰,说明RLFⅠ和RLFⅡ都是多糖类物质,都有O-H和C-H的伸缩振动峰。RLFⅠ在896.737 cm-1处有吸收峰说明含有 β-D-吡喃葡萄糖,RLFⅡ在1 100~1 010 cm-1和957.484 cm-1处均有吸收峰,说明RLFⅡ的单糖残基存在吡喃环和呋喃环。
3油红O染色法观察RLF提取物对3T3-L1 前脂肪细胞分化的影响
3T3-L1前脂肪细胞加诱导液(0.5 μmol/L IBMX、1 nmol/L Dex和10 mg/L insulin)及RLFⅠ或RLFⅡ处理,第8天进行油红O染色。如图3~4所示,与NC组相比,RLF Ⅰ处理组的成熟脂肪细胞分化率和脂肪细胞内甘油三酯的聚集明显下降,表明RLFⅠ具有抑制3T3-L1前脂肪细胞分化的功能。RLFⅡ处理的细胞与NC组相比,差异无统计学显著性。
Figure 2.Infrared absorption spectrum of RLF I and RLF II.
图2RLF的红外吸收光谱图
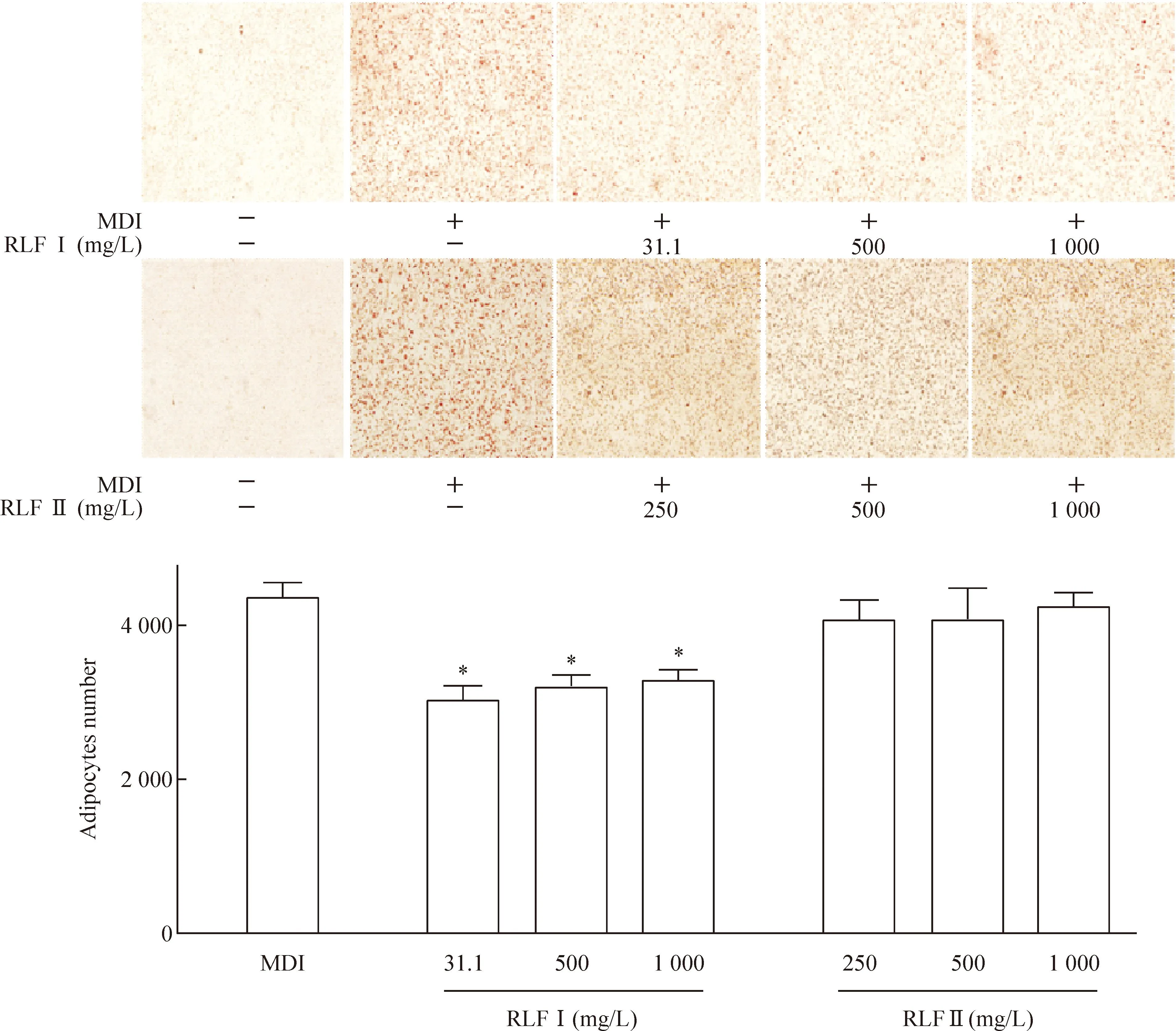
Figure 3.The effect of RLF on the differentiation of 3T3-L1 pre-adipocytes into adipocytes by MDI induction for 8 d (oil red O staining,×100). Mean±SD.n=5.*P<0.05vsMDI.
图33T3-L1前脂肪细胞诱导分化第8天的油红O染色观察脂肪细胞分化率
Figure 4.Triglyceride contents in 3T3-L1 pre-adipocytes induced by MDI for 8 d. Mean±SD.n=3.*P<0.05vsMDI.
图4RLFⅠ和 RLFⅡ对3T3-L1前脂肪细胞甘油三酯合成的影响
4RLFⅠ对脂肪细胞分化相关转录因子表达的影响
RT-qPCR 检测结果见图5。RLFⅠ处理 3T3-L1前脂肪细胞8 d后,脂肪细胞分化转录因子C/EBPβ、PPARγ和C/EBPα的mRNA表达量显著降低,差异有统计学显著性(P<0.05),表明RLFⅠ具有下调脂肪细胞分化过程中相关转录因子C/EBPβ、PPARγ和C/EBPα的作用。
Figure 5.The mRNA expression of C/EBPβ, PPARγ and C/EBPα in differentiated 3T3-L1 pre-adipocytes determined by RT-qPCR. Mean±SD.n=3.*P<0.05vsMDI.
图5RLFⅠ对3T3-L1前脂肪细胞分化调控基因表达的影响
讨论
肥胖症是一种由遗传因素、社会环境、个人行为等多种因素引起的慢性代谢性疾病,可诱发心脏病、2型糖尿病、阻塞性睡眠呼吸暂停等多种疾病,是全球最大的公众健康问题之一。利用药物防治肥胖,从而降低心脑血管等疾病的发病率,具有重要的临床意义。
肥胖症是由于体内能量的摄取和消耗不平衡,导致机体脂肪病理性堆积,从而引起机体组织功能障碍[7]。脂肪细胞的分化和脂肪的堆积与肥胖的发生和发展密切相关[8],控制脂肪细胞的增加(即控制前脂肪细胞分化为成熟脂肪细胞)和脂肪细胞内甘油三酯的过度聚集是治疗肥胖的关键点,也是药物作用的重要靶点[9-10]。本课题组前期研究发现丝瓜络具有降脂、抑制体重增加和抗氧化的功能,但起作用的活性成分和分子机制尚未清楚。
丝瓜络的化学成分有多肽、多糖、甙类(皂甙, 强心甙)、有机酸、蒽醌类、酚类、鞣质、黄酮、香豆素、萜内酯及生物碱等,其中多糖是丝瓜络的主要成分之一,具较高的含量[11]。本研究利用热水浸提法和DEAE-cellulose柱层析法提取分离得到RLFⅠ和 RLFⅡ,红外光谱分析确定这2个组份均为多糖类物质,并发现RLFⅠ中有吡喃环,RLFⅡ中存在吡喃环和呋喃环。多糖类物质具有抗肿瘤、免疫抑制、降血糖、降血脂、抗辐射等生物活性[12-13]。目前关于丝瓜络多糖的生物学效应研究较少,尚未见其参与调节脂质代谢方面的报道。
脂肪细胞的分化是伴随着严密组织性的有丝分裂过程。3T3-L1前脂肪细胞分化成脂肪细胞的过程中,甘油三酯水平显著升高,可根据油红O染色测定观察到此变化。本实验结果显示:RLFⅠ处理后,成熟脂肪细胞分化率明显下降,脂肪细胞甘油三酯的合成显著减少,表明RLFⅠ具有抑制3T3-L1前脂肪细胞分化效应。RLFⅡ对3T3-L1前脂肪细胞分化则无显著效应。随后,本研究观察了RLFⅠ对3T3-L1前脂肪细胞分化相关调控基因的影响。
脂肪细胞的分化过程由复杂的转录因子网络调控。主要包括过氧化物酶体增殖物激活受体γ(PPARγ)和CCAAT增强子结合蛋白家族(C/EBPs)两类转录因子。在分化早期,转录因子C/EBPβ首先被激活,在分化后期,相继激活PPARγ和C/EBPα,PPARγ和C/EBPα协同调控下游分化基因,促进脂肪合成[14]。有研究发现C/EBPβ敲除的小鼠存在轻度的脂肪组织发育缺陷。成熟脂肪基因组研究表明,在终末分化阶段,PPARγ 和C/EBPα占全部基因的60%。PPARγ是维持脂肪细胞终末分化的关键转录因子,敲除PPARγ后,这些分化细胞不能持续[15]。因此,可特异性调控转录因子C/EBPβ、PPARγ和C/EBPα表达的医药植物已成为治疗肥胖的目标[16-17]。本研究发现,在脂肪细胞分化过程中,RLFⅠ处理组C/EBPβ、PPARγ 和C/EBPα的mRNA表达量显著降低。500 mg/L的RLFⅠ对C/EBPβ的影响最明显,31.1 mg/L和500 mg/L的RLFⅠ对PPARγ 和C/EBPα mRNA下调作用最显著。
本研究结果表明,丝瓜络多糖提取物RLFⅠ具有脂代谢调控作用,RLFⅠ抑制3T3-L1前脂肪细胞分化的分子机制,可能是C/EBPβ基因表达下调,脂肪分化启动功能缺陷;PPARγ和C/EBPα基因表达下调,不能维持脂肪细胞的终末分化,最终减少脂肪细胞的合成。因此,丝瓜络多糖对于肥胖的防治具有一定应用价值和临床意义。
[参考文献]
[1]熊淑玲,方乍浦,曾宪仪. 丝瓜化学成分的分离与鉴定[J]. 中国中药杂志, 1994, 19(4): 233-234.
[2]关颖,李菁,朱伟杰, 等. 丝瓜络对小鼠心肌缺血性损伤的预防效应[J]. 中国病理生理杂志, 2006, 22(1):68-71.
[3]潘永勤,李菁,朱伟杰, 等. 丝瓜降血脂及抗氧化作用的实验研究[J]. 中国病理生理杂志, 2008, 24(5):873-877.
[4]李小玲,李菁,朱伟杰,等. 丝瓜络对高脂血症小鼠 LDL-R 基因表达的影响[J]. 中国病理生理杂志, 2009, 25(6):1156-1159.
[5]DuBois M, Gilles KA, Hamilton JK, et al. Colorimetric method for determination of sugars and related substances[J]. Anal Chem, 1956, 28(3): 350-356.
[6]Kwak DH, Lee JH, Song KH, et al. Inhibitory effects of baicalin in the early stage of 3T3-L1 preadipocytes differentiation by down-regulation of PDK1/Akt phosphorylation[J]. Mol Cell Biochem, 2014, 385(1-2):257-264.
[7]Jou PC, Ho BY, Hsu YW, et al. The effect ofMonascussecondary polyketide metabolites, monascin and ankaflavin, on adipogenesis and lipolysis activity in 3T3-L1[J]. J Agric Food Chem, 2010, 58(24):12703-12709.
[8]Feve B. Adipogenesis: cellular and molecular aspects[J]. Best Pract Res Clin Endocrinol Metab, 2005, 19(4):483-499.
[9]Jeon T, Hwang SG, Hirai S, et al. Red yeast rice extracts suppress adipogenesis by down-regulating adipogenic transcription factors and gene expression in 3T3-L1 cells[J]. Life Sci, 2004, 75(26):3195-3203.
[10]Blüher M. The distinction of metabolically ‘healthy’ from‘unhealthy’obese individuals[J]. Curr Opin Lipidol, 2010, 21(1):38-43.
[11]黎炎,李文嘉,王益奎,等. 丝瓜络化学成分分析[J]. 西南农业学报, 2011, 24(2):529-534.
[12]Yang W, Zhang H, Ji M, et al. Antitumor effect of a po-lysaccharide isolated fromPhellinuspullusas an immunostimulant[J]. Biomed Rep, 2016, 4(3):361-364.
[13]Qian L, Zhou Y, Ma JX. Hypolipidemic effect of the polysaccharides fromPorphyrayezoensis[J]. Int J Biol Macromol, 2014, 68:48-49.
[14]Feige JN, Auwerx J. Transcriptional coregulators in the control of energy homeostasis[J]. Trends Cell Biol, 2007, 17(6):292-301.
[15]Cristancho AG, Lazar MA. Forming functional fat: a growing understanding of adipocyte differentiation[J]. Nat Rev Mol Cell Biol, 2011, 12(11):722-734.
[16]Picard F, Kurtev M, Chung N, et al. Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-gamma[J]. Nature, 2004, 429(6993):771-776.
[17]Rayalam S, Della-Fera MA, Baile CA. Phytochemicals and regulation of the adipocyte life cycle[J]. J Nutr Biochem, 2008, 19(11):717-726.
(责任编辑: 林白霜,罗森)
Effects of Retinervus luffae fructus polysaccharides on differentiation of 3T3-L1 pre-adipocytes
LIU Zi-ping1, LI Jing1, ZHU Wei-jie2
(1DepartmentofPathophysiology,SchoolofMedicine,2SchoolofLifeScienceandTechnology,JinanUniversity,Guangzhou510632,China.E-mail:tlijing62@126.com)
[KEY WORDS]Retinervusluffaefructus; 3T3-L1 pre-adipocytes; Cell differentiation
[ABSTRACT]AIM: To observe the influence of polysaccharides extracted fromRetinervusluffaefructus(RLF) on the differentiation of 3T3-L1 pre-adipocytes and to investigate its mechanism. METHODS: DEAE-cellulose column was used to isolate and purify RLF. The effect of RLF polysaccharides on 3T3-L1 pre-adipocyte differentiation was determined by oil red O staining. The effect of RLF on the mRNA expression of differentiation-related factors C/EBPβ, PPARγ and C/EBPα was detected by RT-qPCR. RESULTS: Two components of polysaccharides named as RLFⅠand RLFⅡ were acquired by DEAE-cellulose column and identified as polysaccharides by infrared absorption spectrum. RLFⅠsignificantly reduced the differentiation of 3T3-L1 pre-adipocytes into the adipocytes and the content of triglyceride in the cells (P<0.05). No obvious effect of RLFⅡ was observed. Compared with control group, the mRNA levels of C/EBPβ, PPARγ and C/EBPα in RLFⅠgroup remarkably down-regulated (P<0.05). CONCLUSION: RLFⅠsignificantly inhibits 3T3-L1 pre-adipocyte differentiation into adipocytes. The mechanism might be related to the down-regulation of differentiation-associated factors C/EBPβ, PPARγ and C/EBPα.
[文章编号]1000- 4718(2016)06- 1071- 06
[收稿日期]2016- 03- 11[修回日期] 2016- 04- 29
*[基金项目]广东省中医药管理局资助项目(No. 20112108);国家中医药管理局三级实验室开放课题基金资助项目
通讯作者△Tel: 020-85220253; E-mail: tlijing62@126.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.06.019
