腹腔镜下早期胃癌节段切除术
2016-07-05牛备战孙曦羽肖毅
牛备战 孙曦羽 肖毅
·论 著·(临床实践)
腹腔镜下早期胃癌节段切除术
牛备战 孙曦羽 肖毅
目的 探讨胃节段切除在分化型早期胃癌手术中的可行性。方法 严格挑选2013年8月至2015年6月间4例中段早期胃癌病人,实施腹腔镜下胃节段切除并D1+或D2淋巴结清扫。观察淋巴结清扫数目、术后并发症等情况。结果 在清扫小弯侧淋巴结过程中没有保留迷走神经。远端切缘距离幽门4 cm以上,平均淋巴结获取数目为18.5枚。在术后1年内均存在胃排空缓慢的症状和影像学征像,1年后得到缓解。结论 经腹腔镜行早期胃癌节段切除在技术上安全可行,是否保留迷走神经有待于进一步的观察。
胃节段切除术;保留幽门胃切除术;早期胃癌
远端胃切除术、近端胃切除术、全胃切除术,联合D2淋巴结清扫是目前进展期胃癌的标准手术方式,随着早期胃癌检出率的上升,以保证根治性、降低手术创伤、提高术后生活质量(quality of life,QOL)和保存脏器功能为目的的缩小手术受到关注。对于分化型的早期胃癌病人,可以缩小淋巴结清扫范围。对于胃体部的早期胃癌,人们尝试着实施胃的节段切除(保留幽门)并清扫相应淋巴结,以期在保证肿瘤根治性切除的前提下,尽可能地保留病人生理功能。近年来腹腔镜下胃癌手术在国内得到广泛开展,国内参与或主导的临床试验也得到了相应的推广。但在早期胃癌手术方面,相关文献甚少,现对2013年8月至2015年6月间我院腹腔镜下早期胃癌节段切除术4例报告如下。
资料与方法
一、病例资料
例1,男性病人,56岁,饭后饱胀、反酸3年余;胃镜示:胃底体交界后壁可见2~2.5 cm凹陷,活检:腺体重度异型增生(高级别上皮内瘤变)。幽门螺杆菌C13呼气试验(+)。给予胃体黏膜病变内镜下黏膜切除术(endoscopic mucosal resection,EMR)或内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)。病理结果:(胃体)胃中分化腺癌,侵及黏膜下层,灶性侧切缘见高级别上皮内肿瘤,底切缘未见病变。辅助检查:肿瘤标志物(-);胸腹盆增强CT及胃三维重建:胃大弯、胃底-体交界处胃壁略增厚;胃小弯多发小淋巴结。ESD+EMR术后第3天病人感用力后右侧小腿疼痛,行双下肢静脉彩超示右侧肌间隙静脉血栓,抗凝治疗后右小腿疼痛逐渐缓解。
例2,男性病人,55岁,餐后上腹部饱胀不适,胃镜提示:胃底体交界后壁大弯侧可见线状瘢痕,周围黏膜皱襞中断、隆起,周围黏膜充血、水肿。病理:(胃底体交界大弯侧)胃黏膜高级别上皮内肿瘤,灶性浸润。超声胃镜检查提示:胃底体交界处黏膜病变,早期癌可能。
例3,女性病人,55岁,反酸、上腹胀20余年。多次胃镜提示:“慢性浅表性胃炎”;最近一次胃镜:胃体后壁见约0.5 cm大小微隆起,中心凹陷,活检3块,质软,易出血;胃窦黏膜红白相间,以红为主,未见糜烂及溃疡,余未见明显异常。病理:(胃体后壁)胃黏膜内见异性细胞浸润。免疫组织化学:低分化腺癌,部分为印戒细胞癌,Ki-67(index 50%),Her-2(++)。
例4,女性病人,55岁,上腹部隐痛不适伴呃逆、反酸4月余。胃镜所见:胃体中部大弯侧可见直径约1 cm Ⅱa+Ⅱc型黏膜病变,黏膜下层完整,活检2块。病理:胃体低分化腺癌,部分为印戒细胞癌。
二、手术方法
麻醉后,常规腹腔镜探查肝脏、盆腔、腹膜等是否存在转移种植病灶。
经术中胃镜定位,于病灶处胃壁外予以标记。紧贴结肠剪开胃结肠韧带,切除大网膜,游离胃大弯侧(剔除4sb、4d淋巴结);剔除胰腺被膜,剔除部分幽门下方的淋巴脂肪组织(第6组淋巴结),保留胃网膜右血管。提起胃体,沿胰腺被膜向头侧解剖、剔除第7、8组淋巴结;切断胃左血管主干;进一步剔除第9、11p组淋巴结。沿胰腺被膜向胰体尾方向解剖,显露脾血管在脾门区域的三个分支,并剔除其表面的淋巴脂肪组织。剪开肝胃韧带,沿贲门右向小弯侧剔除第1、3组和部分第5组淋巴结。用切割闭合器于肿瘤标记远近端各5 cm处切断胃体,镜下或体外进行胃体吻合重建消化道的通畅。
三、术后处理
术后第1天病人可下床活动,术后4 d开始少量饮水并逐渐过渡至流食,术后1周左右出院。
四、术后随访
手术后2年内每3~4个月复查,包括胸部X线、腹部超声、血癌胚抗原(CEA)、血癌抗原(CA)19-9,每年复查1次胸腹盆增强CT和胃镜检查。
结 果
一、术后病理结果
例1:(胃体黏膜病变ESD+EMR术后)胃黏膜显示急性及慢性炎伴中度肠化,局部可见溃疡,溃疡周黏膜层、黏膜下层及部分肌层内可见多核巨细胞反应,两断端及大网膜未见特殊;淋巴结未见转移癌(0/27)。
例2:早期胃癌(Ⅱb型,中-低分化腺癌),局灶侵及黏膜下层;上、下断端及另送远端胃切缘、远端胃未见癌;淋巴结未见转移癌(0/26);网膜(大网膜)组织未见特殊。免疫组化结果显示:AE1/AE3(+),ERCC 1(+),Her-2(+),β-tubulin(+),SMA(+)。
例3:早期胃癌(低分化腺癌,Ⅱb型),部分为印戒细胞癌,限于黏膜层,两侧断端及(大)网膜未见特殊,淋巴结未见转移癌(0/13)。免疫组织化学结果显示:AE1/AE3(+)。
例4:早期胃癌(Ⅱc型,印戒细胞癌),大部局限在黏膜内,小灶侵及黏膜下层,两切缘未见特殊;淋巴结未见转移癌(0/8)。
二、一般临床病理特征
4例病人术后定期至门诊随访,随访资料完整。均随访至2015年9月,在3~32个月的术后随访中,未见肿瘤复发或转移征象。在病人胃肠功能方面,3位随访时间超过1年的病人均主诉不同程度的餐后上腹饱胀、消化不良。术后1年胃镜复查均发现有食物残留;影像学检查提示均存在胃体积减小;其中1例还发现胃-食管反流,并有反酸症状。具体详细临床病理资料见表1。
讨 论
目前早期胃癌的治疗方法包括EMR[1-2]或ESD[3-4]、D1或D2根治术。根据日本胃癌规约,胃癌的淋巴结清扫范围主要根据疾病的临床分期,对于T1N0的病人可实施EMR或ESD、D1或D1+手术,而T2期以上或T1N+病人则建议接受D2手术。只有少数分化良好的T1a病人可以接受内镜下切除,除此之外均需接受不同程度淋巴清扫的根治性手术。但是对于早期胃癌,多数学者主张在达到根治的前提下,尽可能保证生活质量[5-6]。对于保留幽门的胃切除手术,日本胃癌治疗规约提出两种手术方式[7]:保留幽门的胃切除术(pylorus-preservinggastrectomy,PPG)和胃节段切除术(segmental gastrectomy,SG)。两种手术均报道于上世纪50、60年代,用以胃溃疡的外科治疗,以期减少倾倒综合征和反流的发生[8]。至90年代,随着日本早期胃癌的发现率增多,大家开始重视胃生理结构和功能保留,逐渐尝试保留迷走神经和幽门,这样可以减少消化道排空障碍、碱性反流、倾倒综合征、胆胰疾患、远期营养不良等并发症[9];文献中并未提及两种手术的具体差异[9]。用于早期胃癌手术[10],文献中报道的保留幽门或节段切除的适应证非常狭窄[11]:①肿瘤仅侵及黏膜下层,未侵及肌层;②病灶大小<3 cm;③无其他可疑病灶存在;④胃的近侧端切割线距离肿瘤上缘5 cm,远侧端切割线距离幽门括约肌胃侧缘4 cm;⑤胃中、下部节段切除。胃节段切除应该属于保留幽门手术的一种特定方式,两者之间差距不大,结合文献后将其列为表2[12-13]。
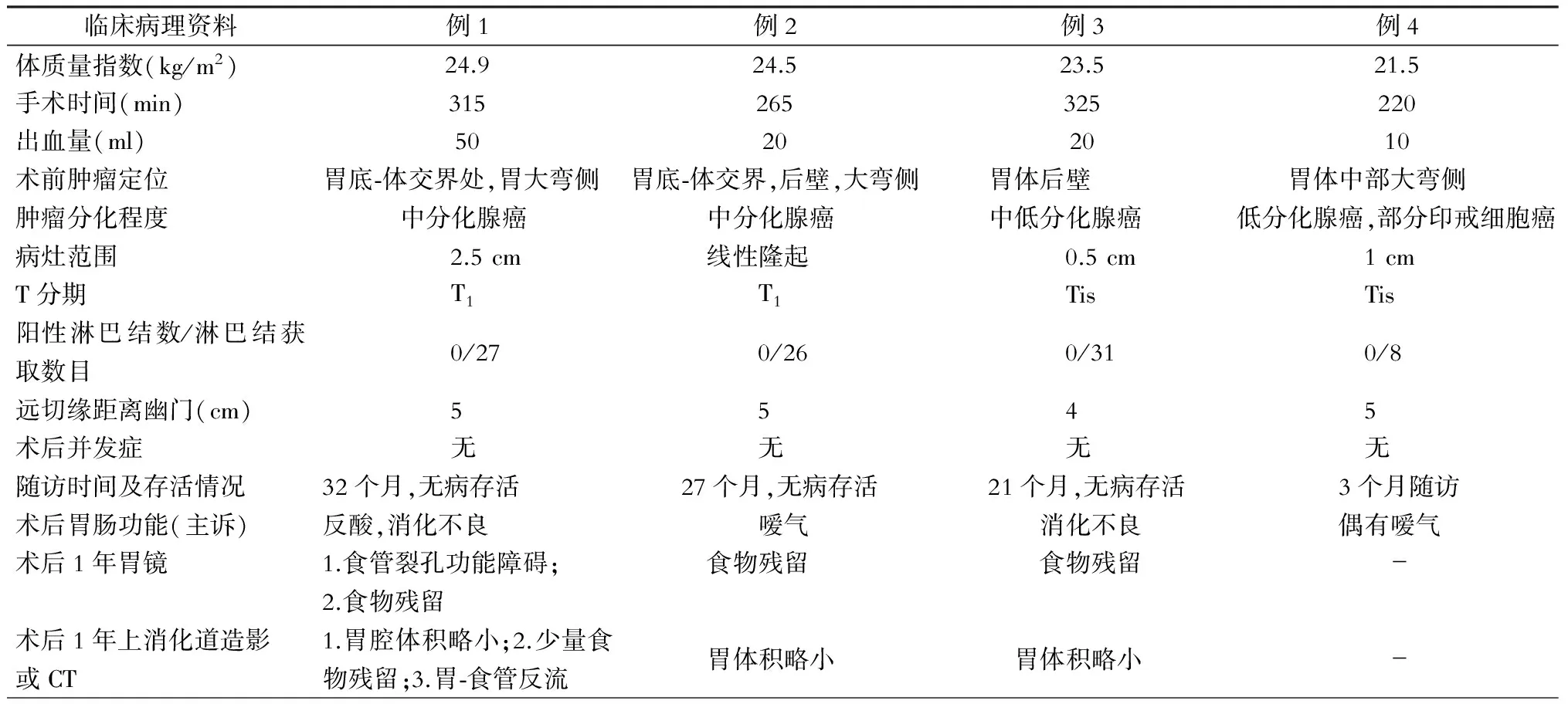
表1 4例早期胃癌病人的临床病理资料
我们的理解是,保留幽门手术适用于偏向幽门的胃中部癌,传统情况下是可以实施远端胃切除、毕Ⅰ式吻合;而节段切除更适用于中段胃癌,如果实施远端胃切除,则无法完成毕Ⅰ式吻合。
淋巴结廓清是胃癌根治术的核心,保留节段切除后远近端残余胃足够的血液供应是手术的重点。有文献认为[14-15],早期中段胃癌在幽门上下方的淋巴结转移率不足1%。因此在清扫幽门上下淋巴结的同时,可以保留胃右动脉和网膜右血管主干的完整性,以保障远端残余胃的血供。另外,在不影响淋巴结廓清的同时,能否保留迷走神经受到外科医生的关注。保留迷走神经的胃癌根治术对于临床医师的解剖知识掌握、手术技巧及熟练程度要求很高,难度较大。关于保留迷走神经的胃癌根治术的肿瘤学安全性与远期疗效,目前尚缺乏足够的循证医学结果,因此,还难以评价保留迷走神经的胃癌根治术的优劣。在我们的3例节段切除手术中,清扫第1、3组淋巴结时没有保留迷走神经。3例病人在术后随访中均存在不同程度的胃肠功能障碍,是否与迷走神经的去留有关,没有直接的证据支持。
鉴于胃节段切除手术的适应证,以及外科医生对其有限的接受程度,所以目前国内没有相关文献报道,我们严格掌握适应证的前提下,仅进行了4例的尝试。本组病例中,术前严格掌握手术适应证尤其是肿瘤部位的准确判断。术中淋巴结清扫按照D1+原则,肿瘤切缘掌握在4 cm以上,这样术后病理的淋巴结检出率和切缘基本能满足目前规范的要求。本组病例中均未保留迷走神经,病人在术后1年内均存在主观或客观的腹胀、消化不良、胃排空延缓等,可能与迷走神经的去留有关。

表2 两种手术方式的异同比较
我们选择实施胃节段切除的4例病人中,术前病灶定位均在胃体中部,如果行近端胃切除术,可能带来严重的食管反流;如行远端胃部分切除,可能无法行毕I式吻合,手术破坏了消化道原有的解剖结构,延长了手术时间,增加了手术风险,亦可能影响病人生活质量。遂决定实施节段切除术,术中实施了D1或D1+的淋巴结清扫,术后未出现吻合口漏、胃瘫、反流等并发症。达到了淋巴结获取的数目要求,未发生胃排空障碍。胃节段切除术与远端胃切除术比较,二者在手术难度上并无重大区别,这4例病人,均未出现严重并发症,提示这一手术方式安全可靠。
虽然,对早期胃癌实施胃节段切除术的开展较早,但是,目前并未得到广范的认可,文献报道还是很少,主要集中在日本。我们认为存在以下两点:其一,适应证非常局限,仅适合于胃体中部的早期胃癌,最好位于胃大弯侧;其二,保留迷走神经的必要性,术中既需剔除小弯侧淋巴结,还需保留迷走神经的肝支和腹腔支,这在手术技巧方面存在一定难度。也有文献认为,保留迷走神经对术后短期内胃功能的恢复有益,但远期效果差异不明显。
综上,对胃体部的早期胃癌采用腹腔镜技术行胃节段切除手术是安全可行的,但应严格掌握手术适应证。随着早期胃癌诊断率、淋巴转移术前评估准确率的提高、手术器械及技术改进,胃节段切除手术的应用可能会得到认可,但其远期效果尚有待于进一步临床验证。
1 Ono H.Early gastric cancer:diagnosis ,pathology,treatment techniques and treatment outcomes.Eur J Gastroenterol Hepatol,2006,18:863-866.
2 吴学队,沈静侠,王东江,等.内镜黏膜下剥离术治疗早期胃癌的可行性研究.实用肿瘤杂志,2015,30:398-400.DOI:10.3969/j.issn.1001-5930.2015.03.026.
3 Fujishiro M.Endoscopic dissection for gastric cancer.Curr Treat Options Gastroenterol,2008,11:119-124.
4 孙曦,张修礼,卢忠生,等.消化道早癌及癌前病变内镜下切除与外科手术切除的效价对比研究.中华消化内镜杂志,2013,30:15-17.DOI:10.3760/cma.j.issn.1007-5232.2013.01.006.
5 徐惠绵,黄宝俊.早期胃癌治疗的有关问题.实用肿瘤杂志,2008,23:193-196.
6 陈志红,张守亮,林建扬.保留幽门胃切除术治疗早期胃癌.中国普通外科杂志,2011,20:330-333.
7 Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gastric Cancer,2011,14:113-123.
8 Wangensteen OH. Segmental gastric resection for peptic ulcer; method permitting restoration of anatomic continuity. J Am Med Assoc, 1952,149: 18-23.
9 Furukawa H, Hiratsuka M, Imaoka S, et al. Phase II study of limited surgery for early gastric cancer: segmental gastric resection. Ann Surg Oncol, 1999,6:166-170.
10Sawai K,Takahashi T,Fujioka T, et al. Pylorus-preserving gastrectomy with radical lymph node dissection based on anatomical variations of the infrapyloric artery.Am J Surg,1995,170:285-288.
11Matsuda T,Kaneda K,Takamatsu M,et al.Segmental gastrectomy with radical lymph node dissection for early gastric cancer. World J Gastroenterol,2010,16:5347-5351.
12Lee SW,Bouras G,Nomura E,et al. Intracorporeal stapled anastomosis following laparoscopic segmental gastrectomy for gastric cancer: technical report and surgical outcomes.Surg Endosc,2010,24:1774-1780. DOI:10.1007/s00464-009-0803-x.
13Kumagai K, Hiki N, Nunobe S, et al. Totally laparoscopic pylorus-preserving gastrectomy for early gastric cancer in the middle stomach: technical report and surgical outcomes.Gastric Cancer,2015,18:183-187.DOI:10.1007/s10120-014-0337-3.
14Kong SH, Kim JW, Lee HJ, et al. The safety of the dissection of lymph node stations 5 and 6 in pylorus-preserving gastrectomy.Ann Surg Oncol,2009,16:3252-3258.DOI: 10.1245/s10434-009-0646-7.
15Kim BH, Hong SW, Kim JW, et al. Oncologic safety of pylorus-preserving gastrectomy in the aspect of micrometastasis in lymph nodes at stations 5 and 6. Ann Surg Oncol,2014,21:533-538.DOI: 10.1245/s10434-013-3252-7.
Laparoscopic segmental gastrectomy for early gastric cancer
NiuBeizhan,SunXiyu,XiaoYi.
DepartmentofGeneralSurgery,PekingUnionMedicalCollegeHospital,ChineseAcademyofMedicalSciences,Beijing100730,China
XiaoYi,Email:xiaoy@pumch.cn
Objective To explore the feasibility of segmental gastrectomy in differentiated early gastric cancer cases.Methods We selected 4 patients with differentiated early gastric carcinoma in middle of the stomach to perform laparoscopic gastric segmental resection with D1+ or D2lymph node dissection.Results After the operation, there were averagely 18.5 lymph nodes retrieved in each case, with the distal margin at 4 cm above pylorus. Within 1 year after the operation, patients had slow gastric emptying indicated by both clinical manifestation and imaging. The symptom recovered gradually after this year.Conclusions It is feasible and safe to perform laparoscopic segmental resection in patients with early-stage gastric cancer, although whether to keep the vagus during the operation remains further discussion.
Segmental gastrectomy; Pylorus-preserving gastrectomy; Early gastric cancer
100730 北京,中国医学科学院 北京协和医学院 北京协和医院基本外科
肖毅,Email:xiaoy@pumch.cn
R735.2
A
10.3969/j.issn.1003-5591.2016.05.011
2016-07-08)
