影响肝门部胆管癌术后生存质量的多因素分析
2016-07-05陈晓燕沈世强张爱民陈祖兵
陈晓燕 沈世强 张爱民 陈祖兵
·论 著·(胆道外科专题)
影响肝门部胆管癌术后生存质量的多因素分析
陈晓燕 沈世强 张爱民 陈祖兵
目的 综合分析肝门部胆管癌的临床分型、病理学特征及不同手术方式,探讨影响肝门部胆管癌术后预后的危险因素分析。方法 回顾性分析2006年6月至2013年3月武汉大学人民医院收治的76例肝门部胆管癌病人的临床资料。采用COX生存风险回归模型分析影响病人预后的危险因素。Kaplan-Meier法分析病人中位生存时间。结果 肝门部胆管癌术后病人1、2、3年生存率分别为88%、72%和41%,中位生存时间为21个月。COX回归模型分析显示肿瘤分型、手术方式、淋巴结转移和癌抗原(CA)199水平是影响肝门部胆管癌预后的独立危险因素。结论 肝门部胆管癌的预后与肿瘤分型、手术方式、CA199水平和淋巴结转移等密切相关。扩大淋巴结清扫及根治性手术方式是提高病人生存率的关键。
肝门部胆管癌;生存分析;预后因素
肝门部胆管癌(hilar cholangiocarcinoma,HC)是指胆总管起始部以上的肝外胆管癌包括左、右肝管及其汇合部和肝总管。该病起病隐匿,恶性度高,发病率有逐年增高的趋势,手术完整切除肿瘤并保证切缘阴性是这一疑难疾病唯一有效的治疗方法[1]。肝门部胆管癌可在肝内胆管树、邻近肝实质和血管、区域淋巴结和神经丛中浸润转移,使得对可切除率、切除的范围判断较为困难,从而对术前评估、治疗方案和预后均会产生影响。近年来随着影像学的进步和外科手术技术的提高,使得治疗效果有所提升[2-3]。本研究回顾性分析于我院施行肝门部胆管癌根治性切除术的76例病人,运用COX模型分析影响其预后的危险因素,为临床治疗和评估提供参考。
资料与方法
一、临床资料
2006年6月至2013年3月我院收治的76例肝门部胆管癌病人,术后病理均证实为肝门部胆管腺癌。其中男性34例,女性42例,平均年龄为63.4岁(37~75岁)。按照Bismuth分型将所有肝门部胆管癌病人进行分型如下:Ⅰ型7例(9.2%),Ⅱ型11例(14.4%),Ⅲa型22例(28.9%),Ⅲb型27例(35.5%),Ⅳ型9例(11.8%)。按照美国癌症联合委员会(AJCC)肝外胆管癌分期(第六版)将所有病例进行分期如下[4]:ⅠA 5例,ⅠB 11例,ⅡA 26例,ⅡB 31例,Ⅲ3例。病人及家属术前均签署手术知情同意书。
二、手术方式
76例病人均切除原发肿瘤病灶,其中术前有超过4周梗阻性黄疸合并活动性肝炎拟行联合肝段切除或者半肝切除的病人先行减黄处理;手术方式:Ⅰ型仅行单纯肝外胆管切除,Ⅱ型为肝十二指肠韧带骨骼化清扫,胆管空肠吻合术;Ⅲa型:行病变胆管及左半肝切除术,肿物侵犯尾状叶者联合尾状叶切除,右肝管空肠吻合;Ⅲb型采用右半肝肝门部不规则肝组织切除,肝门部肝管整形后行肝管空肠吻合,合并尾状叶侵犯者切除尾状叶;Ⅳ型行肝门部不规则肝肿瘤切除、切除或保留左半肝,合并可疑门静脉侵犯者切除部分门静脉并送快速冰冻切片[5]。术后给予保肝利胆、抗感染、营养支持治疗。
三、随访情况
主要采用门诊复查、电话给予规律随访。随访时间计算的起止点为手术当日至2016年3月。
四、统计学方法
采用SPSS(20.0版)统计学软件包进行分析,生存率采用Kaplan-Meier法计算,将病人的一般情况、手术方式和术后病理等因素作为研究因子并分别赋值,进行相关性研究;同时采用COX生存风险回归模型分析影响病人预后的危险因素。P<0.05为差异具有统计学意义。
结 果
一、术后并发症
76例肝门部胆管癌病人有8例出现并发症,其中包括胆瘘3例,肺部感染2例,腹腔感染2例,肝衰竭1例,有1例病人住院期间死于上述并发症。不同手术方式在围手术期并发症发生率比较差异无统计学意义(P>0.05)。
二、术后生存分析
Kaplan-Meier分析结果显示,病人术后生存时间为8~42个月,中位生存时间为21个月,术后6、12、24及36个月病人生存率分别为97%、88%、72%和41%,生存时间曲线显示随着时间延长,病人累积生存率下降。如图1所示。

图1 病人生存时间累积曲线
三、生存相关因素
单因素分析结果见表1,结果显示,年龄、性别、血总胆红素水平、分化程度、神经侵犯和肝实质侵犯与病人的术后生存时间无相关性(P>0.05),而术前癌抗原(CA)199水平、门静脉是否侵犯、尾状叶是否切除和淋巴结转移是影响病人术后生存时间的相关因素(P<0.05)。

表1 影响病人生存的单因素相关分析
四、COX回归模型分析
结果显示:肿瘤分型、淋巴结转移、手术方式和CA199水平是影响肝门部胆管癌病人预后的独立因素(P<0.05)。而肿瘤分化程度并不是影响病人预后的独立因素(P>0.05)。见表2。
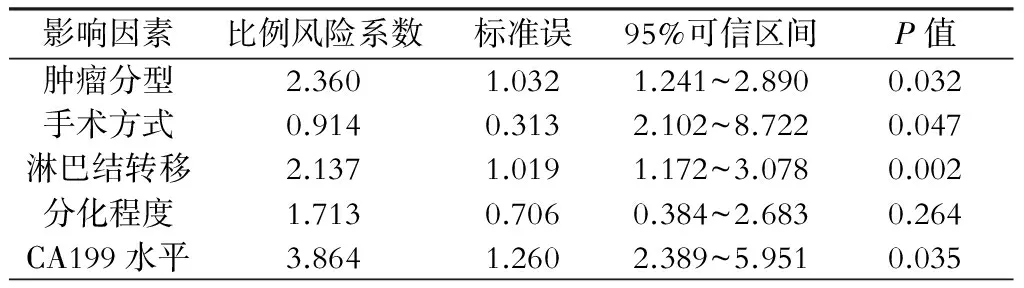
表2 影响病人预后的多元回归分析
讨 论
肝门部胆管癌占肝外胆管癌的58%~75%[6]。其生长、扩散特点主要包括:①胆管黏膜下层沿着胆管纵向扩散,且向肝侧胆管浸润范围明显大于十二指肠方向。②胆管的透壁性浸润和向胆管周围组织及邻近组织的放射状扩散,如肝动脉、门静脉等易受侵犯,同时造成淋巴结转移和神经侵犯[7]。由于解剖关系复杂、恶性度高,起病隐匿,早期诊断率低,当病人出现黄疸时,病变往往发展为中晚期,手术切除率低。本研究Kaplan-Meier分析结果显示,病人术后生存时间为8~42个月,中位生存时间为21个月,术后6、12、24及36个月病人生存率分别为97%、88%、72%和41%。由于影像学技术的发展,以及对肝门脉管结构的评估、肿瘤侵犯范围的判断、预留剩余肝组织储备功能的评估、手术方式的规划等关键问题的认识提高,根治性切除率在逐年增高。因此,我们进一步调查病人术后的生存质量,并研究影响生存质量的相关因素,最终实现病人最佳康复目标。
肝门部胆管癌临床分型较多,但临床最常用的方法为Bismuth-Corlette分型,此分型可以了解肿瘤侵犯胆管的部位并决定手术切除的方式和范围。对于合并黄疸病人术前胆道引流是一个有争论的问题,目前缺乏大样本前瞻随机对照研究。Gouma等[8]对366例肝门部胆管癌病人分析认为术前减黄治疗不会影响病人预后。1项涉及711例肝门部胆管癌病人术前行减黄治疗价值的Meta分析显示,其术后住院时间、并发症和感染率与没有减黄治疗病人相比并没有显著差异[9]。黄志强院士建议在实施广泛肝切除或不宜早期手术且血总胆红素>400 μmol/L时才行减黄治疗[10 ]。笔者认为对于黄疸时间长,营养不良和肝功能较差的病人,术前胆道引流可以降低血总胆红素,提高肝功能储备,纠正凝血功能,减少术后胆瘘,改善病人一般状况并提高肝脏再生能力,同时可以行胆道造影评估胆管受累程度。国内专家认为对于拟行≥3~4个肝段切除或存在胆道感染病人,合并肝硬化、活动性肝炎、持续黄疸超过4周者建议行术前减黄治疗,使得血总胆红素降至50 μmol/L[11]。本研究将可能影响肝门部胆管癌生存期的15个预后因素进行相关性分析,结果发现只有术前CA199水平、术中门静脉浸润、尾状叶有无切除和术后淋巴结转移等有相关性,并直接影响病人预后。术前血总胆红素水平并无明显影响,表明其只提高手术安全性并不影响病人预后,而要达到R0切除须同时进行规范化区域淋巴结骨骼化清扫[12]。
而CA199是否预测肝门部胆管癌病人的预后仍然难以确定,有些研究对其判断预后得出截然相反结果。Saxena等[13]报道CA199与肝门部胆管癌预后无关,而国内有学者认为CA199水平有助于决定病人的预后[10,14]。我们将所有单因素分析中有统计学意义的因素行多元回归分析,结果显示:肿瘤分型、手术方式、淋巴结转移和CA199水平是影响病人预后的独立相关因素(P<0.05)。而淋巴结转移被是公认的影响病人预后的独立影响因素[10-11,14-15]。对于Ⅲb型和Ⅳ型肝门部胆管癌合并门静脉侵犯,应当联合左半肝+尾状叶切除,如门静脉右支与肿瘤分界不清应行部分切除并做修补或吻合,否则会产生残留和复发,注意避免肝动脉损伤,否则会影响胆肠吻合口的愈合。
综上所述,肿瘤分型、手术方式、淋巴结转移和CA199水平是影响肝门部胆管癌预后的独立危险因素。CA199是病人术后常规复查指标,其升高或降低密切影响着每一位病人的心理情绪。根治性手术切除和淋巴结清扫是影响病人预后的关键。
1 Izbicki JR, Tsui TY, Bohn BA,et al.Surgical strategies in patients with advanced hilarcholangiocarcinoma(klatskin tumor).J GastrointestSurg, 2013,17:581-585. DOI: 10.1007/s11605-012-2109-x.
2 Jarnagin WR, Fong Y, DeMatteo RP,et al. Staging,resectability, and outcome in 225 Patients With Hilar Cholangiocarcinoma.Ann surg, 2001, 234:507-519.PMCID:PMC1422074.
3 CIary B, Jarnigan W, Pitt H, et al. Hilar Cholangiocarcinoma. J GastrointestSurg,2004,8:298-302. DOI:10.1016/j.gassur.2003.12.004.
4 Edge SB, Compton CC. The American Joint Committee on Cancer: the 7thedition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol,2010,17:1471-1474. DOI:10.1245/s10434-010-0985-4.
5 中华医学会外科学分会胆道外科学组. 肝门部胆管癌诊断和治疗指南. 中华外科杂志,2013,51:865-871. DOI:10.3760/cma.j.issn.0529-5815.2013.10.001.
6 Freeman ML, Sielaff TD. A modern approach tomalignant hilar biliary obstruction.Rev Gastrornterol Disord,2003,3:187-201.PMID:14668691.
7 王林,耿智敏,宋晓刚,等.联合精准半肝切除治疗肝门部胆管癌。中华消化外科杂志,2013,12:204-209. DOI: 10.3760/cma.j.issn.1673-9752.2013.03.011.
8 Gouma DJ. Multicentre European study of preoperative biliary drainage for hilarcholangiocarcinoma.Br J Surg,2013,100:274-283. DOI: 10.1002/bjs.8977. No abstract available.
9 李慧丽,郑红梅,周武华,等. 术前胆道引流对肝门部胆管细胞癌治疗作用的Meta分析.实用癌症杂志,2015,30:220-224.DOI:10.3969/j.issn.1001-5930.2015.02.020.
10黄志强.肝门部胆管癌外科值的现状与展望.中国普外基础与临床杂志,2005,12:317-320. DOI:10.3969/j.issn.1007-9424.2005.04.001.
11中国抗癌协会.肝门部胆管癌规范化诊治专家共识(2015).中华肝胆外科杂志,2015,21:505-511. DOI:10.3760/cma.j.issn.1007-8118.2015.08.0019.
12Miyazaki M1, Ohtsuka M, Miyakawa S,et al. Classification of biliary tract cancers established by the Japanese Society of Hepato-Biliary-Pancreatic Surgery: 3(rd) English edition. J Hepatobiliary Pancreat Sci, 2015,22:181-96.DOI: 10.1002/jhbp.211.
13Saxena A, Chua TC, Chu FC, et al. Improved outcomesafteraggressive surgicalresection of hilar cholangiocarcinoma: a criticalanalysisof recurrenceand survival. Am J Surg,2011,202:310-320.DOI: 10.1016/j.amjsurg.2010.08.04.
14朱倩,乔国梁,宴建军,等.可切除肝门部胆管癌以后影响因素分析.中华肝胆外科杂志,2014,20:662-666.DOI:10.3760/cma.j.issn.1007-8118.2014.09.011.
15Taniguchi K, Tabata M, Iida T,et al. Significance of lymph node micrometastasis in pN0 hilar bile duct carcinoma. Eur J Surg Oncol,2006,32:208-212.DOI:10.1016/j.ejso.2005.11.006.
Multivariate analysis of survival risk factors in patients with portal hilar cholangiocarcinom
ChenXiaoyan,ShenShiqiang,ZhangAimin,ChenZubing.
DepartmentofHepatobiliarySurgery,RenminHospitalofWuhanUniversity,Wuhan430060,China
ShenShiqiang,Email:swsw2218@hotmail.com
Objective To analyze the clinical typing and pathologic characteristics of hilar cholangiocarcinoma (HC) and surgical strategies on hilar cholangiocarcinoma (HC), and to investigate the risk factors influencing survival of patients with porta hepatic cholangiocarcinoma excised.Methods The clinical data were retrospectively analyzed in 76 cases of HC admitted into our hospital from Jun. 2006 to Mar. 2013. Suivival risk factors were analyzed with COX regression model, and survival time was analyzed with Kaplan-Meier test.Results Of the HC patients, the mean survival time was 21 months, the 1-, 2- and 3-year survival rate was 88%, 72% and 41% respectively. The multivariable analysis revealed that the clinical typing of tumor, operative approach, lymph node metastasis and CAl9-9 levels were independent prognostic factors of survival for HC (P<0.05).Conclusions The prognosis of HC correlates with the clinical typing of tumor, operative approach, CAl9-9 levels, and lymph node metastasis. Curative resection including extended radical resection of lymph nodes carries the best effects that can prolong survive.
Hilar cholangiocarcinoma; Survival data analysis; Prognostic factors
430060 武汉,武汉大学人民医院肝胆腔镜外科
沈世强,Email:swsw2218@hotmail.com
R735.8
A
10.3969/j.issn.1003-5591.2016.05.005
2016-09-01)
