高考中元素周期表的考法
2016-07-04甘肃彭富国
◇ 甘肃 彭富国
高考中元素周期表的考法
◇甘肃彭富国
元素周期表是学习化学的工具,元素周期律则是化学学习的重要规律.利用元素周期表、元素周期律,结合元素“位、构、性”三者的密切关系进行元素和物质推断是学习化学的重要方法.尽管这部分知识学习起来比较容易,但具体运用时却能感觉有一定难度,常常不能得分或不能得高分.有必要对这部分知识的学法、考法和解题方法进行分析总结,通过分析高考题,总结出元素周期表和周期律的考查方式主要有以下3种.
1文字描述型
这种题型在选择题和简答题中都有体现,其特征是以字母和文字等化学用语描述元素及其化合物的性质、用途、特殊结构、特殊反应等,然后要求考生通过分析相关内容,对所给的问题作出正确的判断.要能快速准确解答这类题目,首先要求考生对元素周期表的编排要很熟悉;其次对特殊元素(如H、Na、O、S、F、Cl、Si、Al、C等)易考、常考的知识必须掌握熟练;再次对元素周期律必须很熟练(同周期同主族电子层数、原子离子半径、得失电子难易、金属性非金属性、单质的氧化性还原性、最高价氧化物对应水化物的酸碱性、气态氢化物的稳定性等).

A单质的沸点:W大于X;
B阴离子的还原性:W大于Z;
C氧化物的水化物的酸性:Y小于Z;
DX与Y不能存在于同一离子化合物中
分析首先“W、X、Y、Z均为短周期主族元素,原子序数依次增加”这句话定位了这些元素在短周期,原子序数依次增加则为后续确定每种元素的具体位置给出了一定依据,再根据L层电子数可知,W、X分别是第一和第二周期主族的H和N,Y、Z为第三周期元素,又根据它们最外层电子数之和为18,可知Y、Z分别为S、Cl.
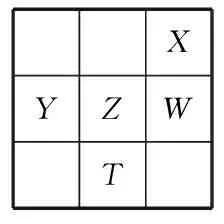
2部分元素周期表型
这种题目往往是将元素的关系以一部分元素周期表的形式给出,这类题目既要求学生对元素周期表这一基本化学工具要熟练,也考查了“位、构、性”的关系,既有推理又有计算,是多年来的常考题型.高考命题中常将将元素周期表、元素周期律与元素性质结合进行考查,有时还会结合相应物质的性质和制备方法,是高考经典和必考题型.考查的知识点有原子半径、氢化物稳定性、晶体类型及作用力、氧化还原反应、元素周期表的应用等.

AX、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增;
BY、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增;
XYZWT
图1
CYX2晶体熔化、液态WX3气化均需克服分子间作用力;
D根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
分析从表中位置关系可看出,X为第二周期元素,Y为第三周期元素,又因为X、W同主族且W元素的核电荷数为X的2倍,所以X为O元素、W为S元素;再根据元素在周期表中的位置关系可推知Y为Si元素、Z为P元素、T为As元素.O、S、P的原子半径由大到小顺序为P、S、O,3种元素的气态氢化物的热稳定性由强到弱顺序为H2O、H2S、PH3,选项A不正确.在火山口附近或地壳的岩层里,常常存在游离的S元素,选项B不正确.SiO2晶体为原子晶体,熔化时需克服的微粒间作用为共价键,选项C不正确.As在元素周期表中位于金属和非金属的交界线附近,具有半导体的特性,As2O3中As为+3价,处于中间价态,所以具有氧化性和还原性,选项D正确.
3图标数据型

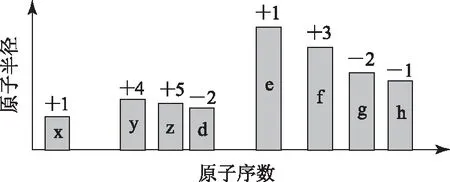
图2
根据判断出的元素回答问题:
(1)f在元素周期表的位置是________.
(2) 比较d、e常见离子的半径的大小(用化学式表示,下同)________;比较g、h的最高价氧化物对应的水化物的酸性强弱是________.
(3) 任选上述元素组成一种四原子共价化合物,写出其电子式________.
(4) 已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式________.

图3
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化如图3.
①R离子浓度由大到小的顺序是____________.
② 写出m点反应的离子方程式__________.
③ 若R溶液改加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________mol.
分析本题将元素的判断、元素在周期表中位置的判断、原子半径与元素化合价规律的应用、元素周期律的应用、酸性的比较、电子式的书写、热化学方程式的书写、电解质溶液中离子浓度的比较、对图象的分析理解、离子方程式的书写、物质的量的有关计算等有机地结合起来,从化学用语到元素周期表和元素周期律的应用,再到化学反应原理的应用,层层递进,逐步加大难度,考查了考生综合分析问题、解决问题的能力.考生要针对每个知识点根据所学知识进行解答,如溶液中离子浓度比较的问题,抓住溶液的酸碱性,水解程度与电离程度的相对强弱进行判断;电子式的书写中应注意物质的类别,根据离子化合物、共价化合物、单质的电子式的不同进行书写;离子半径的比较应掌握电子层数、质子数、核外电子数决定简单离子半径的顺序进行逐一判断.在解决元素周期表和元素周期率相关问题时要具备一些熟悉的基础知识,才能做到知识应用的融会贯通.
(作者单位:甘肃省民乐县第一中学)
