香菇工厂化栽培中常见霉菌的分离鉴定及抑菌剂筛选
2016-07-02朱晓玲章炉军张俊玲尚晓冬
朱晓玲,章炉军,张俊玲,谭 琦,尚晓冬*
(1上海市农业科学院食用菌研究所/国家食用菌工程技术研究中心,上海201403;2南京农业大学生命科学学院,南京210095)
香菇工厂化栽培中常见霉菌的分离鉴定及抑菌剂筛选
朱晓玲1,2,章炉军1,张俊玲1,谭 琦1,2,尚晓冬1*
(1上海市农业科学院食用菌研究所/国家食用菌工程技术研究中心,上海201403;2南京农业大学生命科学学院,南京210095)
摘 要:为了明确香菇工厂化栽培中污染霉菌的优势种,对分离的49株常见霉菌进行鉴定,并针对优势种进行抑菌剂试验,筛选出绿色高效的抑菌剂。显微形态鉴定和ITS序列分析的鉴定结果表明:香菇工厂化栽培培养料中的霉菌优势种有:哈茨木霉、侧耳木霉、深绿木霉、短密青霉和总状毛霉,其分离频率分别为57%、25%、4%、6%和8%。H2O2、中生菌素和克霉灵对除短密青霉外的4种霉菌的菌丝抑制效果由强到弱依次为:H2O2、中生菌素和克霉灵,对5种霉菌的孢子萌发抑制作用由强到弱依次为:H2O2、中生菌素和克霉灵;这些抑菌剂中,H2O2的安全性最高,中生菌素次之。为制定香菇工厂化污染霉菌优势种的控制方案提供参考。
关键词:香菇;工厂化栽培;霉菌;鉴定;抑菌剂
目前,香菇栽培模式亟待转型升级,设施和工厂化栽培受到越来越多的关注,也掀起了香菇工厂化栽培研究的热潮,其中尤以香菇工厂化压块模式最受关注。霉菌污染一直是香菇工厂化压块模式中需要重视的的问题,污染会发生在栽培的任何时期,发菌期是菌块最易受到霉菌侵染的时期,严重的霉菌污染会给栽培带来巨大损失甚至绝收[1]。其中,尤以木霉污染最为严重[2],木霉可通过溶壁、缠绕等方式作用香菇菌丝细胞壁[3],并产生毒素抑制菌丝的生长[4-5]。青霉和毛霉亦有分解有机物和产生毒素的能力[6],与香菇菌丝竞争营养与水分。近年来,国内外相关研究人员针对霉菌污染问题进行了相关报道,覃培升等[7]对平菇栽培料中的木霉、青霉特性进行了研究,王刚正等[8]研究了植物提取液对食用菌中木霉菌的抑制作用,Park等[9]利用分子标记分析平菇中的污染杂菌,Johanna等[10]研究了木霉的生长特性,但目前还未有关于防控香菇工厂化栽培中的污染菌的研究。在霉菌的防控方面,使用农药造成的药剂残留会对人体、环境等产生诸多危害。因此,本研究对引起香菇工厂化栽培料污染的杂菌进行分离鉴定,并进行抑菌剂筛选,旨在找出污染霉菌优势种,筛选出绿色高效的抑菌剂,为制定控制方案提供科学参考。
1 材料与方法
1.1材料
1.1.1试剂
乳酸酚棉蓝染色液(卓越生物实验器材),40%克霉灵可湿性粉剂(湖北省随州市随缘食用菌消毒剂厂),3%中生菌素可湿性粉剂(深圳谱诺信农化股份有限公司),30%H2O2(国药集团化学试剂有限公司)。
1.1.2供试香菇菌株
香菇‘申香F2’(Lentinula edodes‘Shenxiang F2’),上海市农业科学院食用菌研究所选育。
1.1.3培养基
PDA培养基:去皮土豆200 g,葡萄糖20 g,琼脂20 g,加蒸馏水定容至1 000 mL。
PDB培养基:去皮土豆200 g,葡萄糖20 g,加蒸馏水定容至1 000 mL。
1.2霉菌的分离鉴定
1.2.1样品采集
上海国森生物技术公司香菇工厂化栽培菇房中,在栽培瓶中发满并经过一段时间后熟期的培养料,重新压块后被杂菌侵染,从25块受污染的压块上随机采集污染菌块,4℃冰箱中保存备用。
1.2.2分离纯化
从采集的菌块上挑取霉菌孢子,25℃,PDA平板上培养3 d,待长出菌落后立即纯化培养[11],纯化2—3次,纯化菌株依次编号。
1.2.3形态学鉴定
25℃避光条件下,PDA平板上倒置培养3—7 d,观察描述菌落特征。与此同时,待菌落上可以观察到明显的绿色孢子时,挑取菌丝制片,用乳酸酚棉蓝染色液染色,根据分生孢子梗的形态特征及分生孢子的形态大小进行鉴定[12-14]。
1.2.4ITS序列分析
用特制接种针将霉菌菌块接种于装有100 mL PDB培养基的250 mL三角瓶中,25℃,120 r/min振荡培养3 d。挑取适量菌丝于研磨管中,冷冻干燥12 h,研磨充分,然后用CTAB[15-16]提取总DNA。PCR扩增,真菌通用引物对为ITS1:5’-TCCGTAGGTGAACCTGCGG-3’和ITS4:5’-TCCTCCGCTTATTGATATGC-3’;扩增程序为:94℃3 min,94℃1 min,60℃1 min,72℃1 min,35个循环,72℃10 min。扩增产物经1.5%琼脂糖凝胶电泳,EB染色,在凝胶成像系统上观察并记录结果。PCR扩增产物交送生工生物工程股份有限公司完成测序。
1.2.5构建系统发育树
根据步骤1.2.4的测序结果,利用NCBI数据库进行同源性对比,鉴定到种[17]。GeneBank中下载已知序列与测得的序列进行比对,利用MEGA 5.10计算菌株之间的遗传距离,构建系统发育树。
1.3抑菌剂的筛选
选取克霉灵、中生菌素、H2O23种抑菌剂,从霉菌、香菇菌丝和孢子的抑制效果考察3种抑菌剂的抑制作用。
1.3.1菌丝生长抑制作用的测定
3种抑菌剂用无菌水配制成各种不同浓度的母液,加入灭菌后冷却至50℃左右的PDA培养基中,充分摇匀后倒入培养皿中制成平板,以培养基中加等量无菌水作为对照。克霉灵、中生菌素、H2O2的试验浓度范围分别为:40—2560 mg/L、1.05—67.2 mg/L、0.1—6.4 mg/L,各7个梯度,2倍浓度梯度差。

1.3.2孢子萌发抑制作用的测定
采用凹玻片悬滴法[1]测定3种抑菌剂对霉菌孢子萌发的抑制作用,每隔4 h镜检1次,当空白对照组中的孢子萌发率达到90%以上时,统计各试剂处理组孢子萌发情况。3种抑菌剂的试验浓度范围与菌丝抑制试验相同。

1.3.3数据处理
将抑制率转化为几率值,浓度转化为对数值,利用SPSS 19.0软件进行数据分析,得到毒力回归方程,求出EC50和EC90,比较几种杀菌剂的抑制效果。
2 结果与分析
2.1形态学鉴定
经分离、纯化等步骤共获得49株霉菌,从1—49依次编号,形态学鉴定初步将分离到的49株霉菌菌株划分为5个种,分别为哈茨木霉、侧耳木霉、深绿木霉、总状毛霉、短密青霉。污染往往不是单一的,同一污染压块上有2—3种霉菌并存。5种霉菌的形态学鉴定结果如下:
哈茨木霉(T.harzinum):生长迅速,菌落生长初期呈绒毛状,有明显的同心圆环状产孢区,随着菌丝的老熟,颜色由淡绿色变为暗绿色,培养基反面同色。菌丝有隔膜,分生孢子梗呈树状,有二级分支,瓶状小梗基部细,中间膨大,顶部变细。分生孢子呈球状,由小梗相继生出,孢子直径2—3 μm(图1)。
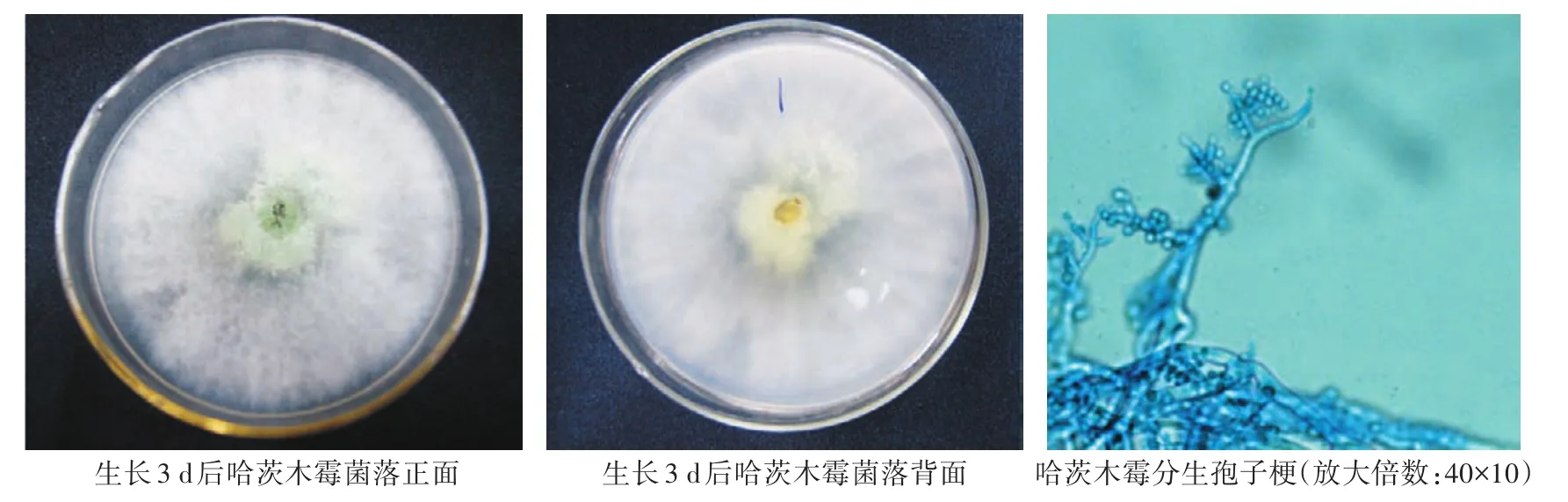
图1 哈茨木霉培养皿上着生状态及显微形态观察Fig.1 Status on culture dish and microstructure morphology of T.harzinum
侧耳木霉(T.pleuroticola):菌丝长速快,生长初期菌丝呈棉絮状,菌丝致密平坦,有明显的同心圆产孢区,颜色随着菌丝老熟由淡黄色最后转化为深黄绿色,培养基背面呈黄色。菌丝有隔膜,分生孢子梗有三级分支,对生。分生孢子呈球状,由小梗顶端相继生出,孢子直径2—3 μm(图2)。
深绿木霉(T.atroviride):生长速度慢于哈茨木霉和侧耳木霉,菌丝呈絮状,新生长的产孢区为白色,老产孢区为深绿色,菌落反面无色或呈淡黄色。菌丝有隔膜,分生孢子梗有分枝,对生或互生,瓶梗细长,呈窄安瓿形,树状排列。分生孢子呈球状或椭球状,由小梗顶端相继生出,孢子直径为2—3 μm(图3)。
短密青霉(P.brevicompactum):菌丝生长不蔓延,为局限性菌落,中央厚,凸起,质地呈绒状,有辐射状沟纹,外层新生菌丝白色,中央产孢区由淡青色转为青灰色,反面同色。菌丝有隔膜,分生孢子梗顶端膨大,帚状,二级或三级分支,瓶梗呈安瓿形,排列紧密。分生孢子球形或椭球形,孢子直径为2—3 μm(图4)。
总状毛霉(M.racemosus):菌丝生长速度快,在培养基上可长到1—2 cm高,初期呈绒毛状,颜色为白色,后期变为淡褐灰色,部分菌丝上生长出褐色孢子。培养基反面为淡褐灰色。菌丝无隔膜,孢子梗总状分枝,孢子囊为椭球形,成熟时孢子囊壁消解,释放孢子,孢子呈近球形,无假根和囊托(图5)。
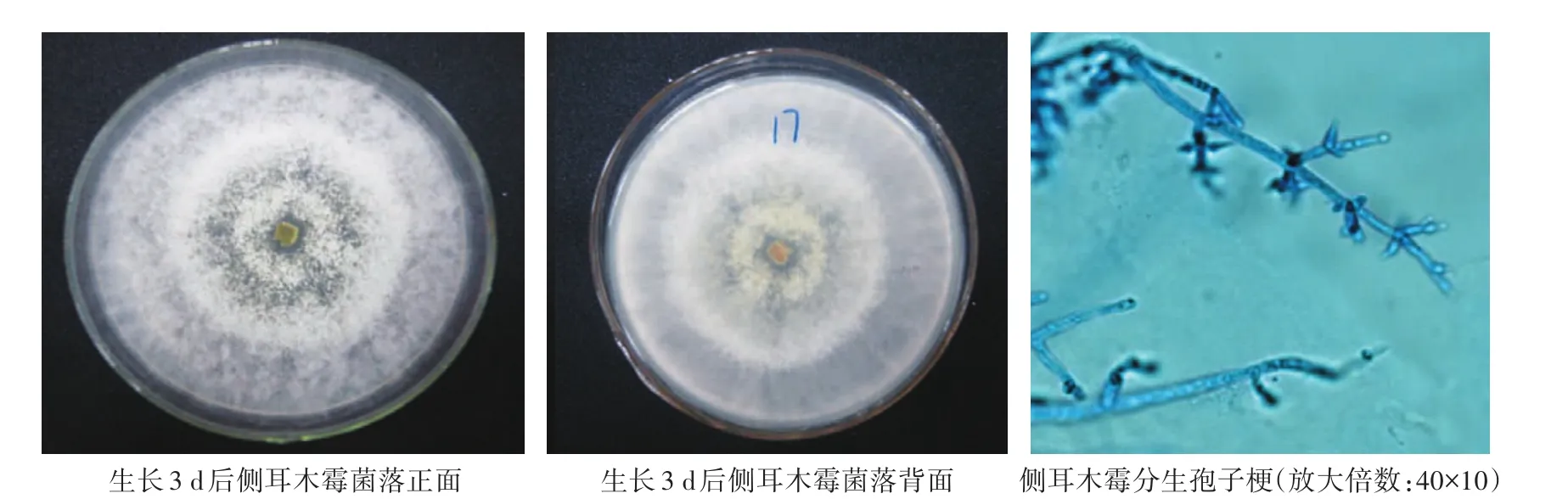
图2 侧耳木霉培养皿上着生状态及显微形态观察Fig.2 Status on culture dish and microstructure morphology of T.pleuroticola
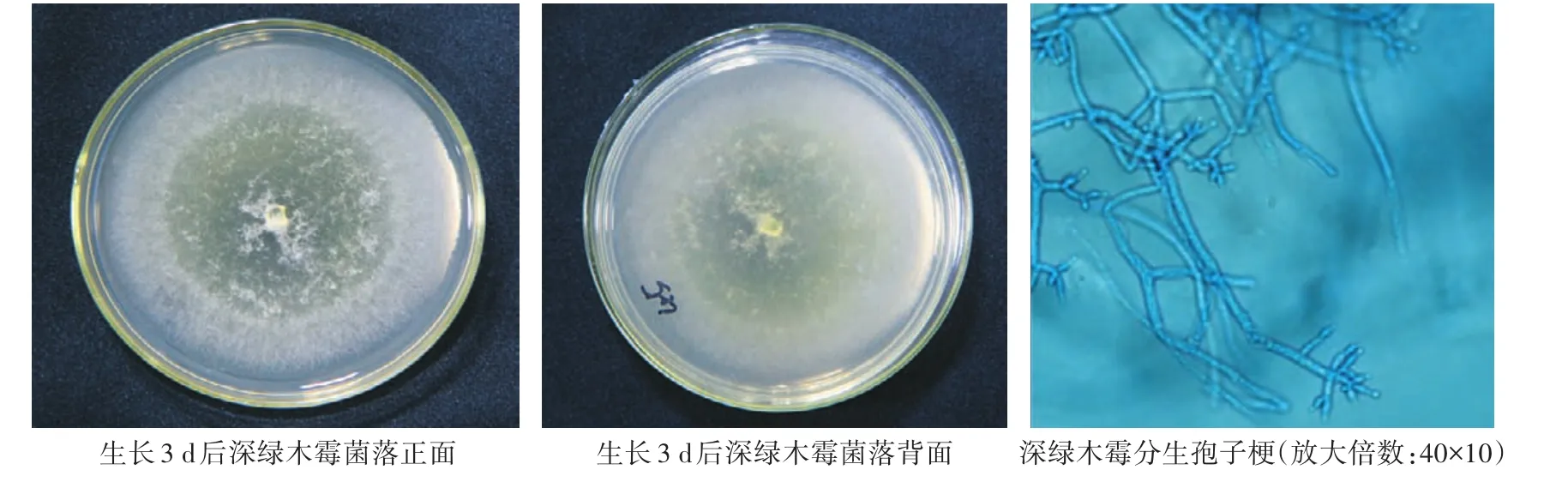
图3 深绿木霉培养皿上着生状态及显微形态观察Fig.3 Status on culture dish and microstructure morphology of T.atroviride
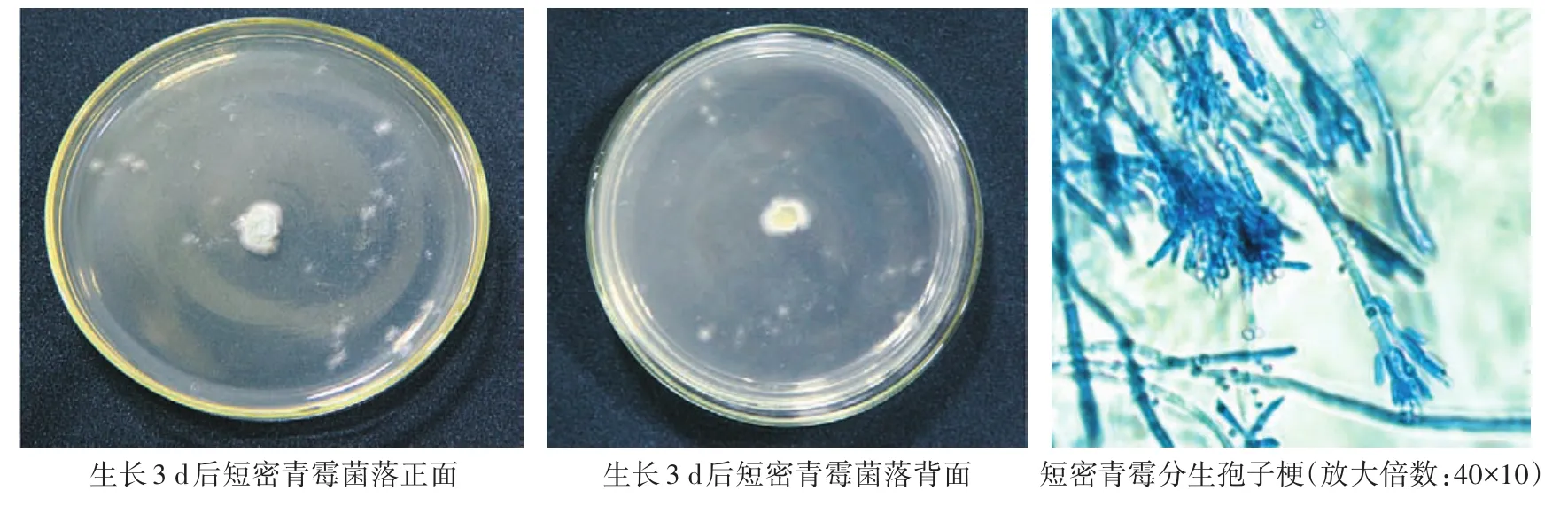
图4 短密青霉培养皿上着生状态及显微形态观察Fig.4 Status on culture dish and microstructure morphology of P.brevicompactum
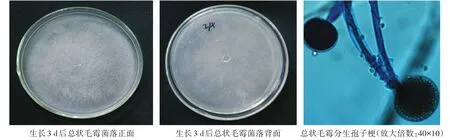
图5 总状毛霉培养皿上着生状态及显微形态观察Fig.5 Status on culture dish and microstructure morphology of M.Racemosus
2.2分离频率
根据2.1形态学鉴定结果统计分析49株霉菌的分离频率,详细信息见表1。

表1 各霉菌分离频率Table 1 Separation frequency of various molds
2.3ITS鉴定
49株霉菌经ITS-PCR后均扩增出一条大小相近的条带,500—600 bp,条带较清晰,可用于后续测序工作,部分电泳结果见图6。
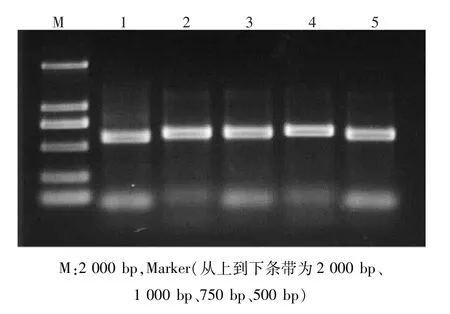
图6 部分霉菌的ITS-PCR电泳图Fig.6 ITS-PCR electrophoretogram of some molds
2.4系统发育树
由图7可知,12、7、46、47、40、25、22、1、5、3、21、6、43、41、42、44、29、23、35、19、30、48、24、32、49、31、11、28号菌株的ITS序列与KF18428相近,属于哈茨木霉,共28株菌株,这28株菌株虽都归为哈茨木霉,但菌株间的ITS序列还是存在差异性,体现了香菇工厂化栽培料中木霉的多样性。10、13、2、14、26、8、16、17、20、27、33、18号菌株的ITS序列与JX173846聚为一类,属于侧耳木霉,共12株菌株。39号和45号菌株的ITS序列与AB853782聚为一类,属于深绿木霉。9、15、4号菌株的ITS序列与AY373897聚为一类,属于短密青霉。34、37、36、38号菌株的ITS序列与JF723568相近,聚为一类,属于总状毛霉。
由基于ITS序列分析构建的系统发育树可以看出,可以将分离出的菌株分为三大群。第一大群分为3组:第1组均为哈茨木霉,28个菌株。第2组为侧耳木霉,12个菌株。第3组为深绿木霉,2个菌株。第一大群均为木霉。第二大群均为短密青霉,3个菌株,属于青霉属。第三大群均为总状毛霉,4个菌株,属于毛霉属。这与形态学及BLAST同源性鉴定的结果一致。由遗传距离可以看出,木霉和青霉的遗传距离近,毛霉与木霉、青霉的遗传距离远。3个木霉种中,哈茨木霉与侧耳木霉的遗传距离较近。
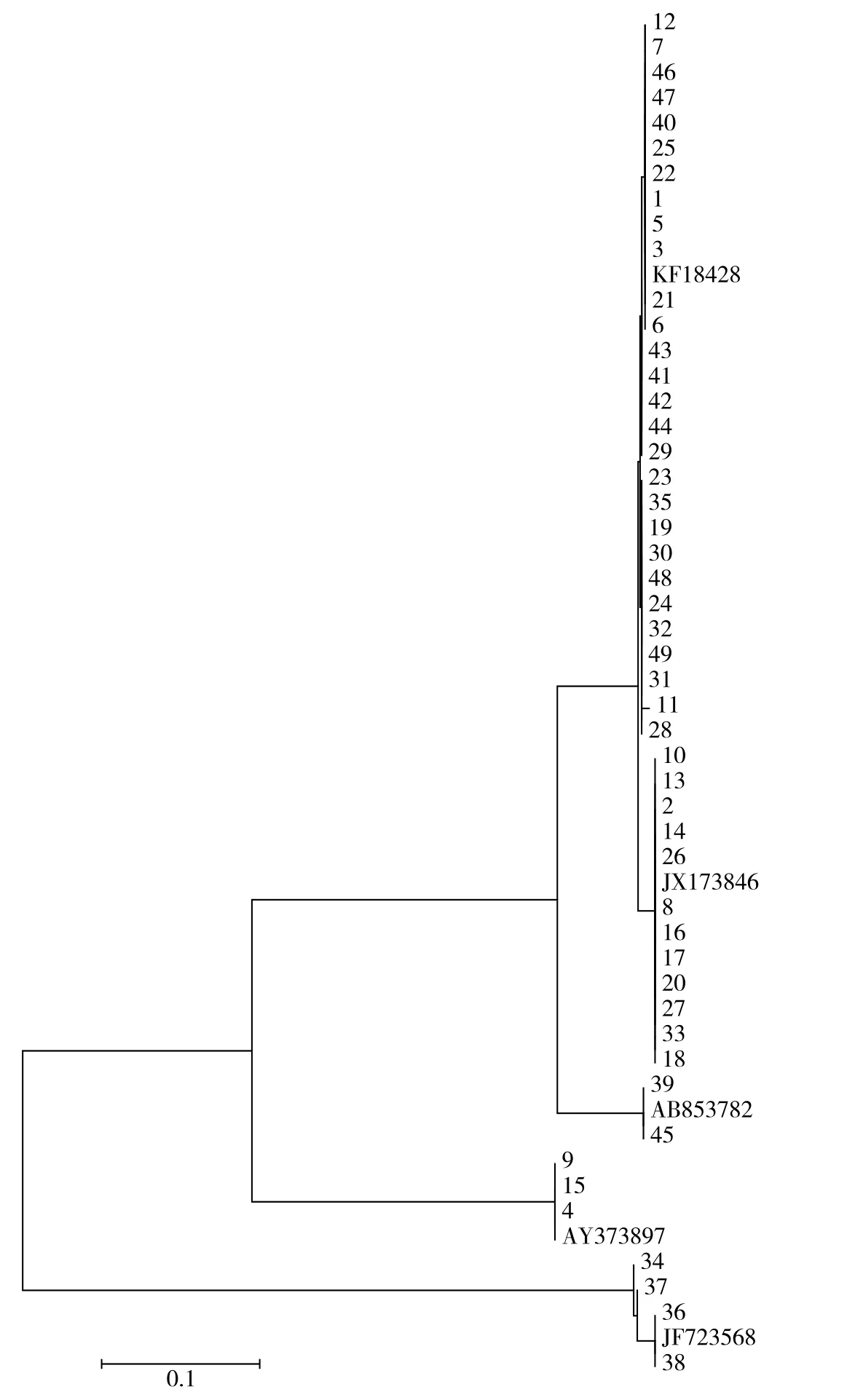
图7 由MEGA 5.10软件构建的供试菌株系统发育树Fig.7 Phylogenetic tree of tested strains established by MEGA 5.10 software
2.5抑菌剂的筛选
2.5.1对霉菌与香菇菌丝的抑制作用比较
从表2可以看出,中生菌素对哈茨木霉、侧耳木霉、深绿木霉、总状毛霉菌丝生长抑制的EC50分别为:2.85 mg/L、1.00 mg/L、16.22 mg/L、43.65 mg/L,克霉灵对哈茨木霉、侧耳木霉、深绿木霉、总状毛霉菌丝生长抑制的EC50分别为:616.60 mg/L、467.74 mg/L、812.83 mg/L、416.87 mg/L,H2O2对哈茨木霉、侧耳木霉、深绿木霉、总状毛霉菌丝生长抑制的EC50分别为:1.87 mg/L、3.42 mg/L、2.15 mg/L、2.83 mg/L,短密青霉属于局限性菌落,无法测量菌丝生长速度,故未对其进行菌丝抑制试验。对比可知,H2O2和中生菌素相较于克霉灵,对5种霉菌的抑制作用更强。H2O2对哈茨木霉、深绿木霉、总状毛霉菌丝生长的抑制作用优于中生菌素,但对侧耳木霉的抑制作用不及中生菌素。从表中也可看出,3种抑菌剂对香菇菌丝生长也存在一定的抑制作用。

表2 抑菌剂对霉菌及香菇菌丝的抑制作用Table 2 Inhibiting effects of 3 fungistats on molds and L.edodes mycelia
2.5.2对孢子萌发的抑制作用比较
由表3可知,中生菌素抑制哈茨木霉、侧耳木霉、深绿木霉、总状毛霉和短密青霉孢子萌发的EC50分别为:3.80 mg/L、3.98 mg/L、3.31 mg/L、5.97 mg/L、4.07 mg/L,克霉灵抑制哈茨木霉、侧耳木霉、深绿木霉、总状毛霉、短密青霉孢子萌发的EC50分别为:151.36 mg/L、131.83 mg/L、138.04 mg/L、109.64 mg/L、69.18 mg/L,H2O2抑制哈茨木霉、侧耳木霉、深绿木霉、总状毛霉、短密青霉孢子萌发的EC50分别为:1.82 mg/L、0.80 mg/L、0.32 mg/L、1.54 mg/L、1.47 mg/L,对比可知,3种抑菌剂中对五种霉菌孢子萌发抑制作用最强的是H2O2,其次是中生菌素,抑制作用最弱的是克霉灵。

表3 抑菌剂对霉菌孢子萌发的抑制作用Table 3 Inhibiting effects of 3 fungistats on spore germination of 5 mold species
3 结论与讨论
香菇工厂化压块栽培过程中,霉菌污染会发生在任何时期,当栽培瓶中菌丝发满并经过一段后熟期的栽培料经重新压块后,最易受到杂菌污染。本研究首次针对香菇工厂化压块栽培中的污染霉菌进行研究,采集了经重新压块后受霉菌污染的香菇菌块,分离纯化出了49株霉菌,采用形态学鉴定和ITS鉴定,两者的鉴定结果一致。形态学鉴定要求鉴定者有一定的鉴定经验,会因为鉴定者的主观因素而带来误差[17],ITS鉴定相比形态学鉴定更为可靠,因此,本研究以ITS鉴定为主,对照形态学鉴定结果对49株霉菌进行了分类。鉴定结果表明,49株霉菌可分为3个属:木霉、青霉、毛霉,5个种:哈茨木霉、侧耳木霉、深绿木霉、短密青霉、总状毛霉,可以推断这5种霉菌是香菇工厂化栽培料中的优势污染真菌,其中木霉的分离频率最高。在以往的研究中,吴小平[5]报道了哈茨木霉在食用菌栽培料中的分离频率最高,覃培升等[7]研究发现侧耳木霉和短密青霉都是平菇栽培料中的优势污染种。霉菌常作为纤维素酶的生产菌株[18],而香菇工厂化栽培料中含有大量的粗纤维和木质素,可以作为霉菌生长的良好基质,由此推测,这是霉菌成为香菇工厂化栽培中的主要污染真菌的原因。
此外,本研究对比了中生菌素、克霉灵、H2O23种抑菌剂的抑菌效果。本试验中经检测,添加H2O2时PDA的pH为5,温度为50℃。H2O2在pH为3.5—4.5,温度为40℃条件下性质最稳定,而pH为5,温度50℃条件下虽有一定分解,但分解较少,性质较为稳定[19],故H2O2在此条件下可以发挥抑菌作用。从抑菌剂对除短密青霉外的4种霉菌及香菇菌丝生长的抑制作用上看,H2O2和中生菌素抑制4种霉菌菌丝生长的EC50和EC90值远小于克霉灵,即中生菌素对哈茨木霉、侧耳木霉、深绿木霉、总状毛霉菌丝生长的抑制效果强于克霉灵。由于短密青霉是局限性菌落,无法测量菌丝生长速度,故未对其进行菌丝抑制试验。另外,由于霉菌的生长过程一般是从分生孢子或孢囊孢子开始,由孢子萌发逐渐形成菌丝,因此,抑制孢子的萌发也是防止香菇工厂化栽培中的有效措施。从对孢子萌发的抑制效果看,H2O2抑制五种霉菌的EC50和EC90值小于中生菌素和克霉灵,中生菌素抑制五种霉菌EC50和EC90值又远小于克霉灵。因此,对五种霉菌孢子萌发的抑制效果由强到弱,依次为H2O2、中生菌素、克霉灵。张继英等[1]报道证明了H2O2和克霉灵对总状毛霉和绿色木霉的孢子萌发有较好的抑制作用,且H2O2的抑制效果优于克霉灵,这与本研究的结果基本一致。马林等[20]等报道了中生菌素对木霉有很好的抑制作用,但中生菌素对青霉和毛霉的菌丝生长和孢子萌发的抑制作用尚属首次报道。从安全性上对比,克霉灵是一种化学抑菌剂,药剂用量不当会引起药剂残留从而危害食用者的健康。中生菌素是一种生物抑菌剂,不会产生农药残留[20],在安全性上优于化学抑菌剂——克霉灵。H2O2作为一种无机物,加热后可水解为无毒的H2O和O2,安全性最高。因此,综合对比,H2O2最适合在香菇工厂化栽培中应用。
本研究只对比了3种抑菌剂对霉菌的抑制作用,对抑菌剂安全浓度的试验尚未涉及,还有待进一步研究。另外,本研究结果仅是实验室内的研究结果,其实际应用效果尚待生产检验。希望在以后的研究中通过使用适宜浓度的绿色高效抑菌剂,并配合调节温度、pH等环境条件,降低香菇工厂化栽培中的霉菌污染,提高香菇产量。
参 考 文 献
[1]张继英,戚元成,王兰青,等.几种杀菌剂抑菌防杂比较试验[J].食用菌,2009(3):68-70.
[2]SAVOIE J M,IAPICCO R,LARGETEAU-MAMOUN M L.Factors influencing the competitive saprophytic ability of Trichoderma harzianum Th2 in mushroom(Agaricus bisporus)compost[J].Mycological Research,2001,105:1348-1356.
[3]万鲁长,宫志远,张柏松,等.秸秆栽培食用菌霉菌污染综合防控技术规范[J].山东农业科学,2011(9):108-109.
[4]马燕芹,孙成洋.绿霉菌综合防治技术[J].农业知识,2014(8):6-7.
[5]吴小平.食用菌致病木霉的鉴定、致病机理及防治研究[D].福州:福建农林大学,2008.
[6]BEKADA A M A,BENAKRICHE B,HAMADI K,et al.Effects of water activity,pH and temperature on the growth rate of Mucor racemosus isolated from soft camembert cheese[J].World Journal of Agricultural Sciences,2008,4(6):790-794.
[7]覃培升,刘武,黎金锋,等.平菇培养料青、绿霉菌的分离鉴定[J].广东农业科学,2013,40(4):57-60.
[8]王刚正,曹现涛,边银丙.36种植物提取液对食用菌两种竞争性木霉菌的抑制作用[J].中国食用菌,2015(2):6-7.
[9]PARK M S,BAE K S,YU S H.Molecular and morphplogical analysis of Trichoderma isolates associated with green mold epidemic of oyster mushroom in Korea[J].Journal of Huazhong Agricultural.2004,23(1):157-164.
[10]JOHANNA M,STEYAERTA,RICHARD J,et al.Ambient pH intrinsically influences Trichoderma conidiation and colony morphology[J].Fungal Biology,2010,114:198-208.
[11]方中达.植病研究方法[M].北京:中国农业出版社,1998:110-154.
[12]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[13]杨合同.木霉分类与鉴定[M].北京:中国大地出版社,2009.
[14]BISSETT J.A revision of the genusTrichoderma:Ⅱ-Ⅲ[J].Can J Bot,1991,62:924-931.
[15]吴发红,黄东益,黄小龙,等.几种真菌DNA提取方法的比较[J].中国农学通报,2009,25(8):62-64.
[16]ZHANG Y.MOLINA F I.Strain typing of Lentinula edodes by random amplified polymorphic DNA assay[J].FEMS Microbiol Lett,1995,131 (1):17-20.
[17]覃培升.平菇培养料青、绿霉菌的分离鉴定及抗菌药剂的筛选[D].南宁:广西大学,2012.
[18]吴小平,吴晓金,胡方平.食用菌栽培相关木霉种的鉴定[J].农业生物技术学报,2008,16(6):1048-1055.
[19]张清,应超燕,余可娜,等.双氧水分解速率和稳定性研究[J].嘉兴学院学报.2010,22(3):51-53.
[20]马林,宋金俤,曲绍轩.六种生物杀菌剂对平菇及杂菌生长的影响[J].食用菌,2010(3):58-59.
(责任编辑:程智强)
Identification of common molds in factory cultivation of Lentinula edodes and screening of fungistats
ZHU Xiao-ling1,2,ZHANG Lu-jun1,ZHANG Jun-ling1,TAN Qi1,2,SHANG Xiao-dong1*
(1Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences/National Engineering Research Center of Edible Fungi,Shanghai 201403,China;2College of Life Sciences,Nanjing Agricultural University,Nanjing 210095,China)
Abstract:In order to clarify dominant mold species in factory cultivation of Lentinus edodes,49 common molds were isolated and identified,and green and efficient fungistats were selected.Both morphological identification and ITS sequence analysis showed that the dominant mold species in the compost used for factory cultivation of L.edodes were Trichoderma harzinum,T.pleuroticola,T.atroviride,Penicillium brevicompactum and Mucor racemosus,and their isolation frequencies were 57%,25%,4%,6%and 8%respectively.The tests for 3 fungistats indicated that the descending order of inhibiting effects of fungistats on the hypha of the 4 mold species except P.brevicompactum was H2O2,Zhongshengmycin and Mepartricin,and that on the spore germination of all the 5 mold species was the same.H2O2had the highest safety in use and Zhongshengmycin took the second place.The above results could provide a scientific reference for mold pollution control in factory cultivation of L.edodes.
Key words:Lentinula edodes;Factory cultivation;Mold;Identification;Fungistat
中图分类号:S436.46
文献标识码:A
文章编号:1000-3924(2016)03-083-08
DOI:10.15955/j.issn1000-3924.2016.03.17
收稿日期:2015-05-27
基金项目:国家科技支撑项目(2013BAD16B02);现代农业产业技术体系建设专项(CARS-24);上海种业专项[沪农科种字(2012)第6号]
作者简介:朱晓玲(1991—),女,在读硕士,研究方向:食用菌遗传育种研究。E-mail:zxlangyo@126.com
*通信作者,E-mail:xdshang@163.com
