MicroRNAs对羊生长发育调控作用的研究进展
2016-07-02林月霞吕玉华丁宏林廖荣荣
林月霞,吕玉华,丁宏林,廖荣荣
(上海市农业科学院畜牧兽医研究所,上海201106)
MicroRNAs对羊生长发育调控作用的研究进展
林月霞,吕玉华,丁宏林,廖荣荣*
(上海市农业科学院畜牧兽医研究所,上海201106)
摘 要:MicroRNAs(miRNAs)是一类高度保守的、在转录后水平调控基因表达的非编码小RNA分子,miRNAs通过与靶基因的3’端非翻译区的互补序列结合,抑制靶基因的翻译,进而调控一系列的生理生化过程,主要包括机体细胞的增殖、分化、凋亡、信号转导、肿瘤形成等。文章综述了miRNAs的合成与功能,尤其是近年来miRNAs在羊的皮毛生长、肌肉生长以及卵巢发育等生长发育过程中的研究进展与应用。
关键词:MicroRNAs;山羊;绵羊;生长;调控
MicroRNAs(miRNAs)是一类长度约为19—24个核苷酸的内源性单链非编码RNA,在转录后水平调控基因表达的非编码小RNA分子[1-2],通过与靶基因的3’端非翻译区的互补序列结合,形成双链RNA,从而诱导靶mRNA降解或抑制其翻译过程,参与调控细胞分化、生长、凋亡、代谢等功能[3-4]。LEE等[5]于1993年首次在线虫(Caenorhabditis elegans)中发现了一种小RNA可以控制Lin-4基因的表达,后来证实这是一类新的具有调控功能的微小RNA——miRNA[6-7]。miRNAs是在各物种里研究最为深入的小非编码RNA之一。目前,miRBase数据库(版本21,2014年6月,http://www.mirbase.org/)已经收录了多种生物的miRNAs达28 645个。大量研究证实miRNAs在生物体的生长、发育和凋亡等过程中具有重要的调控意义[3,8],在组织细胞中起着极其重要的调控作用,每个miRNAs都有自己特定的靶基因,通常一个miRNA可以调控多个基因,也有几个miRNAs调控同一个基因的现象,从而在生物体内形成了一个复杂的基因调控网络。据估测,超过60%的基因受到miRNAs直接调控[9]。越来越多的研究证明,miRNAs在羊的皮毛生长、肌肉生长发育、卵巢发育、神经发育、细胞分化、脂肪代谢等生物过程中发挥着重要作用。本研究聚焦于miRNAs的结构与功能,尤其是近年来miRNAs在羊的皮毛生长、肌肉生长以及卵巢发育等生长发育过程中的调控作用与研究进展。
1 miRNAs的合成与功能
miRNAs通常是由基因间区的DNA序列编码,或者由非编码RNA(ncRNA)基因所编码,也有的miRNAs存在于mRNA前体的内含子中[10]。miRNAs的生物合成是一个较为复杂的多步骤过程(图1)。首先,在RNA聚合酶II的作用下,miRNAs转录成一条较长的具有帽子和多聚腺苷酸结构的初始miRNAs,通常包含几百甚至是上千条核酸[11]。在细胞核内,这些初始miRNAs在核糖核酸酶III Drosha-DGCR8(DiGeorge syndrome critical region 8)复合体的作用下,形成具有发夹结构的60—100个核苷酸的前体miRNAs,在exportin 5的作用下,前体miRNAs被转运出细胞核,在RNA酶Dicer作用下,进一步被加工成双链miRNA,然后,解旋酶helicase将双链解链,成熟的miRNA便可形成,并整合进入RISC复合体(RNA-induced silencing complex)。成熟的miRNAs可特异性地结合到其靶基因的3’非翻译区(3’-untranslated region,3-UTR)或mRNA的其他位点发挥功能,进而起到抑制翻译和(或)降解mRNA的作用,而总体上起到降低蛋白表达水平的功能[3,12-13]。
成熟的miRNAs在进化中大多是相对较为保守的单链RNA,其表达具有时空特异性[14],研究证实,在处于同一发育阶段的不同细胞中或不同的发育阶段的同一细胞中,miRNAs的表达谱也各不相同,而相同的miRNAs在个体发育的不同阶段的表达也是不同的。
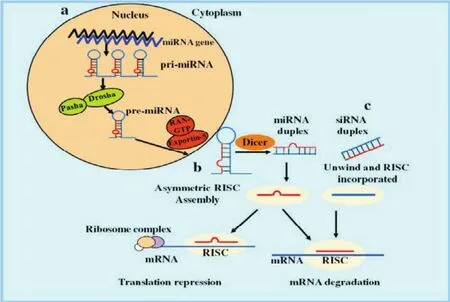
图1 miRNA的生物合成[11]Fig.1 Biosynthesis of miRNA[11]
2 羊miRNAs的分离与鉴定
近年来,通过高通量测序等生物技术手段获得了大量有关羊的miRNAs。DAVIS等[15]通过对双肌臀绵羊的骨骼肌样本进行序列同源比对,首次发现了6个羊miRNAs(miR-431、miR-433、miR-127、miR-434、miR-432和miR-136)。利用芯片技术,ZHANG等[16]对159个miRNAs在成年绵羊和山羊的身体皮肤及耳部皮肤中的表达进行了比较,发现有19个miRNAs大量富集在身体皮肤。随后,CAIMENT等[17]通过二代测序技术,从双肌臀绵羊的骨骼肌中鉴定出了747个小RNA,对应到472个miRNAs前体,其中有324个对应到已知的miRNAs,另有148个被认为是新的miRNAs。KHAN等[18]鉴定了172个新的miRNAs基因,分属于114个家族。MCBRIDE等[19]在不同发育阶段羊的卵泡中鉴定了212个miRNAs。CHANG等[20]通过对同日龄的绵羊黄体期卵巢和睾丸的高通量测序研究,共鉴定出267个新miRNAs。
此外,通过计算生物学方法结合实验方法可以有效地鉴别miRNAs[21]。利用小RNA克隆技术及结合表达序列标签(EST)信息,SHENG等[22]的研究鉴定了31个羊miRNAs,其中有2个新miRNAs;还克隆了骨骼肌中的12个miRNAs,并对各靶点的表达情况进行了分析。
3 miRNAs在羊皮毛生长中的调控
羊的皮毛是羊的重要的经济性质,为了解miRNAs在皮肤和毛囊的发育中的作用,LIU等[23]对3头一岁山羊(一公二母)进行了RNA测序,共检测到316个miRNAs,其中68个保守的miRNAs是NCBI报道过的(其中有55个是同时匹配到miRBase库的山羊和绵羊miRNAs的),另外的248个miRNAs是在其他物种内进化上保守的,但是在山羊上未见报道。该研究也确定了22个新发现的山羊miRNAs,还发现一个现象就是在山羊与绵羊中都表达的miRNAs位于各自染色体的相同区段,并且可能在皮肤和毛囊的发育中发挥关键作用。
为了解miRNAs在羊毛纤维生长发育中的作用,LIU等[24]研究了miRNAs在藏绵羊毛发生长初期、中期和晚期毛囊中的表达模式,共检测到244个成熟的miRNAs,其中只有5个是已经被绵羊miRBase库收录。进一步研究发现,有204个miRNAs是在哺乳动物进化上保守的,而有35个是首次发现的绵羊特异性的miRNAs。各发育阶段的miRNAs表达水平差异显著,也表明miRNAs可能通过调控不同生物通路的靶基因进而调控羊毛毛囊发育,如MAPK通路和Wnt通路等。此外,有6个miRNAs(oar-miR-103-3p、oarmiR-148b-3p、oar-miR-320-3p、oar-miR-31-5p、oar-novel-1-5p和oar-novel-2-3p)可能通过调控羊毛囊发育关键的Wnt通路内基因来控制羊毛发育。
绒山羊70 d胎儿皮肤中的miRNAs相对于2周龄羊羔体侧部皮肤表达上调的有4个,下调的则有64个,绒山羊70 d胚胎皮肤中上调的miRNA远远少于出生后羊羔皮肤上调miRNAs,这说明miRNAs在绒山羊皮肤毛囊不同发育阶段中发挥着关键作用[25]。ZHANG等[16]对身体皮肤及耳朵皮肤组织中的159个miRNAs的表达进行了比较,共发现有19个miRNAs大量富集在身体皮肤。这也显示miRNAs在毛发生长过程中可能也起着重要作用。
通过对miRNAs的研究,进而找出miRNAs的靶基因作用位点是探讨miRNAs调控羊皮毛生长的一个途径。SU等[26]在绒山羊的皮肤和背最长肌中共鉴定了5个新的miRNAs(chi-miR-2284n、chimiR-421*、chi-miR-421、chi-miR-1839和chi-miR-374),通过对潜在的靶基因进行研究,确定了WDR12和CSNK1A1基因参与了Notch/Wnt信号转导通路并参与对绒山羊毛发生长的调控。
4 miRNAs在羊肌肉生长中的调控
肉类性状是羊生产中的一个重要的经济性状。探讨miRNAs对肌肉生长发育的作用具有很重要的意义[27],已有不少研究报道了miRNAs在不同品种羊的不同发育阶段的功能[27-28]。胎儿的肌肉发育受到母体肥胖程度及miRNAs的表达水平的影响。母体肥胖使得let-7 g的表达下调,从而导致了处在肌肉发育期的绵羊胎儿肌内脂肪的增多[29]。
目前,虽然在羊上已经发现了大量的miRNAs,但是,由于一个miRNA可能有几个靶基因或者是很多个miRNAs在同一时间调控一个基因,所以许多miRNAs的确切的功能还不是很清楚。如何快速而准确地确定miRNAs的靶基因,对研究miRNAs的功能尤为重要。CLOP等[30]研究发现,特塞尔绵羊的Myostatin(MSTN)基因的3’-UTR区域有个G/A突变,该突变会产生miR-1和miR-206的作用靶点,miR-1和miR-206在骨骼肌中的高表达抑制了MSTN蛋白的表达,从而导致肌肉过度生长。
miR-1和miR-133在大多数动物中都是进化上保守的,并且已被证明在小鼠和猪等动物的骨骼肌发育中起着重要作用。在安徽白山羊的研究中,miR-1和miR-133在不同组织中的表达差异较大,其中,在心脏和骨骼肌(背最长肌、胸肌和小腿肌肉)中表达最多,而在肝脏、脾脏、肺和小肠等组织中的表达最少,然而,miR-1和miR-133的靶基因HDAC4和SPF基因的表达则正好相反,这些研究结果表明,miR-1和miR-133可能通过抑制各自靶基因的表达并增强成肌细胞的增殖与分化来影响骨骼肌的生长与发育[31]。
有研究表明,miR-101a富集表达于山羊骨骼肌中,并在骨骼肌卫星细胞的分化期表达上调。转染miR-101a模拟物,经分化培养基培育后,卫星细胞的分化可以得到促进,并伴随有肌原性的标志物MyoG 的mRNA的表达上升及MyoD的下降。相反,阻断miR-101a的功能,则卫星细胞的分化功能将被抑制。由此可知,miR-101a在骨骼肌卫星细胞的增殖与分化中发挥关键作用[32]。
5 miRNAs在羊卵巢发育中的作用
卵巢是雌性动物极其重要的生殖器官,研究miRNAs在羊卵巢发育中的作用不仅有助于增强对miRNAs的认识,更有利于探索miRNAs在羊的妊娠生理调控机制及分子育种方面的应用。通过对怀孕及未怀孕的山羊卵巢中miR-184的差异表达分析及生物信息学分析,发现miR-184在山羊的发育、妊娠及细胞生物合成过程中起着重要作用[33]。Chang等通过对同日龄的绵羊黄体期卵巢和睾丸进行高通量测序研究,共鉴定出267个新miRNAs,经荧光定量PCR和Northern blot检测,其中有一个miRNA(ovis_aries_ovary-m0033_3p)在卵巢和睾丸中均有表达[20]。TORLEY等[34]用荧光定量PCR方法比较了128个miRNAs在不同妊娠日龄(42 d和75 d)绵羊胎儿的卵巢和睾丸中的表达情况,共检测到24个miRNAs在42妊娠日龄胎儿的卵巢和睾丸中表达差异显著,而75妊娠日龄时有43个miRNAs在卵巢和睾丸中表达差异显著。这表明随着胎儿的发育,miRNAs在不同组织器官中的表达差异明显。
通过原位杂交技术,TORLEY等[34]揭示miR-22坐落于支持细胞内,可能在胎儿的性别分化及生殖发育过程中起着重要作用。产前睾酮的注射会导致卵巢病变。对妊娠母羊进行睾酮注射,胎儿卵巢中miR-497和miR-15b的表达量将会上调,LUENSE等[35]认为这两个miRNAs可能在睾酮诱导的卵巢病变中起着一定的作用。对绵羊不同时期卵泡和黄体的miRNAs研究,共鉴别获得189个已知miRNAs和23个新的miRNAs,其中,miR-21、miR-125b、let-7a以及let-7b表达量最高,占到了所有检测的miRNAs的40%,并揭示了miRNAs在卵泡向黄体转化过程中扮演着重要调控者角色[19]。
6 结论与展望
该综述聚焦于miRNAs在调节羊的重要经济性状方面的作用。作为一类重要的调控因子,miRNAs在转录后水平调控基因的表达,通过与靶基因的3’端非翻译区的互补序列结合,抑制靶基因的翻译,进而调控一系列的生理生化过程。越来越多的研究表明,miRNAs在羊的皮毛生长、肌肉生长、卵巢发育与疾病[36]等生理过程中起着重要的调控作用,这些研究可为提高羊的生产性能和改善健康状况提供重要的理论依据。
未来,miRNAs与羊生产性能的关系将会得到更多的研究,特别是在miRNAs的mRNA靶位点的确定方面会有更多进展。地方品种的特异性的miRNAs也是一个研究方向,可以探讨将miRNAs作为特异地方品种的生物标志。研究品种特异性的miRNAs或者miRNAs靶基因的变异也非常有利于羊的经济性状的育种。肠道微生物是动物生产性能与健康的重要影响因素,未来,miRNAs对宿主和肠道微生物互作的调控作用的研究将会受到重视。全基因组关联分析(GWAS)越来越多地应用于家畜经济性状的研究中,结合miRNAs的GWAS将会更好地运用于miRNAs的靶基因突变研究,并促进家畜经济性状的开发利用和健康的改善。
参 考 文 献
[1]ZHU L H,LIU J M,CHENG G F.Role of Micrornas in Schistosomes and Schistosomiasis[J].Frontiers in Cellular & Infection Microbiology,2014,4(165):1-5.
[2]WEN K C,SUNG P L,YEN M S,et al.Micrornas Regulate Several Functions of Normal Tissues and Malignancies[J].Taiwanese Journal of Obstetrics and Gynecology,2013,52(4):465-469.
[3]BARTEL D P.Micrornas:Genomics,Biogenesis,Mechanism,and Function[J].Cell,2004,116(2):281-297.
[4]AMERES S L,PHILLIP D Z.Diversifying Microrna Sequence and Function[J].Nature reviews Molecular cell biology,2013,14(8):475-488.
[5]LEE R C,RHONDA L F,VICTOR A.The C.Elegans Heterochronic Gene Lin-4 Encodes Small Rnas with Antisense Complementarity to Lin-14 [J].Cell,1993,75(5):843-854.
[6]LAGOS-QUINTANA M,RAUHUT R,MEYER J,et al.New Micrornas from Mouse and Human[J].Rna,2003,9(2):175-179.
[7]LEE R C,VICTOR A.An Extensive Class of Small Rnas in Caenorhabditis Elegans[J].Science,2001,294(5543):862-864.
[8]ZHU L H,LIU J M,CHENG G F.Role of Micrornas in Schistosomes and Schistosomiasis[J].Frontiers in Cellular & Infection Microbiology,2014,4:165.
[9]FRIEDMAN R C,FARH KKH,BURGE C B,et al.Most Mammalian Mrnas Are Conserved Targets of Micrornas[J].Genome research,2011,19(1):92-105.
[10]LIN S L,MILLER J D,YING S Y.Intronic Microrna(miRNA)[J].Journal of Biomedicine & Biotechnology,2006,2006(1):71-81.
[11]LU Y,MAHATO R I.Pharmaceutical Perspectives of Cancer Therapeutics[M].Manassas:Springer,2009.
[12]TAY Y,ZHANG J Q,THOMSON A M,et al.Micrornas to Nanog,Oct4 and Sox2 Coding Regions Modulate Embryonic Stem Cell Differentiation [J].Nature,2008,455(7216):1124-1128.
[13]LYTLE J R,YARIO T A,STEITZ J A.Target Mrnas Are Repressed as Efficiently by Microrna-Binding Sites in the 5'Utr as in the 3'Utr[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(23):9667-9672.
[14]LAGOS-QUINTANA M,RAUHUT R,LENDECKEL W,et al.Identification of Novel Genes Coding for Small Expressed Rnas[J].Science,2001,294(5543):853-858.
[15]DAVIS E,CAIMENT F,TORDOIR X,et al.Rnai-Mediated Allelic Trans-Interaction at the Imprinted Rtl1/Peg11 Locus[J].Current Biology,2005,15(8):743-749.
[16]ZHANG W G,WU J H,LI J Q,et al.A Subset of Skin-Expressed Micrornas with Possible Roles in Goat and Sheep Hair Growth Based on Expression Profiling of Mammalian Micrornas[J].Omics:a journal of integrative biology,2007,11(4):385-396.
[17]CAIMENT F,CHARLIER C,HADFIELD T,et al.Assessing the Effect of the Clpg Mutation on the Microrna Catalog of Skeletal Muscle UsingHigh-Throughput Sequencing[J].Genome research,2010,20(12):1651-1662.
[18]KHAN B M Y.The Novel 172 Sheep(Ovis Aries)Micrornas and Their Targets[J].Molecular biology reports,2012,39(5):6259-6266.
[19]MCBRIDE D,CARRE W,SONTAKKE SD,et al.Identification of Mirnas Associated with the Follicular-Luteal Transition in the Ruminant Ovary [J].Reproduction,2012,144(2):221-233.
[20]CHANG W H,WANG J H,TAO D Y,et al.Identification of a Novel Mirna from the Ovine Ovary by a Combinatorial Approach of Bioinformatics and Experiments[J].Journal of Veterinary Medical Science,2015,77(12):1617-1624.
[21]BALAL S,NASSIRI M,ALI M N,et al.Computational Analyses for Identification Novel Micrornas from Cattle and Sheep[J].Journal of Cell and Molecular Research,2013,4(2):62-67.
[22]SHENG X H,SONG X M,YAN Y,et al.Characterization of Micrornas from Sheep(Ovis Aries)Using Computational and Experimental Analyses [J].Molecular biology reports,2011,38(5):3161-3171.
[23]LIU Z H,XIAO H gG,LI H P,et al.Identification of Conserved and Novel Micrornas in Cashmere Goat Skin by Deep Sequencing[J].PLoS One,2012,7(12):e50001.
[24]LIU G B,LIU R Z,LI Q Q,et al.Identification of Micrornas in Wool Follicles During Anagen,Catagen,and Telogen Phases in Tibetan Sheep [J].PLoS One,2013,8(10):e77801.
[25]郝玉,尹俊.绒山羊70 d胚胎与新生羊羔体侧部皮肤miRNA的比较分析[J].生物技术,2014(5):71-76.
[26]SU R,FU S Y,ZHANG Y J,et al.Comparative Genomic Approach Reveals Novel Conserved Micrornas in Inner Mongolia Cashmere Goat Skin and Longissimus Dorsi[J].Molecular biology reports,2015,42(5):989-995.
[27]MIAO X Y,LUO Q M,QIN X Y.Genome-Wide Analysis Reveals the Differential Regulations of Mrnas and Mirnas in Dorset and Small Tail Han Sheep Muscles[J].Gene,2015,562(2):188-196.
[28]BIDWELL C A,Waddell J N,TAXIS T M,et al.New Insights into Polar Overdominance in Callipyge Sheep[J].Animal genetics,2014,45(s1):51-61.
[29]XU Y,HUANG Y,ZHAO J X,et al.Maternal Obesity Downregulates Microrna Let-7 g Expression,a Possible Mechanism for Enhanced Adipogenesis During Ovine Fetal Skeletal Muscle Development[J].Int J Obes(Lond),2013,37(4):568-575.
[30]CLOP A,MARCQ F,TAKEDA H,et al.A Mutation Creating a Potential Illegitimate Microrna Target Site in the Myostatin Gene Affects Muscularity in Sheep[J].Nature Genetics,2006,38(7):813-818.
[31]LING Y H,WANG L J,DING J P,et al.Expression Analysis of miR-1 and miR-133 in Three Developmental Stages of Goat Skeletal Muscle[J].JAPS:Journal of Animal & Plant Sciences,2015,25(1).
[32]LI D D,ZHAN S Y,WANG Y L,et al.Role of Microrna-101a in the Regulation of Goat Skeletal Muscle Satellite Cell Proliferation and Differentiation[J].Gene,2015,572(2):198-204.
[33]ZHANG X D,DING J P,LING Y H,et al.Differential Expression and Bioinformatics Analysis of miR-184 in Pregnant and Non-Pregnant Goat Ovaries[J].Journal of Animal & Plant Sciences,2013,23(6):1545-1552.
[34]TORLEY K J,DA SILVEIRA J C,SMITH P,et al.Expression of Mirnas in Ovine Fetal Gonads:Potential Role in Gonadal Differentiation[J].Reprod Biol Endocrinol,2011,9(2):1-11.
[35]LUENSE L J,VEIGA-LOPEZ A,PADMANABHAN V,et al.Developmental Programming:Gestational Testosterone Treatment Alters Fetal Ovarian Gene Expression[J].Endocrinology,2011,152(12):4974-4983.
[36]LAGANÃ A,VENEZIANO D,SPATA T,et al.Identification of General and Heart-Specific Mirnas in Sheep(Ovis Aries)[J].PLoS One,2015,10(11):e0143313.
(责任编辑:张睿)
Research progress on MicroRNAs in regulating the growth and development of goat and sheep
LIN Yue-xia,LÜ Yu-hua,DING Hong-lin,LIAO Rong-rong*
(Institute of Animal Science and Veterinary Medicine,Shanghai Academy of Agricultural Sciences,Shanghai 201106,China)
Abstract:MicroRNAs(miRNAs)are important regulators in biology.MiRNAs are a class of small noncoding RNAs that target mRNAs for translational repression or degradation.MiRNAs target mRNAs by base-pairing with the 3’-untranslated regions(3’-UTRs)of mRNAs.MiRNAs have been shown to play roles in many biological processes,including cell proliferation,differentiation,apoptosis,signal transduction and ontogenesis.The paper summarizes the identification,expression,and function of miRNAs in two important farm animal species:goat and sheep,highlights the potential role of miRNAs in regulating economically important traits,such as skin,hair,muscle and ovary.
Key words:MicroRNAs;Goat;Sheep;Growth;Regulation
中图分类号:S826
文献标识码:A
文章编号:1000-3924(2016)03-172-05
DOI:10.15955/j.issn1000-3924.2016.03.34
收稿日期:2016-04-01
基金项目:上海市科技兴农推广项目[沪农科推字(2014)第3-1号];上海市科委项目(15391912901)
作者简介:林月霞(1978—),女,硕士,助理研究员,研究方向:动物营养与功能基因组学。E-mail:lyxia05@163.com
*通信作者:廖荣荣(1985—),男,博士,助理研究员,研究方向:动物功能基因组学及其应用。E-mail:lrrnd@163.com
