小尾寒羊TGF-β3基因在同期发情处理过程中的表达分析
2016-07-02许立胜殷茂军许文海
马 瑞,许立胜,殷茂军,陈 军,许文海
(1.靖边县畜牧局草原工作站,陕西 榆林 718500;2.西北农林科技大学 动物医学院)
小尾寒羊TGF-β3基因在同期发情处理过程中的表达分析
马瑞1,许立胜1,殷茂军1,陈军1,许文海2
(1.靖边县畜牧局草原工作站,陕西 榆林 718500;2.西北农林科技大学 动物医学院)
摘要:为了探索胚胎移植过程中妊娠率的根本原因。本研究以高繁殖力小尾寒羊为试验对象,采用公认的CIDR结合外源激素处理使其同期发情,与自然发情及乏情的小尾寒羊作对比,分析了转化生长因子TGF-β3基因在卵巢细胞中的表达差异,同时对其启动子区的甲基化岛进行了分析。结果发现,自然发情绵羊和外源激素处理发情的羊在发情表现和时间上无明显差别,但是TGF-β3基因在转录水平和蛋白水平上自然发情绵羊显著高于外源激素处理发情的羊,而同期处理发情的羊显著高于乏情期绵羊卵巢细胞内的表达。自然发情和激素处理的绵羊TGF-β3基因启动子甲基化水平分别为25.8%和53.3%,而乏情期绵羊TGF-β3基因启动子处于超甲基化水平达到70.0%。以上结果说明外源激素处理的同期发情小尾寒羊尽管在发情表现、时间等与自然发情的绵羊类似,但是胚胎发育和着床重要调控基因TGF-β3的表达和甲基化模式存在显著性差异这也许是目前胚胎移植后着床率低下的原因之一。
关键词:转化生长因子;小尾寒羊;同期发情;基因表达
转化生长因子B(transforming growth factors-β, TGF-βs)是一组多效性细胞因子,包括TGF-β1、TGF-β2和TGF-β3,主要有卵巢组织分泌。可以调节卵巢的生长和分化,促进卵母细胞的成熟、受精以及胚胎的分化、凋亡和着床。TGF-β家族在反刍动物胚胎形成到着床后30 d都能表达,体外采用无血清法培养山羊胚胎,TGFβ3能显著增加桑葚胚和囊胚形成率,并且提高了胚胎抗冻性能。但至今未见TGFBs在超排动物上的研究报道。由于小尾寒羊体格高大,难产率低,并且相对较容易饲养管理,成为我国绵羊胚胎移植技术中首先的受体羊。因此,本文以小尾寒羊为试验动物,重点研究同期发情处理后卵巢组织TGF-β3基因mRNA水平变化及与启动子印迹区甲基化水平之间的关系,阐明胚胎移植过程中导致胚胎低着床率的关键因素,为提高小尾寒羊作为受体动物的受胎率提供科学参考。
1材料与方法
1.1试验动物和主要试剂
同等条件下选取18只发情周期正常的成年小尾寒羊,6只用作同期处理(EST,estrus synchronization treatment),6只作为自然发情的对照(Natural estrus control,NEC),另外6只作为乏情羊(Anestrus,ANE)。同期处理按照目前国内公认的方法,即CIDR+PMSG法,第1 d放栓,第12 d肌肉注射PMSG,第13 d撤栓并且开始观察发情表现。
试剂主要包括TRIZOL RNA 提取试剂盒、荧光定量反转录试剂盒PrimeScriptTM RT-PCR Kit、Taq DNA聚合酶和EpiMethy DNA甲基化检测试剂盒等。
1.2样品采集
将各组羊颈动脉放血致死,打开腹腔,取出卵巢,一部分进行蛋白分离;另一部分迅速放入液氮中冷冻,用于进一步提取RNA。
1.3PCR引物的设计与合成
用引物设计软件Primer Premier 6.0对TGF-β3基因mRNA序列(GenBank号:NC_019464的CDS区)设计引物;选择β-actin(GenBank号:U39357)为内参基因。所有引物由大连TAKARA公司合成。TGF-β3上游引物5'-AACTTTGCCACGGTCAGC-3', 下游引物5'-TCGGGTGCTGTTGTAAAGA -3',产物大小186bp;β-actin上游引物5'-TGACGTCGACATCCGCAAAG-3'下游引物5'-GGAGCCGCCAATCCACAC-3'产物大小179bp。
1.4总RNA的提取、cDNA合成及RT-PCR
采用Trizol RNA提取试剂盒提取卵巢总RNA,每个样品取约0.2 g,边添加液氮边匀浆,具体操作按试剂说明书进行。用琼脂糖凝胶电泳鉴定RNA的质量,并用核酸蛋白测定仪测定其浓度及纯度。最后,利用反转录试剂盒将mRNA合成CDNA,反转录体系为25 μL,然后采用RT-qPCR试剂盒进行荧光定量PCR,反应总体积为50 μL。反应条件为:94 ℃ 1 min, 然后94 ℃ 30 s,60 ℃ 40 s, 72 ℃ 45 s 30个循环。每个样品做3个重复,用相对定量法计算TGF-β3基因表达量。
1.5Western blot
在低温下将卵巢组织进行匀浆研磨,SDS蛋白裂解液(25 mmol/L H E PE S,4 nmol/L E D TA,10 g/L SDS,25 nmol/L NaF, 1 mmol/L Na3VO4; 10mmol/L sodium PyroPhosPhate, 1 mmol/PMSF)冰上裂解细胞2 0 min , 超声波粉碎5 s×4次, 4 ℃,12 000 g 离心30 min , 采用BCA法对蛋白样品进行定量, 用蒸馏水将蛋白样品调成相同浓度, 加入相同体积上样缓冲液, 沸水煮5 min 进行蛋白变性。
Westernblot 每个样本取等量蛋白(约50 μg )进行SDS-PAGE 凝胶电泳, 电压00 V,2.5 h, 电泳后将蛋白转膜, 电压50 V,2 h, 脱脂奶粉4 ℃封闭过夜,TBS洗3次, 加入兔抗TGF-β3抗体(1∶1 000)室温2 h, TTBS洗3次, 然后加入碱性磷酸酶标记的鼠抗兔IgG抗体(1∶5000)室温2 h, TTBS洗后用ECL显色。以同一样本的β-atin 作为内参。结果通过SpectrumSee凝胶图像分析系统进行分析。
1.6TGF-β3基因启动子区甲基化水平分析
根据生物信息学分析(http://www.ncbi.nlm.nih.gov/projects/mapview),发现绵羊TGF-β3基因启动子区仅有1个甲基化岛,共12个CpG位点,利用在线软件http://www.urogene.org/methprimer/对该甲基化岛序列设计特异性亚硫酸氢盐测序引物,共有5对引物供参考,试验过程中选择第三对,即上游引物5'- TAAGAGGTAGTTTTTGATTGTTTGG-3',下游引物5'- CCAAAAAAATACCCACATTATACAC-3',产物长度为180 bp。利用常规方法提取不同羊卵巢基因组序列,采用EZ DNA Methylation-DirectTM 试剂盒(货号:zymo.D5005)对提取的基因组进行转换处理,然后用Zymo TaqTM DNA Polymerase (货号:A1003-25)试剂盒对转换的基因组进行扩增,PCR条件为94 ℃ for 4 min,再94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 40 s 共35个循环,最后提纯PCR产物,并测序。甲基化CpG位点占该甲基化岛总CpG位点的百分比为甲基化水平。
1.7统计学分析
试验结果均以mean±SD表示, 采用SPSS 10.0统计软件对各组间数据进行单因素方差分析, 每个试验均重复3次。统计学上P<0.05为差异显著。
2结果与分析
2.1总RNA样品完整性检测
为了证明提取的总RNA能满足后续试验的要求,先对其进行高压快速电泳。本试验随机从每组选两个样品进行,取0.5 μg样品RNA,补水至总体积约5~10 μL,再加入适量loading buffer及EB混合,进行1.0%浓度的琼脂糖凝胶电泳,在紫外灯下观察条带并照相。结果发现提取的总RNA样品28S和18S两条带清晰、完整,无弥散(如图1)。说明提取的总RNA样品没有发生降解,完整性好,完全能满足后续试验的需要。

图1 卵巢细胞总RNA完整性检测
注释:1~2为自然发情羊卵巢组织;3~4为激素同期处理发情羊卵巢组织;5~6为乏情羊卵巢组织。
2.2TGF-β3基因在转录水平的表达
采用常规的荧光染料嵌入法对TGF-β3基因进行定量分析发现(图1),采用激素处理后发情小尾寒羊卵巢细胞内TGF-β3的转录水平显著低于自然发情羊TGF-β3基因的转录水平 (P<0.05);乏情期羊TGF-β3的转录水平显著低于同期发情处理的小尾寒羊TGF-β3基因转录水平(P<0.01)。
2.3TGF-β3基因在蛋白水平的表达
由于转化生长因子TGF-β3的功能主要表现在蛋白水平上。因此,进一步采用Western blot技术进行了蛋白表达分析。结果发现TGF-β3蛋白在自然发情小尾寒羊卵巢细胞内表达最高(图3A 和3B),尽管采用同期处理的小尾寒羊卵巢细胞内TGF-β3蛋白表达水平显著高于(P<0.05)乏情期绵羊卵巢细胞的水平,但是仍然显著低于自然发情的绵羊(P<0.05)。说明激素处理受体母羊后,即使其发情症状相似,但是卵巢细胞内TGF-β3基因在蛋白水平上的表达存在显著性差异。

图2 转化生长因子基因TGF-β3在转录水平
的表达分析结果注释:不同的小写字母代表差异显著(P<0.05; P<0.01)。

图3 转化生长因子TGF-β3基因的Western blot图
注释:1为激素同期处理发情期羊卵巢组织;2为自然发情期羊卵巢组织;3为乏情期羊卵巢组织。
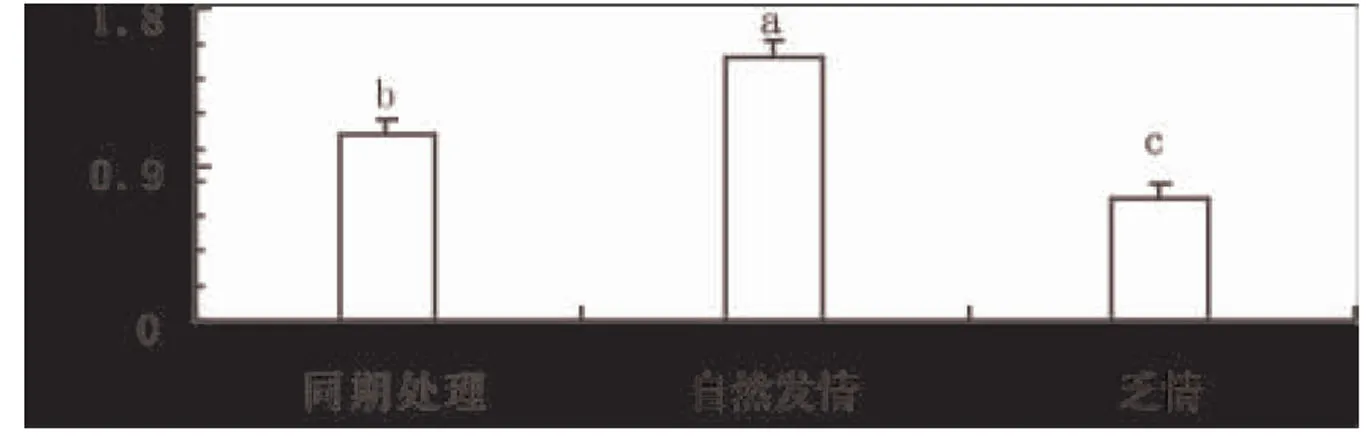
图4 转化生长因子TGF-β3基因在蛋白水平的表达分析
注释:不同的小写字母代表差异显著(P<0.05)。
2.4TGF-β3基因启动子甲基化CpG水平
生物信息学分析发现绵羊转化生长因子TGF-β3基因启动子区含有唯一1个甲基化岛,包含12个CpG位点(图5);经过亚硫酸氢盐测序结果发现小尾寒羊自然发情时TGF-β3基因启动子区甲基化水平仅有25.8%;采用外源激素同期处理的羊该基因启动子区甲基化水平为53.3%,而处于乏情时的小尾寒羊TGF-β3基因启动子甲基化水平最高(70.0%)。

图5 绵羊转化生长因子TGF-β3启动子区CpG岛图

自然发情(25.8%) 同期处理(53.3%) 乏情绵羊(70.0%)
图6 转化生长因子TGF-β3基因启动子区甲基化水平
3讨论
胚胎移植技术经过几十年的发展和完善,广泛应用于牛、羊等家畜的扩繁,在我国得到了交大的推广和应用。羊是季节性发情动物,生殖活动受到生殖激素的调节与影响,当内源生殖激素不足以使卵巢活动时,应用外源激素促使发情可达到理想的效果,即同期发情处理。同期发情技术的应用,可实现不同生理阶段的羊群集中发情、配种、产羔、育肥、出栏,有助于实现集约化的生产方式。而我国小尾寒羊具有体格高大,易饲养,抗病率强等特点,是其他品质绵羊无法比拟的。因此,在大规模绵羊胚胎移植过程中是一种理想的受体绵羊。但是胚胎移植后胚胎在子宫内的着床及随后的胚胎发育是影响胚胎移植成功率的关键所在。目前,小尾寒羊作为受体绵羊的妊娠率约为75%,产羔率约为60%,仍然显著低于自然情况下绵羊的妊娠率90%和产羔率80%。国内外许多研究已经证明转化生长因子TGF-β3基因在卵母细胞成熟、受精和胚胎发育甚至着床过程中起着重要的调控作用。
启动子区域DNA甲基化(CpG位点中胞嘧啶第5位碳原子的甲基化)是一种重要的表观遗传修饰机制,为基因沉默与开启提供了基因组水平的调控方式。一般而言,低甲基化的DNA与活跃的染色质相关,而高甲基化的DNA则与不活跃的染色质相关。
本研究以小尾寒羊为试验材料,采用公认的CIDR结合外源激素处理使其同期发情,与自然发情的小尾寒羊作对比,利用反转录荧光定量RT-PCR和Western blot技术研究TGF-β3基因在卵巢细胞中的表达差异,探索胚胎移植过程中低着床率的根本原因;同时将乏情期的小尾寒羊做对比,更有利于说明TGF-β3基因在发情不同阶段的表达差异,为今后阐明胚胎着床机理以及提高胚胎移植率奠定基础。自然发情绵羊和外源激素处理发情的羊在发情表现和时间上无明显差别,这可能与促卵泡素和雌激素的水平有关。利用荧光定量RT-PCR技术在转录水平的检测结果表明,在TGF-β3基因mRNA表达量在自然发情羊卵巢显著高于同期处理羊,并且它们显著高于在乏情期绵羊卵巢细胞内的表达。由于TGF-β3最终起作用是发生在蛋白水平,因此我们进一步采用蛋白杂交技术对蛋白的表达进行了分析,结果发现激素处理的同期发情羊卵巢细胞内的TGF-β3蛋白表达量显著高于乏情期绵羊,但是仍然显著低于自然发情期绵羊卵巢细胞的表达。说明激素处理受体母羊后,即使其发情症状相似,但是卵巢细胞内TGF-β3基因在蛋白水平上的表达存在显著性差异。
采用亚硫酸氢盐测序发现TGF-β3基因启动子区的CpG岛在3种绵羊卵巢细胞中也存在明显的差异。自然发情的绵羊卵巢细胞TGF-β3基因启动子甲基化水平最低,而乏情绵羊卵巢细胞中甲基化水平最高,从表观遗传学上说明了外源激素处理的小尾寒羊与自然发情绵羊仍然具有一定的差异。
以上结果说明:(1)外源激素处理的同期发情小尾寒羊尽管在发情表现、时间等与自然发情的绵羊类似,但是其卵巢生理环境有明显的差别;(2)转化生长因子TGF-β3基因无论在转录水平还是蛋白水平在绵羊卵巢内的的表达是一致的;(3)同期发情处理的绵羊卵巢TGF-β3基因启动子区甲基化修饰程度显著高于自然发情绵羊,这与该基因的表达有直接的关系;(4)小尾寒羊作为绵羊胚胎移植过程中的受体羊,TGF-β3基因启动子区高甲基化修饰及其在蛋白水平的低表达可能是目前胚胎移植后着床率低下的原因之一。
参考文献:
[1]Neira JA, Tainturier D, Pena MA, et al. Effect of the association of IGF-I, IGF-II, bFGF, TGF-b1, GM-CSF, and LIF on the development of bovine embryos produced in vitro [J]. Theriogenology, 2010,73:595-604.
[2]Kosla J, Dvorak M, Cermak V. Molecular analysis of the TGF-beta controlled gene expression program in chicken embryo dermal myofibroblasts [J]. Gene, 2013,513: 90-100.
[3]Juenge JL, Bibby AH, Reader KL, et al. The role of transforming growth factor-beta (TGF-beta) during ovarian follicular development in sheep [J]. Reproductive Biology and Endocrinology, 2004, 2:1-11.
[4]Knight PG, Glister C. Local roles of TGF-beta superfamily members in the control of ovarian follicle development[J]. Animal Reproduction and Science, 2003, 78:165-183.
[5]Freetly HC, Leymaster KA. Relationship between litter birth weight and litter size in six breeds of sheep [J]. Animal Reproduction and Science, 2004,82(2):612-618.
[6]李蕴华. 小尾寒羊的养殖要点与注意事项[J]. 畜牧与饲料科学,2013,34(1):81-82.
[7]冯亚杰, 王二耀, 吴娇, 等. 促排卵3号在小尾寒羊超排中的应用效果[J]. 黑龙江动物繁殖,2013,21(6):19-24.
[8]贾银海, 陈永昌, 叶绍辉, 等. 羊的胚胎移植技术[J]. 畜牧与饲料科学,2006(4):112-117.
[9]章孝荣. 动物胚胎移植及其在畜牧生产中的应用[J]. 黑龙江动物繁殖,2004,12(2):17-19.
[10]王俊贤,安继忠,张勃. 小尾寒羊不同杂交组合羔羊的生产性能测定[J]. 畜牧兽医杂志, 2012,31(3): 15-17.
[11]李蕴华. 小尾寒羊的养殖要点与注意事项[J]. 畜牧与饲料科学,2013,34(1):81-82.
[12]王存芳. 如何提高鲁西南小尾寒羊养殖的经济效益[J]. 畜牧兽医杂志,2012,3(12):23-27.
[13]Chang H, Brown CW, Matzuk MM. Genetic analysis of the mammalian transforming growth factor-beta superfamily [J]. Endocrine Reviews, 2002, 23:787-823.
[14]Bourc'his D, Le Bourhis D, Patin D, et al. Delayed and incomplete reprogramming of chromosome methylation patterns in bovine cloned embryos[J]. Current Biology, 2001, 11: 1542-1546.
[15]Barreto G, Schafer A, Marhold J, et al.Gadd45a promotes epigenetic gene activation by repair-mediated DNA demethylation[J]. Nature, 2007, 445: 671-675.
[16]Bian Y, Alberio R, Allegrucci C, et al.Epigenetic marks in somatic chromatin are remodelled to resemble pluripotent nuclei by amphibian oocyte extracts [J]. Epigenetics, 2009, 4: 194-202.
[17]Curchoe CL, Zhang S, Yang L,et al. Hypomethylation trends in the intergenic region of the imprinted IGF2 and H19 genes in cloned cattle. Animal reproduction science[J]. Endocrine Reviews, 2009, 116: 213-225.
[18]Freetly H C, Leymaster K A. Relationship between litter birth weight and litter size in six breeds of sheep [J]. Animal Reproduction and Science, 2004,82(2):612-618.
Expression Analysis of TGF-β3 Gene in the Process of Estrus Synchronization for Small-Tail Han Sheep
MA Rui1,XU Li-sheng1,YIN Mao-jun1, CHEN Jun1, XU Wen-hai2
(1.JingbianCountyGrasslandWorkstationofAnimalHusbandryBureau,YulinShaanxi718500;2.CollegeofVeterinaryMedicine,NorthwestA&FUniversity)
Abstract:In order to explore the underlying reason of pregnancy rate after embryo transplantation, Small-tail han sheep with high fertility were used as experimental animals in this study, and exogenous hormones and CIDR were used to make synchronize estrus. Compared with natural oestrous and anestrous Small-tail han sheep, the expression difference of transforming growth factor-beta 3 (TGF-β3) gene in ovarian cells and the methylation levels of TGF-β3 promoter was analyzed. The results showed that there was no significantly difference in estrus performance and time between natural oestrous sheep and treated oestrous sheep by exogenous hormones,but in the transcription level and protein level of TGF-β3 gene, natural oestrous sheep was significantly higher than treated oestrous sheep by exogenous hormones, and treated oestrous sheep by exogenous hormones were significantly higher than that of anestrous sheep. The methylation levels of TGF-β3 gene promoter were 25.8% and 53.3% in natural oestrous sheep and treated oestrous sheep by exogenous hormones, respectively. While in anestrous sheep the supermethylation level was 70.0%. These results suggested that treated oestrous sheep by exogenous hormones in estrus performance and time were similar to natural oestrous sheep,but it was important to regulate embryo development and implantation in the expression and methylation pattern of TGF-β3 gene. And there were significantly different between them, which may be one reason resulting in the low implantation rate after embryo transplantation.
Key words:transforming growth factor;Small-tail han sheep;estrus synchronization;gene expression
[收稿日期]2015-09-17
[基金项目]国家自然基金青年基金项目(31101682)
[作者简介]马瑞(1969-),男,陕西靖边人,本科,主要从事优质牧草的培育及高效利用等方面工作。
[中图分类号]S 188
[文献标识码]A
[文章编号]1004-6704(2016)01-0024-05
