红茂草中黄酮类提取工艺优化及体外抑菌研究
2016-07-02王廷璞
赵 强,王廷璞
(天水师范学院 生物工程与技术学院,甘肃 天水 741000)
红茂草中黄酮类提取工艺优化及体外抑菌研究
赵强,王廷璞
(天水师范学院 生物工程与技术学院,甘肃 天水 741000)
摘要:以红茂草为研究对象,在单因素水平筛选测定的基础上,通过响应面法优化其提取工艺。提取物采用Diamonsil C18(4.6 mm×150 mm,1.8 μm)色谱柱为固定相,甲醇-0.2%磷酸(65∶35,v/v)为流动相,流速1.0 mL/min,检测波长280 nm;并对提取物进行抑菌活性测定,以大肠埃希氏杆菌和金黄色葡萄球菌为供试菌,进行体外抑菌活性研究和透射电镜观察。结果显示,红茂草中黄酮类化合物最佳提取工艺条件为:液料比15 mL/g、超声时间35 min、回流时间2.5 h、乙醇体积分数65%,在此工艺下红茂草中黄酮类化合物含量为2.60%,HPLC检测重现性好;其提取物对大肠埃希氏杆菌和金黄色葡萄球菌的MIC为0.28 g/mL和0.20 g/mL,MBC为0.26 g/mL和0.10 g/mL,IC50为0.2162 g/mL和0.1805g/mL,在透射电镜下观察抑菌效果显著。研究表明,响应面法对红茂草中黄酮类化合物提取工艺的优化比较合理。
关键词:响应面法;红茂草;黄酮类化合物
红茂草[Dicranostigma leptodum(maxim.)Fedde,DLF]俗名秃疮花、秃子花、勒马回,属罂粟科秃疮花属两年或多年生草本植物。生长于海拔1 000~2 400 m的草坡、丘陵、路边、农田埂、墙上、屋顶等处,具有耐旱、耐瘠薄等生活习性。在我国主要分布在青海、甘肃、陕西等省。味苦、涩、性凉,有毒,民间全草入药,能清热解毒、消肿止痛、杀虫、治疗扁桃腺炎、咽喉痛、淋巴结核、秃疤、疥癣等症。
黄酮类化合物是植物次生代谢的产物,广泛存在于自然植物中,以游离态或与糖结合为苷的形式存在。该类化合物结构复杂,种类很多;研究发现其具有显著的生理及药理活性,不仅有抗癌、抗肿瘤、抗氧化、抗炎抑菌、降血糖、抗辐射以及增强免疫能力等药理作用,还具有改善记忆、抗焦虑、抗抑郁、中枢抑制和神经保护等功能,能够防治心脑血管系统和呼吸系统的疾病。
为了科学、充分的利用红茂草中的黄酮类化合物资源,很有必要对其黄酮类化合物的提取条件进行优化。本次实验选择红茂草干粉为原料,采用单因素实验筛选,利用响应面分析法对其提取工艺参数进行优化,得到红茂草黄酮类化合物最佳提取工艺条件,并通过HPLC对提取物成份及纯度进行检测,为红茂草药物的深层次研究提供了一定的理论参考。
1材料与方法
1.1材料与仪器
红茂草干粉,天水师范学院生物园规范化种植,自然风干,粉碎、过筛、备用。试剂 芦丁对照品(国药集团,批号:F20051222)、NaOH、95%乙醇、NaNO2、Al(NO3)3甲醇、磷酸、戊二醛等,其余试剂均为国产或进口分析纯。培养基 牛肉膏蛋白胨培养基,提前配制,灭菌备用。菌种,大肠埃希氏杆菌(Escherichia coli,ATCC 12453)、金黄色葡萄球菌(Staphylococcus aureus,ATCC 26113),均为天水师范学院生物工程实验室保存标准菌。
KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司产品;722可见分光光度计,上海欣茂仪器有限公司;Alliance 高效液相色谱仪,美国安捷伦;AB104-S精密电子分析天平:瑞士梅特勤公司产品;JY系列电子天平,上海方瑞仪器有限公司;RE52-99 旋转蒸发器,上海亚荣生化仪器厂产品;JEM-1230 型透射电子显微镜,瑞利仪器分析有限公司产品;索氏提取器等。
1.2试验方法
1.2.1标准溶液配制与标准曲线绘制精密称取0.0625 g的芦丁对照品,加75% 50 mL乙醇溶解,定容至250 mL的容量瓶中,摇匀作为芦丁对照品溶液(0.25 mg/mL)。准确移取0.25 mg/mL芦丁溶液1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0、14.0、15.0 mL 于15只50 mL容量瓶中,另取蒸馏水作为空白对照,分别各加入10 mL蒸馏水,加入5% 的NaNO2溶液2 mL,摇匀,静置6 min,加1% 的Al(NO3)3溶液6 mL,摇匀,静置6 min,加4% 的NaOH溶液20 mL,摇匀后静置15 min,加蒸馏水至刻度,在510 nm的波长处测定其吸光度,每个样品设置三个平行样。
1.2.2红茂草中黄铜类化合物的盐酸-镁粉反应检测采用盐酸-镁粉反应法对红茂草中黄铜类化合物进行定性检测,以标准品芦丁为阳性对照品。准确移取5.00 mL红茂草中黄铜类化合物浓缩液和0.005 g/mL的芦丁标准液各两份,分别置于50 mL的烧杯中,并向每只烧杯里加入5.00mL的甲醇溶液。将6只烧杯分组进行实验,具体分组如表1所示。各试剂添加完毕后,充分振摇,观察颜色变化。实验组重复3次操作。

表1 试验分组与试剂添加
注:试验组重复3次操作。
1.2.3提取试验设计称取红茂草干草粉末6份,每份10.0 g。固定液料比14 mL/g、浸泡时间18 h、索氏提取回流时间2.5 h、超声时间25 min、浸提液pH=5,考察乙醇体积分数为50%,55%,60%,65%,70%,75%,80%时对提取效果的影响。然后将优选的最佳乙醇体积分数做为固定数值,依次选取考察液料比为12:1、13:1、14:1、15:1、16:1、17:1、18:1 mL/g,回流时间为1.0、1.5、2.0、2.5、3.0、3.5、4.0 h,超声时间为10、15、20、25、30、35、40 min,浸泡时间为0、4、8、12、16、20、24h,调节浸提液pH为2、3、4、5、6、7、8时对提取效果的影响。将每次优选后的最佳条件固定,再逐次筛选其余最佳条件。根据单因素实验结果,进行极差分析,最终优选出4个主要影响因素,按照响应面实验设计方案进行黄酮提取。再将提取液转入旋转蒸发仪,35~40 ℃下减压蒸至无醇味,转入100 mL锥形瓶,封口静置。在单因素试验的基础上,使用Box-Behnken中心设计,通过响应面法进行红茂草中黄酮类化合物提取条件的优化。
采用极差分析对6组单因素水平进行筛选,最终确定液料比X1(mL/g)、超声时间X2(min)、回流时间X3(h)、乙醇体积分数X4(min)四个因素作为自变量进行响应面分析实验。使用Design-Expert 7.0软件,以红茂草中黄酮类化合物(芦丁)含量为指标,设计4因素3水平(共29个实验点,5个中心点)的响应面实验,其因素水平表见表2所示。
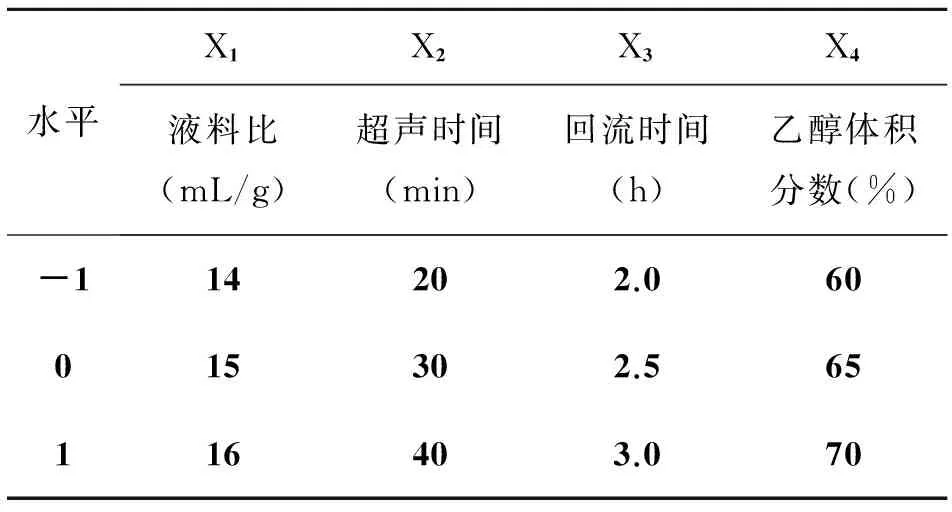
表2 响应面实验因素水平
1.2.4红茂草中黄酮类化合物含量的测定将25个50 mL容量瓶中的提取液稀释后测定其吸光值,对照标准曲线,得出提取液中黄酮类化合物的浓度,最后计算出红茂草中黄酮类化合物提取得率。
C为提取物中芦丁含量(mg/mL);V为体积(mL);B为稀释倍数;m为红茂草的质量(g)。
1.2.5HPLC检测色谱柱:Diamonsil C18(4.6 mm×150 mm,1.8 μm);流动相:甲醇-0.2%磷酸溶液(65:35);流速:1.0 mL/min;检测波长:280 nm;温度30(±1)℃;进样量:5.0μL 。
准确配制浓度为0.0250 mg/mL的芦丁标准液,依次配成0.1875、0.3750、0.7500、1.5000、3.0000μg/mL浓度梯度的溶液,进行HPLC检测。
1.2.6体外抑菌(1)菌液制备,将所选供试菌事先接种于无菌平板上,37 ℃培养1 d后,选取典型菌落,转移接种在液体培养基中,经37 ℃培养1 d后,再用无菌生理盐水稀释,使其为菌量106~107CFU /mL的菌悬液,备用。(2)MIC、MBC和IC50的测定,将红茂草黄酮类提取物用无菌蒸馏水倍比稀释,制备所需系列浓度的稀释液。然后将稀释液分别定量转移至无菌培养皿中,与定量倒入的培养基充分混匀,室温冷却、凝固,制成含药液的平板。再按培养皿所需的计量,分别移取定量被试菌液,涂于平板上,置于恒温箱中37 ℃培养1~2 d,检查菌落生长情况,以平板菌落计数法计算菌落数,另取各含药液1:5浓度无菌阴性和无药阳性作为对照。以肉眼计数,完全没有菌落生长时的最低药物浓度,为该药物的最小抑菌浓度(Minimal Inhibitory Concentration, MIC)。取上述MIC及以上各浓度未见细菌生长的个试管培养物,分别移取0.1 mL接种至不含药物的培养基上,涂匀平板,置于恒温箱37 ℃培养1 d,查看有无菌落生长,计数少于5个菌落者,为该药物的最低杀菌浓度(Minimal Bactericidal Concentration, MBC)。37 ℃培养观察菌落生长情况,以培养皿中长菌或不长菌为准,按Reed-Muench法计算其半数抑菌浓度(Half Inhibitory Concentration, IC50)。以上试验均重复3次。(3)透射电子显微镜观察,选取典型供试菌作为研究对象,将其接种在已制得的琼脂蛋白胨培养基上,恒温箱37 ℃培养1 d后,用pH=6.0的5 mmol/L磷酸缓冲液洗脱细菌,使其含量保持在108 CFU /mL左右。移取500 μL菌悬液,加到浓度为0.2%的红茂草黄酮类提取物中(溶于1% HAc),使红茂草黄酮类提取物最终浓度稀释为0.1%。将其置于1.5 mL离心管中,37 ℃摇床(120 r/min)培养1 d,离心后取出细菌沉渣。将离心后的细菌团,加3%戊二醛,在4 ℃时固定5 h,用5 mol/L磷酸盐缓冲液漂洗3次,每次10 min,再用1%的OsO44 ℃后固定1 h,最后用5 mol/L磷酸盐缓冲液漂洗3次。使用40%、60%、80%、100%乙醇,4 ℃下脱水10 min,再用纯丙酮脱水2次,每次10 min。加入环氧树脂Epon-812(1∶1)与纯丙酮,室温静置3 h,用环氧树脂Epon-812包埋后,分别在30、40、60 ℃下,分别聚合4、12、24 h,制成超薄切片,使用枸椽酸铅和醋酸双氧铀双染色,在JEM-1230型透射电镜下观察其抑菌效果。
2结果与分析
2.1芦丁标准曲线
根据芦丁标准品系列质量浓度梯度在510 nm处测定吸光值,得回归方程:Y=0.0166X+0.0216,R2=0.9989,线性关系良好。
2.2红茂草中黄铜类化合物的定性检测
通过盐酸-镁粉反应法对红茂草中黄铜类化合物进行定性检测。结果显示,试验组烧杯中,在反应生成的泡沫处,溶液呈现橙红色,均呈明显的阳性反应,阳性对照组同样呈现橙红色,而空白对照组溶液无明显的颜色变化,这表明本试验所提取的红茂草提取物里含有黄酮类化合物,这与相关文献报道一致。
2.3单因素提取实验
将单因素的实验结果绘制成表格,见表3所示。以芦丁含量为指标,选出每个因素的最优水平,即对应的黄酮类化合物含量也最高。
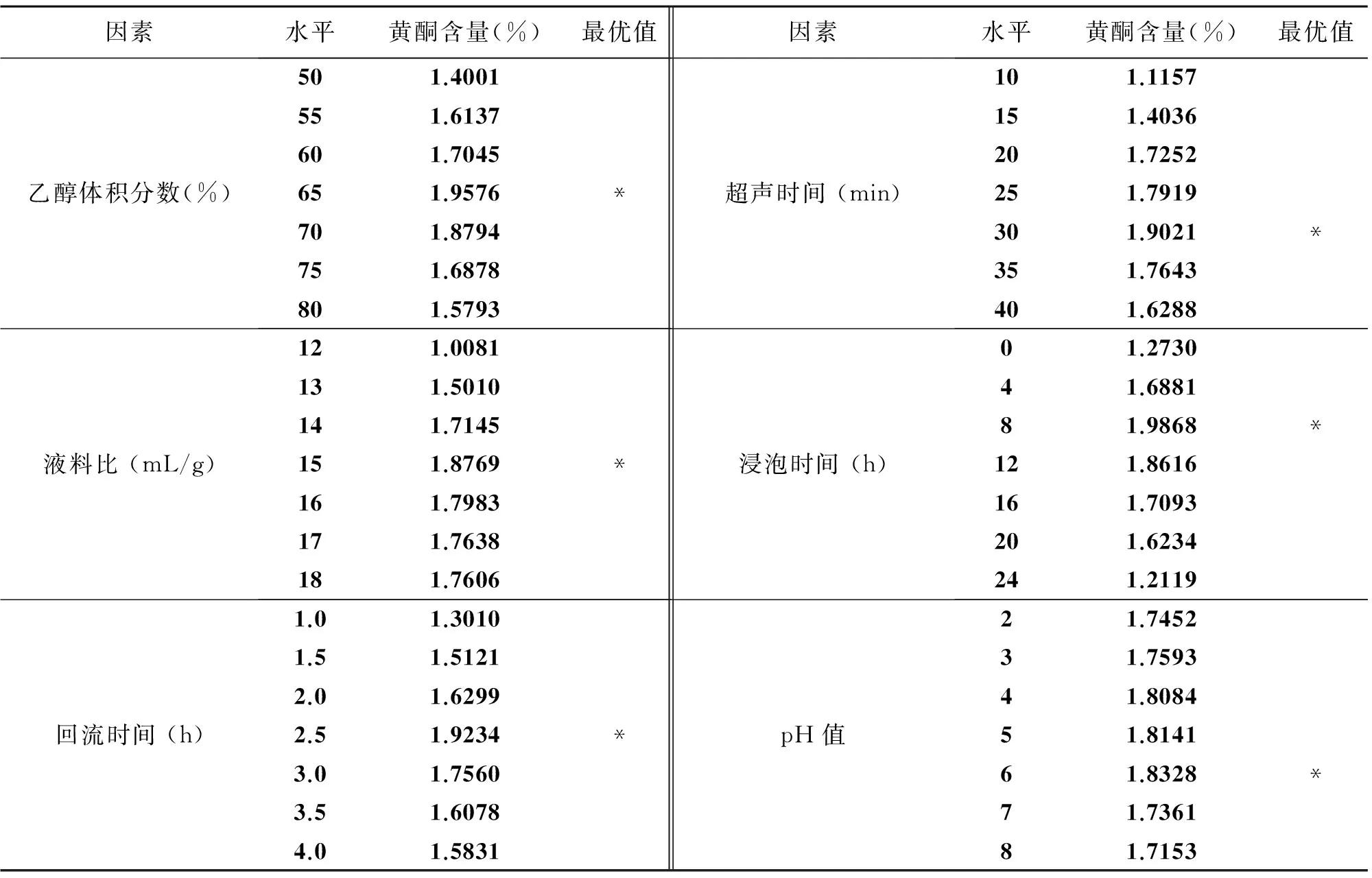
表3 单因素实验结果
注:*表示最优水平。
2.4响应面法模型建立
2.4.1响应面实验方案设计及结果以X1(液料比)、X2(超声时间)、X3(回流时间)、X4(乙醇体积分数)为自变量,红茂草中黄酮类化合物含为响应值(Y),进行响应面分析实验,共有29个实验,其中24个为析因实验,5个为中心实验,用以估计误差。其结果见表4所示,模型方差分析结果见表5所示。
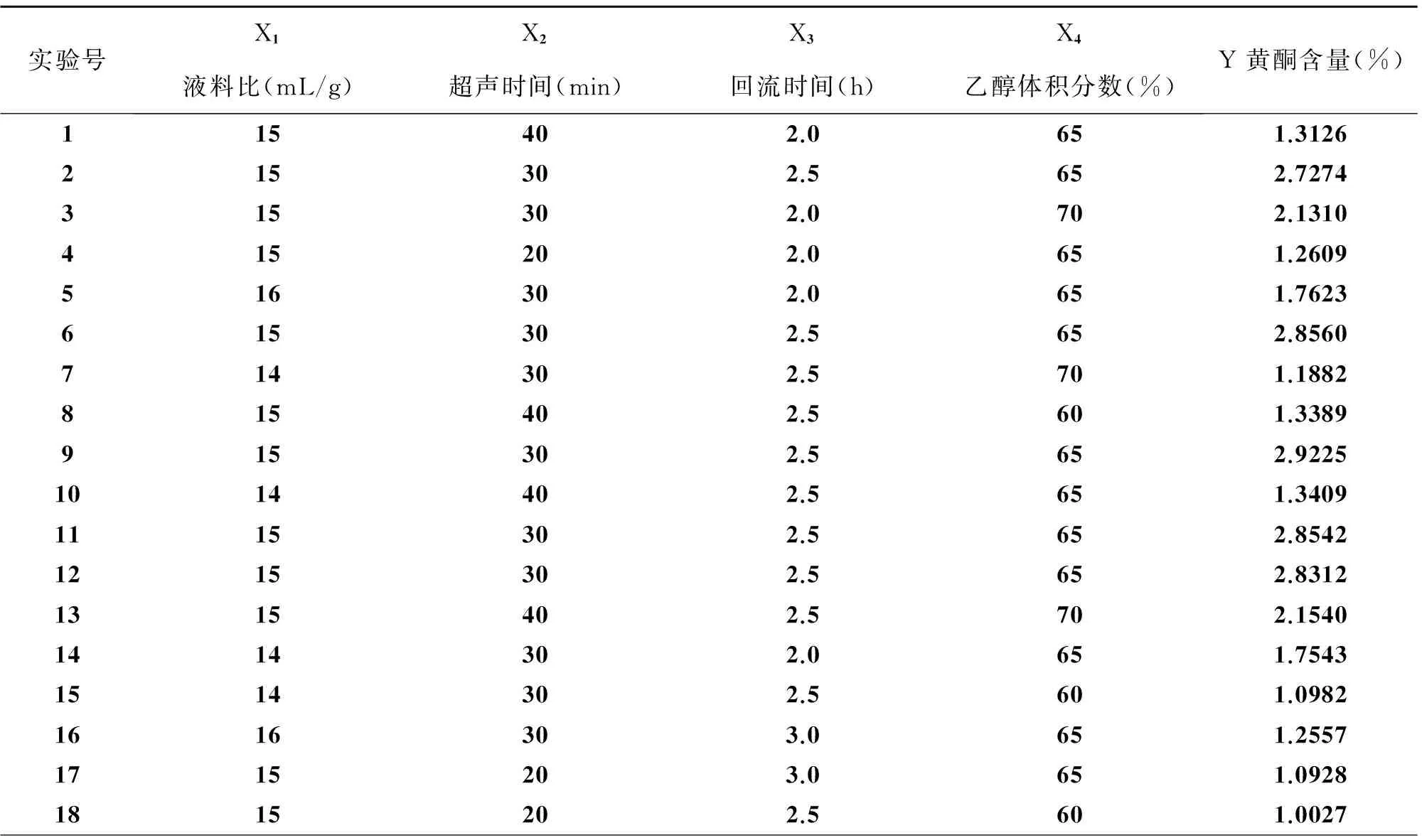
表4 响应面实验结果
续表4
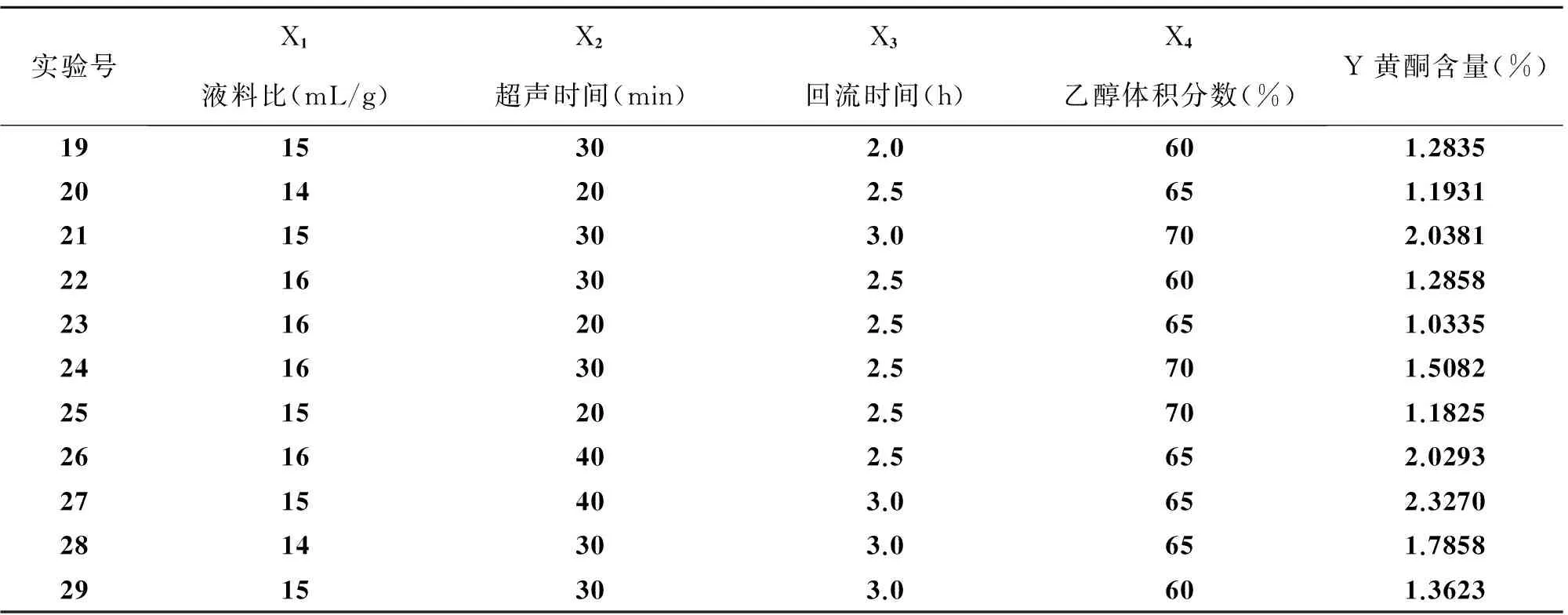
实验号X1X2X3X4液料比(mL/g)超声时间(min)回流时间(h)乙醇体积分数(%)Y黄酮含量(%)1915302.0601.28352014202.5651.19312115303.0702.03812216302.5601.28582316202.5651.03352416302.5701.50822515202.5701.18252616402.5652.02932715403.0652.32702814303.0651.78582915303.0601.3623
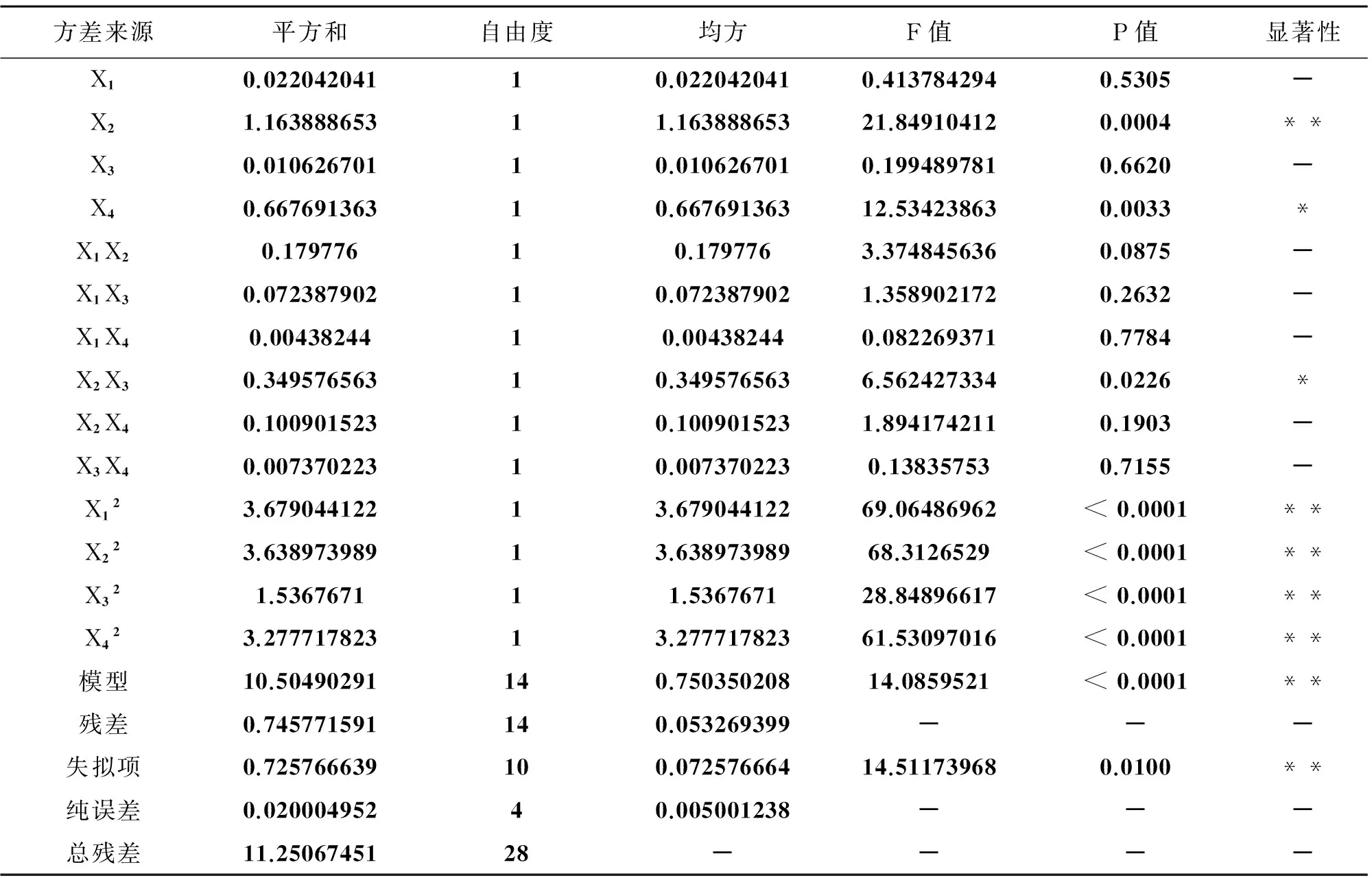
表5 响应面实验方差分析
注:* 表示差异显著,** 表示差异极显著。
通过Design-Expert 7.0软件对表3中的数据得到以上四个因素与红茂草中黄酮类化合物得率Y(%)之间的模拟方程为:
Y=2.8382+0.0429X1+0.3114X2+0.0297X3+0.2359X4+0.2120X1X2-0.1345X1X3+0.0331X1X4+0.2956X2X3+0.1588X2X4-0.0429X3X4-0.7531X12-0.7490X22-0.4867X32-0.7109X42
该回归模型F检验为极显著(P<0.01),纯误差项不显著,其决定系数r2=0.8752,说明该拟合方程与实际情况相符,且误差较小,能充分反映出各因素与响应值之间的关系,其影响不是呈简单的线性关系。通过该方程发现,各种因素之间存在着一定的交互作用,其中X2、X12、X22、X32、X42均呈极显著影响(P<0.01),X4、X2X3呈显著影响(P<0.05),X1、X3、X1X2、X1X3、X1X4、X2X4、X3X4均呈不显著。
从单因素水平观察,可以得出其影响顺序为:X2(超声时间)>X4(乙醇体积分数)>X1(液料比)>X3(回流时间)。在有交互作用存在下,对红茂草中黄酮类化合物含量的影响顺序为:X2X3>X1X2>X2X4>X1X3>X3X4>X1X4。
2.4.3黄酮类化合物得率的响应曲面分析与优化各影响因素之间两两相互关系对红茂草中黄酮类化合物含量影响的响应面图,见图1所示。
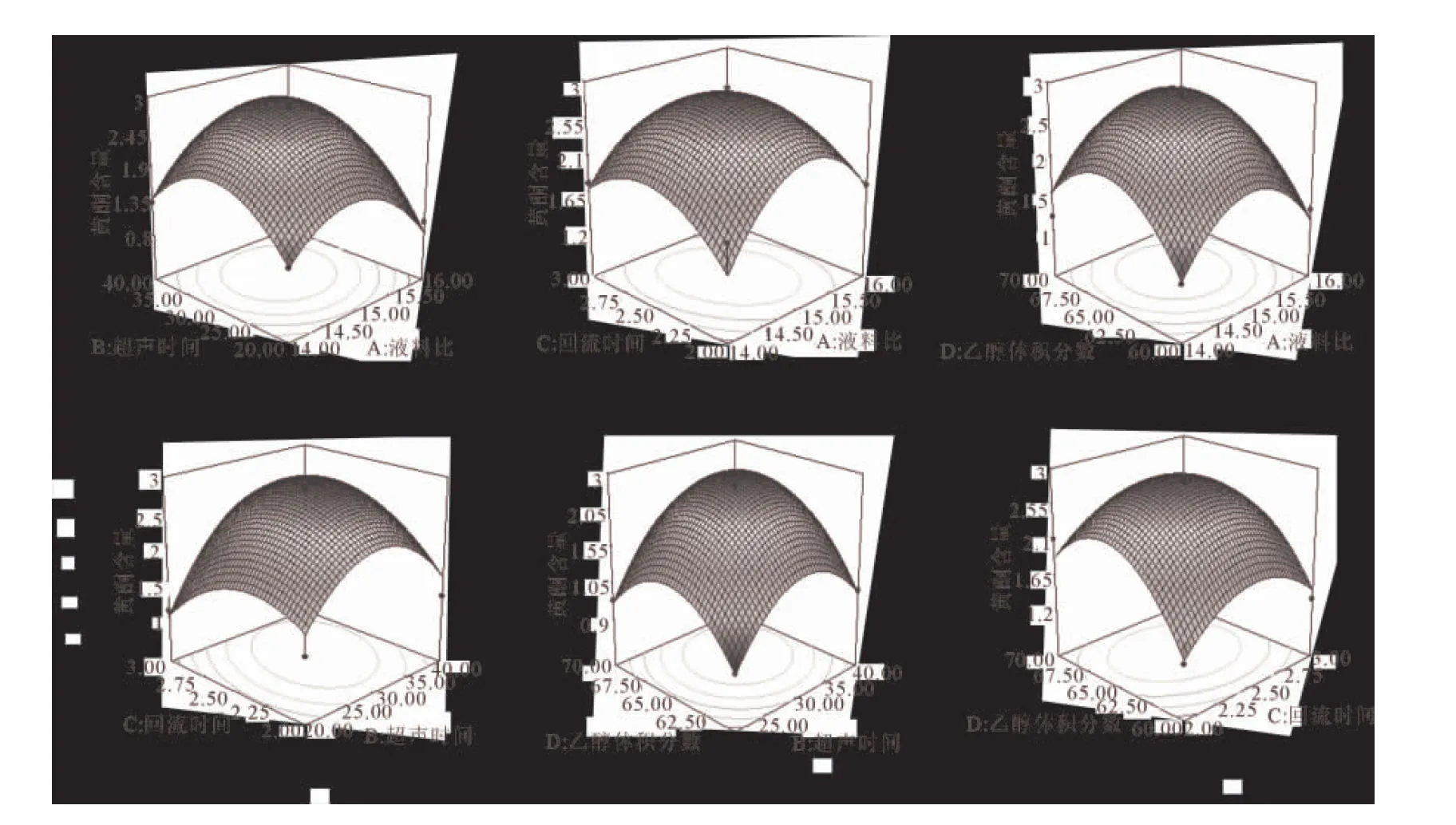
图1各因素之间的等高线图和响应面图
从各因素之间两两相互作用的响应面图形观察,发现其中曲线走势越陡,其影响越显著;曲线走势越平滑,其影响越小。超声时间、乙醇体积分数和液料比的图形曲线走势较陡,说明其影响显著。由Design-Expert 7.0软件进行系统分析,得出影响红茂草中黄酮类化合物含量的最佳提取工艺条件为:液料比15.70 mL/g、超声时间33.36 min、回流时间2.51 h、乙醇体积分数66.09%、黄酮类化合物含量为2.60%,结合实际操作过程中的局限性,最终确定修正后的工艺条件为:液料比15 mL/g、超声时间35 min、回流时间2.5 h、乙醇体积分数65%,在此工艺下红茂草中黄酮类化合物为2.60%。按照优化条件进行平行三组提取实验,取平均值为2.59%,与理论值相差0.39%,说明采用响应面法优化的提取条件可靠。使用响应面法实验设计,克服了正交设计只能处理离散的水平值,而无法找出整个区域上因素的最佳组合和响应值的最优值的缺陷,并能减少实验次数,分析几种因素间的交互作用,以达到较全面地反映各因素水平的效果。
2.4.4HPLC检测结果将芦丁标准品和在响应面优化条件下提取浓缩至无醇味的红茂草提取物进行HPLC检测,见图2所示。
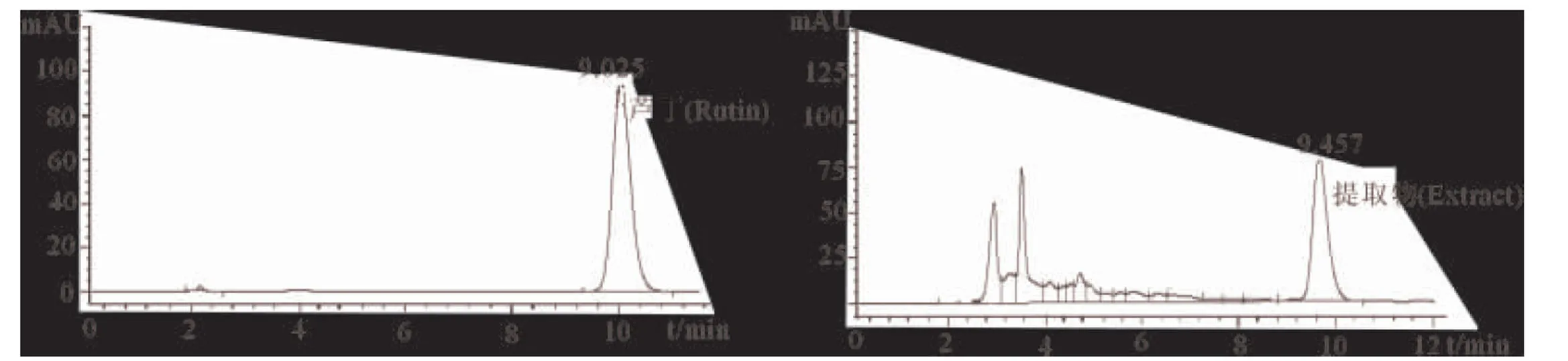
图2 HPLC检测结果
在选定波长为280 nm处,将芦丁标准品与响应面优化条件下提取的红茂草样品分别进行HPLC检测。由上图可知,将芦丁标准系列得到的标准曲线为色谱峰面积Y,得归一化方程为:Y=70.289X-8.7089(R2=0.9995),0.352~24 μg/mL;芦丁标准品保留时间tR=9.658 min,范围为9.326~11.015 min。优化条件下提取的红茂草中提取的黄酮类化合物在9.457 min时出峰,峰形对称,与标样接近。平均回收率为99.78%、RSD为2.4%,表明精密度良好、重现性好。
2.5 抑菌结果
由表6可知,红茂草黄酮类提取物对大肠埃希氏杆菌和金黄色葡萄球菌的MIC为:0.28和0.20 g/mL,MBC为:0.26和0.10 g/mL,IC50为:0.2162和0.1805 g/mL。

表6 红茂草黄酮类提取物抑菌效果
注:表中数据为3次重复实验的平均值。(“+”表示有菌生长;“++”表示细菌生长较茂盛;“+++”表示细菌生长茂盛;“-”表示无菌生长。)
2.6超微结构观察
以红茂草黄酮类提取物对大肠埃希氏杆菌和金黄色葡萄球菌的抑制作用结果50 000倍电镜图。
2.6.1E. coli抑制效果加入红茂草黄酮类提取物前后,大肠埃希氏杆菌变化电镜照片如图3所示。

(A)E. coli (B)药液处理后的E.coli
图3红茂草黄酮类提取物加入前后E. coli的透射电镜图(×50000)
对照组(图3A)的切面呈杆状,菌细胞大小基本一致,排列整齐,细胞壁、细胞膜完整,胞质均匀,内缘与细胞膜间无空隙。红茂草黄酮类提取物加入后E.coli(图3B)形态多样,排列不整齐,多以球形体为主,并可见不规则形,细胞壁变薄不完整,或者已经破裂,有些菌体的细胞壁部分或全部脱落消失,细菌轮廓模糊,外观呈毛刺状,结构不清且发生不同程度的凹陷变形,细胞外有溶出物溢出。
2.6.2S.aureus抑制效果加入红茂草黄酮类提取物前后,金黄色葡萄球菌变化照片如图4所示。
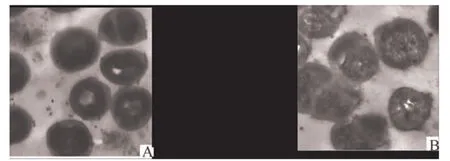
(A)S.aureus (B)药液处理后的S.aureus
图4红茂草黄酮类提取物加入前后S.aureus的透射电镜图(×50000)
对照组(图4A)的菌细胞切面呈葡萄球状,表面光滑圆润,菌细胞结构完整、清晰,细胞壁边缘整齐、细胞膜完整;红茂草黄酮类提取物加入后S.aureus的形态发生变化(图4B),菌细胞结构、层次不清,外围有液体溢出的痕迹,细胞壁局部似乎比对照组更厚,还可观察到有缺乏任何细胞内结构的细菌碎片。
3结论
本试验以药用植物红茂草中黄酮类化合物(芦丁)的含量为标准,首先考察了乙醇体积分数、液料比、回流时间、超声时间、浸泡时间、浸提液pH等6组单因素水平对红茂草中黄酮类化合物的影响,最终筛出4组主要因素进行响应面实验设计,确定其最佳提取工艺条件为:液料比15 mL/g、超声时间35 min、回流时间2.5 h、乙醇体积分数65%,在此工艺下黄酮类化合物含量为2.60%。HPLC检测进一步验证响应面法提取工艺的可靠性,为红茂草中黄酮类化合物含量做了进一步准确测定。通过抑菌实验发现:红茂草黄酮类提取物对对大肠埃希氏杆菌和金黄色葡萄球菌的MIC为:0.28和0.20 g/mL,MBC为:0.26和0.10 g/mL,IC50为:0.2162和0.1805 g/mL。对供试细菌进行50 000倍透射电镜观察,表明其抑菌效果显著,进一步说明了红茂草黄酮类提取物的抑菌性能较强。
红茂草在甘肃省天水地区分布广泛,有清热、消肿、解毒等功效。通过对红茂草中黄酮类化合物的响应面提取工艺及抑菌活性研究,为该药物资源的进一步深层次开发提供了基础。
参考文献:
[1]赵强,余四九,王廷璞,等.响应面法优化秃疮花中生物碱提取工艺及抑菌活性研究[J].草业学报,2012,21(4):206-214.
[2]畅行若,王宏新,马广恩.秃疮花化学成分的研究[J].中国药学杂志,1981(2):52.
[3]赵强,王廷璞,廖天录,等.红茂草生物碱TLC检测技术的建立及抑菌活性研究[J].中兽医医药杂志,2010(6):47-51.
[4]赵强,王廷璞,余四九,等.红茂草生物碱抑菌活性测定[J].中国兽医科学,2008,38 (12):1098-1101.
[5]赵强,王廷璞,董晓宁,等.酸性染料比色法测定红茂草中总生物碱含量[J],中兽医医药杂志,2011(6):38-40.
[6]Wenhua Zhang, Minghua Lv, Jun Hai,Qingpu Wang, Qin Wang. Dicranostigma leptopodum (maxim) fedde induced apoptosis in SMMC-7721 human hepatoma cells and inhibited tumor growth in mice[J]. Natural Science, 2010, 2:457-463.
[7]Hefen Sun, Helei Hou, Ping Lu, Lixing Zhang, Fangyu Zhao, Chao Ge, Tingpu Wang, Ming Yao,Jinjun Li. Isocorydine Inhibits Cell Proliferation in Hepatocellular Carcinoma Cell Lines by Inducing G2/M Cell Cycle Arrest and Apoptosis[J]. PLOS ONE, 2012, 7(5):1-11.
[8]赵强,王廷璞,余四九,等.红茂草生物碱正交提取工艺模式优化及清除自由基作用的研究[J].草地学报,2012,20:71-78.
[9]毛爱红,唐德平,夏小慧等.秃疮花提取物对CCl4诱导的小鼠急性肝损伤的影响[J].兰州大学学报(医学版).2008,34(2):18-20.
[10]Yakubu MBello, OdamaLE, NanditaB De. Studies on the Antibacterial Activity of the Extract of Stachysarpheta angustifolia[J]. Acta Universitatis Medicinalis NanJing, 2003, 23,(4): 424-424.
[11]Zakaria El Astal. The inhibitory action of aqueous garlic extract on the growth of certain pathogenic bacteria[J]. European Food Research and Technology, 2004, 218(5) :460-464.
[12]Somchit M N, Reezal I, Nur I Elysha, In vitro antimicrobial activity of ethanol and water extracts of Cassia alata [M]. Journal of Ethnopharmacology, 2003, 84 (1) :1-4 .
[13]Qian Xu, Yanyan Shen, Haifeng Wang, Niping Zhang, Shi Xu, Ling Zhang. Application of response surface methodology to optimise extraction of flavonoids from fructus sophorae[J]. Food Chemistry, 138 (2013):2122-2129.
[14]Jun Lu, Chi Zhou, Ou Rong, Yanyan Xu, Bo Zhou and Zhonghai Li. Optimization of Microwave-assisted Extraction of Flavonoids from Cryptotaenia japonica Hassk using Response Surface Methodology[J]. Advance Journal of Food Science and Technology ,2013,5(3): 310-317.
[15]Lianxin Peng, Liang Zou, Jianglin Zhao, Dabing Xiang, Peng Zhu, Gang Zhao. Response surface modeling and optimization of ultrasound-assisted extraction of three flavonoids from tartary buckwheat (Fagopyrum tataricum)[J].Pharmacognosy Magazine. 2013 Jul-Sep; 9(35): 210-215.
[16]Wentao Bia, Minglei Tian, Kyung Ho Row, Evaluation of alcohol-based deep eutectic solvent in extraction and determination of flavonoids with response surface methodology optimization[J]. Journal of Chromatography , 1285 (2013) 22-30.
[17]Baokun Tang, Yu Jin Lee, Yu Ri Lee, Kyung Ho Row. Examination of 1-methylimidazole series ionic liquids in the extraction of flavonoids from Chamaecyparis obtuse leaves using a response surface methodology[J]. Journal of Chromatography B, 933 (2013) 8-14.
[18]Soma Roy ,Kiranmayee Rao , Ch. Bhuvaneswari,Archana Giri, Lakshmi Narasu Mangamoori.Phytochemical analysis of Andrographis paniculata extract and its antimicrobial activity[J]. World journal Microbiol Biotechnol (2010) 26:85-91.
[19]Ran, X. Y., Hu, D. Y., & Xue, W. Research on the extracting and purification process of the Aempferide in Fructus Sophorae. Journal of Guizhou Education Institute (Natural Science), (2009).20, 22-24.
[20]Liang Yu, Hosahalli S,Ramaswamy ,Joyce Boye. Twin-screw Extrusion of Corn Flour and Soy Protein Isolate(SPI) Blends: A Response Surface Analysis[J]. Food Bioprocess Technology,2009, 2012, 5(2):485-497.
[21]Guan, X., & Yao, H. Y. (2008). Optimization of Viscozyme L-assisted extraction of oatbran protein using response surface methodology. Food Chemistry, 106,345-351.
[22]Karacabey, E., & Mazza, G. (2010). Optimisation of antioxidant activity of grapecane extracts using response surface methodology. Food Chemistry, 119,343-348.
[23]Nagendra, P. K., Abdulrahman, H. F., & Bao, Y. (2011). Response surface optimization for the extraction of phenolic compounds and antioxidant capacities of underutilised Mangifera pajang Kosterm.peels. Food Chemistry, 128, 1121-1127.
[24]Wang, H. W., Liu, Y. Q., & Wei, S. L. (2012). Application of response surface methodology to optimise supercritical carbon dioxide extraction of essential oil from Cyperus rotundus Linn. Food Chemistry, 132, 582-587.
[25]Mehrnoush A, Mustafa S, Sarker MZ, Yazid AM. Optimization of the conditions for extraction of serine protease from kesinai plant (Streblus asper) leaves using response surface methodology. Molecules. 2011;16:9245-9260.
[26]Ryad A, Lakhdar K, Majda KS, Samia A, Mark A, Corinne AD. Optimization of the Culture Medium Composition to Improve the Production of Hyoscyamine in Elicited Datura stramonium L. Hairy Roots Using the Response Surface Methodology (RSM) Int J Mol Sci. 2010;11:4726-4740.
Optimization of Extracting Technology of Flavonoid from Dicranostigma Leptopodum (maxim.)Fedde and Study on its Antibacterial Activity in Vitro
ZHAO Qiang, WANG Ting-pu
(CollegeofBioengineeringandTechnology,TianshuiNormalUniversity,TianshuiGansu741000)
Abstract:On the basis of single factor level determination of screening, the extraction technology of flavonoid from Dicranostigma leptopodum(maxim.)Fedde (DLF) was optimized by using the response surface analysis. Extractive was used by Diamonsil C18 (4.6mm×150mm,1.8μm). The stationary phase was chromatographic column, mobile phase was methanol-0.2% phosphoric acid(65:35,v/v), the flow rate was 1.0 mL/min, and detection wavelength was 254 nm. Antibacterial activities of the extracts were measured. Providing E. coli and S.aureus as the tested strains, antibacterial activity in vitro was researched and transmission electron microscope images were observed. The results demonstrated that the optimum condition of extraction technology of flavonoids from DLF as follow: liquid to solid ratio was 15 mL/g, ultrasound time was 35 min, refluxing time was 2.5h, and alcohol was 65%. In these conditions, the content of flavonold from DLF was 2.60% and HPLC detection had good reproducibility. The MIC of flavonoids on E.coli and S.aureus were 0.28 and 0.20 g/mL, respectively. The MBC were 0.26 and 0.10 g/mL, respectively. The IC50 were 0.2162 and 0.1805g/mL, respectively.Observed under transmission electron microscopy, the effects of antibacterial activity were significant. The results showed that the response surface analysis to optimization of extraction process of flavonoid from DLF was quite reasonable.
Key words:response surface analysis; Dicranostigma leptopodum(maxim.)Fedde; flavonoid
[收稿日期]2015-09-14
[基金项目]2013年国家自然科学基金项目(31360603)。
[作者简介]赵强(1982-),男,甘肃天水人,博士,高级工程师。研究方向为西北特色生态经济动植物资源开发与利用。
[中图分类号]S 859.7999
[文献标识码]A
[文章编号]1004-6704(2016)01-0004-09
