初始pH对嗜线虫致病杆菌YL001菌株抑菌活性及代谢的影响
2016-07-02郭树奇王泽宇王永宏
郭树奇,许 鹏,鲁 梅,王泽宇,王永宏,张 兴
(西北农林科技大学 无公害农药研究服务中心,陕西 杨凌 712100;2 陕西省杨凌区高新中学,陕西 杨凌 712100)
初始pH对嗜线虫致病杆菌YL001菌株抑菌活性及代谢的影响
郭树奇1,许鹏1,鲁梅1,王泽宇2,王永宏1,张兴1
(西北农林科技大学 无公害农药研究服务中心,陕西 杨凌 712100;2 陕西省杨凌区高新中学,陕西 杨凌 712100)
[摘要]【目的】 研究初始培养pH对Xenorhabdus neamatophila YL001发酵液抑菌活性的影响,为进一步提高YL001的抑菌活性提供理论依据。【方法】 采用生长速率法、琼脂扩散法、活体组织法,分别测定了初始pH 4.5,5.5,6.5,7.0,7.5和8.5培养条件下,X.neamatophila YL001发酵液及其乙酸乙酯提取物的抑菌活性;同时采用HPLC、LC-MS分析了乙酸乙酯提取物中代谢物的差异。【结果】 随着初始pH的升高,共生菌发酵液及其乙酸乙酯提取物的抑菌活性也逐步提高。pH8.5时,YL001发酵液对水稻瘟疫病菌(Magnaporthe grisea)、辣椒疫霉病菌(Phytophthora capsici)、番茄灰霉病菌(Botrytis cinerea)、苹果轮纹病菌(Physalospora piricola)、番茄早疫病菌(Alternaria solani)、甘蓝黑斑病菌(Alternaria brassicae)以及枯草芽孢杆菌(Bacillus subtilis)均具有最强的抑制作用,发酵液乙酸乙酯提取物对番茄灰霉病的EC50为1.29 mg/mL,对枯草芽孢杆菌的抑菌圈直径为14.65 mm。随着初始培养pH的升高,YL001发酵液及乙酸乙酯提取物对番茄灰霉病的治疗和保护作用也逐渐提高,保护作用明显优于治疗作用。HPLC和LC-MS代谢分析表明,pH8.5、pH 7.0及pH 4.5培养条件下发酵液乙酸乙酯提取物中代谢物含量存在显著差异。【结论】 初始培养pH可以显著影响X.neamatophila YL001的抑菌活性及代谢能力,碱性条件更有利于活性物质的产生及其稳定性的保持。
[关键词]嗜线虫致病杆菌;初始pH;胞外产物;抑菌活性
昆虫病原线虫共生细菌是一种寄生于昆虫病原线虫肠道内的革兰氏阴性细菌,属肠杆菌科(Enteobacteriaceae),包括致病杆菌属(Xenorhabdus)和发光杆菌属(Photorhabdus),分别与斯氏线虫(Steinernema)和异小杆线虫(Heterorhabditis)共生[1]。产生具有抗菌活性的次生代谢产物是共生菌的普遍特征,到目前为止,已从致病杆菌和发光杆菌中分离鉴定出30多种生物活性成分(主要为乙腈类、酰胺类、吲哚类、二硫吡咯类、水溶性苯并芘类、羟化二苯乙烯类、蒽醌类、肽类化合物),其中从致病杆菌中分离的生物活性成分主要有乙腈类化合物Rhabduscin、 酰胺类化合物Nematophin、 吲哚类化合物Indoles等[2],这些代谢产物不仅具有多种化学结构,而且在医药和农业上具有广泛的生物活性,如抗肿瘤[3-5]、杀虫[6]、杀线虫[7]、抑菌[8-9]等。同时,这些化合物结构新颖、生物活性高,具备开发新型农药的潜质,在农业和医药卫生领域应用前景方阔。
近年来X.nematophilaATCC 19061、X.bovienii和PhotorhabdusluminescensTT01全基因组序列已经完成并公布[10-11]。全基因组序列分析发现,共生菌中含有的次生代谢产物生物合成基因簇的数量远多于已分离鉴定的次生代谢产物的数量,大量的次生代谢产物生物合成基因簇没有表达,处于隐藏状态,共生菌次生代谢产物的多样性有进一步挖掘的潜力[2,9-11]。昆虫病原线虫共生菌次生代谢物的产生与菌种、菌株及培养条件密切相关。不同种的致病杆菌产生的抑菌物质有较大差异,同一菌株在不同培养条件下的代谢也有一定差异[12-17]。培养条件的改变不仅可以影响X.nematophila代谢产物含量的变化,而且还可影响其总体的代谢特征,有利于促进次生代谢产物的生物合成及隐藏天然产物的发现与挖掘[2,18-19]。初始pH作为细菌生长的重要影响因子,对共生菌细胞生长、代谢产物的产生以及生物活性同样具有重要作用[20-22]。
X.nematophilaYL001是从陕西杨凌土壤中筛选的昆虫病原线虫Steinernemasp.YL001中分离获得的1株共生菌[23],前期研究已证明其具有广泛的抑菌活性,特别是对番茄灰霉病和辣椒疫霉病具有很强的抑制作用[24]。为进一步提高YL001菌株的抗菌活性,促进其隐藏天然产物的开发,本研究采用生长速率法、琼脂扩散法、活体组织法,分别测定了初始pH 4.5,5.5,6.5,7.0,7.5和8.5培养条件下X.neamatophilaYL001发酵液及其乙酸乙酯提取物的抑菌活性,并采用HPLC、LC-MS分析了初始pH对X.nematophilaYL001代谢的影响,旨在为进一步提高YL001的抑菌活性提供理论依据。
1材料与方法
1.1供试菌株与培养基
1.1.1供试菌株XenorhabdusnematophilaYL001(简称YL001),来源于共生线虫Steinernemasp(采自杨凌),均由西北农林科技大学无公害农药研究服务中心提供。
1.1.2供试病原菌辣椒疫霉病菌(Phytophthoracapsici)、番茄灰霉病菌(Botrytiscinerea)、水稻瘟疫病菌(Magnaporthegrisea)、苹果轮纹病菌(Physalosporapiricola)、油菜菌核病菌(Sclerotiniasclerotiorum)、小麦赤霉病菌(Fusariumgraminearum)、番茄早疫病菌(Alternariasolani)、棉花黄萎病菌(Fusariumoxysporiumf.sp.vasinfectum)、苹果炭疽病菌(Clomerelacinyulate)、玉米大斑病菌(Exserohilumturcicum)、棉花枯萎病菌(Verticilliumdahliae)、甘蓝黑斑病菌 (Alternariabrassicae)、玉米弯孢病菌(Curvularialunata(Wakker) Boed)、蜡状芽孢杆菌(Bacilluscereus)、枯草芽孢杆菌(Bacillussubtilis)、苏云金芽孢杆菌(Bacillusthuringiensis)、白菜软腐病菌(Erwiniacarotorora)、水稻白叶枯病菌(Xanthomonascampestris)、猕猴桃溃疡病菌(Pseudomonassyringae),均由西北农林科技大学无公害农药研究服务中心提供。
1.1.3培养基菌种活化培养基为NB培养基;鉴别培养基为NBTA培养基;发酵培养基:葡萄糖 6.13 g/L,蛋白胨21.29 g/L,MgSO41.50 g/L,(NH4)2SO42.46 g/L,KH2PO40.86 g/L,K2HPO41.11 g/L,Na2SO41.72 g/L;病原真菌培养基为PDA培养基;病原细菌培养基为NA培养基。各处理发酵培养基初始pH分别用0.1 mol/L NaOH及0.1 mol/L HCl调节pH为4.5,5.5,6.5,7.0,7.5和8.5;其余培养基pH为7.2~7.4。
1.2不同初始pH条件下X.nematophilaYL001胞外代谢产物的制备
取种管保存的共生菌,分别挑取单菌落于NB培养基,28 ℃、180 r/min活化24 h后划线于NBTA平板,28 ℃培养48 h,挑取蓝色初生型单菌落接种于NB培养基,28 ℃、180 r/min振荡培养16 h,以9%接种量转接于发酵培养基,同样条件下培养72 h,得共生菌发酵液,9 000 r/min、4 ℃离心30 min,然后取上清液用于抑菌活性测定。乙酸乙酯提取物分别用等体积乙酸乙酯萃取3次,浓缩后置40 ℃烘箱烘干,干物质获得率为545 mg/L。
1.3YL001菌株发酵液对病原菌的抑制作用
1.3.1对植物病原真菌的抑制作用采用生长速率法[24-25]测定发酵液对13种植物病原真菌菌丝生长的抑制作用。菌饼直径4 mm,以无菌水为对照。
1.3.2对植物病原细菌的抑制作用采用琼脂扩散法[23-24]测定共生菌胞外代谢物对6种供试病原细菌的抑制作用。供试发酵液测定用量为60 μL,以发酵培养基为对照,28 ℃培养48 h,十字交叉法测量抑菌圈直径。
1.4YL001菌株发酵液及其乙酸乙酯提取物对番茄灰霉病的抑制作用
1.4.1发酵液对番茄灰霉病的抑制作用采用活体组织法分别测定 YL001菌株发酵液对番茄灰霉病防治的保护作用及治疗作用,以50%腐霉利可湿性粉剂1 000倍稀释液为药剂对照,无菌水为空白对照,5 d后调查防治效果[24]。
1.4.2发酵液乙酸乙酯提取物对番茄灰霉病的抑制作用采用活体组织法分别测定乙酸乙酯提取物对番茄灰霉病防治的保护作用及治疗作用,以80%多菌灵可湿性粉剂800倍稀释液为药剂对照,无菌水为空白对照,5 d后调查防治效果。
1.4.3发酵液乙酸乙酯提取物对番茄灰霉病菌的毒力采用生长速率法测定,以无菌水为空白对照。乙酸乙酯提取物毒力测定设6.81,3.41,1.70,0.85和0.43 mg/mL 5个质量浓度。
1.5YL001菌株乙酸乙酯提取物对枯草芽孢杆菌的抑制作用
采用琼脂扩散法测定,参见1.3.2节的方法。
1.6不同初始pH条件下 YL001菌株胞外代谢产物的差异分析
采用HPLC[2]及LC-MS分析不同初始pH培养条件下共生菌发酵液代谢产物乙酸乙酯提取物成分的差异。将乙酸乙酯提取所得的粗提物蒸干溶于8 mL甲醇,进样。色谱柱:Agilent ZORBAX Eclipse XDB C18 column (250 mm×4.6 mm,3.5 μm) HPLC 柱;流速:1 mL/min ;流动相:0~2 min 10%乙腈,2~20 min 10%~40%乙腈,20~40 min 40%~100%乙腈,40~45 min 100%~10%乙腈,45~55 min 10%乙腈;检测波长:280 nm;液相进样量:5 μL。LC-MS体系选用Thermo ion trap LC-MS 系统 (Thermo Scientific,USA),离子源工作用阳离子模式,色谱柱:Agilent ZORBAX Eclipse XDB C18 column (250 mm×4.6 mm,3.5 μm);梯度洗脱条件同HPLC;流速0.4 mL/min;系统运行温度25 °C,进样体积10 μL。LC-MS条件:ESI喷雾电压,一级质谱(MS1)扫描范围选择m/z100~1 000。数据使用Xcalibur 2.1软件分析。
1.7数据分析
作图采用Excel 2007及Empower软件,方差分析采用SPSS18.0软件。
2结果与分析
2.1不同初始pH条件下X.nematophilaYL001发酵液对病原真菌的抑制作用
由表1可以看出,在不同初始pH条件下,X.nematophilaYL001发酵液对13种病原真菌菌丝生长均有不同程度的抑制作用,除小麦赤霉病菌外,随着初始pH的增加,X.nematophilaYL001发酵液对各病原真菌的抑制作用也逐渐增强,尤其是对水稻瘟疫病菌、辣椒疫霉病菌、番茄灰霉病菌、苹果轮纹病菌、番茄早疫病菌、甘蓝黑斑病菌的抑制作用均有显著提高。pH 8.5时YL001菌株发酵液对水稻瘟疫病菌、辣椒疫霉病菌、番茄灰霉病菌、苹果轮纹病菌、番茄早疫病菌、甘蓝黑斑病菌的抑制率分别为100.0%,91.34%,100.0%,100.0%,97.84%和99.28%。pH 4.5与pH 8.5时YL001发酵液对番茄灰霉病菌和油菜菌核病菌的抑制作用表现出极显著差异,碱性初始培养条件更有利于X.nematophilaYL001发酵液胞外抑菌活性物质的产生。
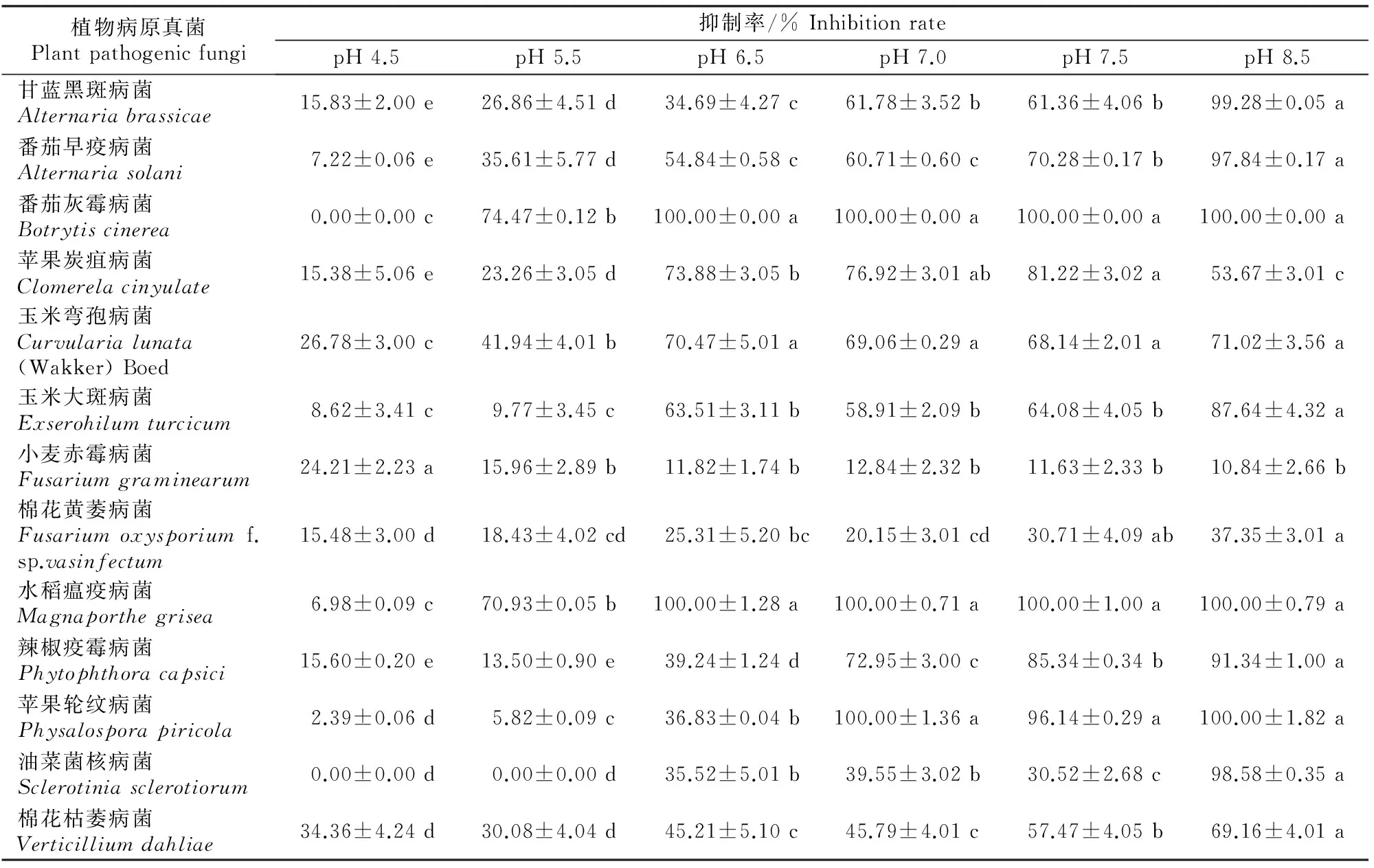
表 1 不同初始pH条件下Xenorhabdus nematophila YL001发酵液对病原真菌的抑制作用
注:同行数据后标不同小写字母者代表(DMRT 法)方差分析在P0.05水平上差异显著。表2同。
Note:Different lowercase letters in each row mean significant difference atP0.05level by Duncan’s Multiple Range Test.The same for Table 2.
2.2不同初始pH条件下X.nematophilaYL001发酵液对病原细菌的抑制作用
从表2可以看出,随着初始pH的升高,X.nematophilaYL001发酵液对植物病原细菌的抑制作用逐渐增强。在pH 8.5时,60 μL发酵液作用48 h后对枯草芽孢杆菌的抑菌圈直径达到21.00 mm。从测定结果可以看出,YL001发酵液对于革兰氏阳性细菌具有较好的抑制作用。
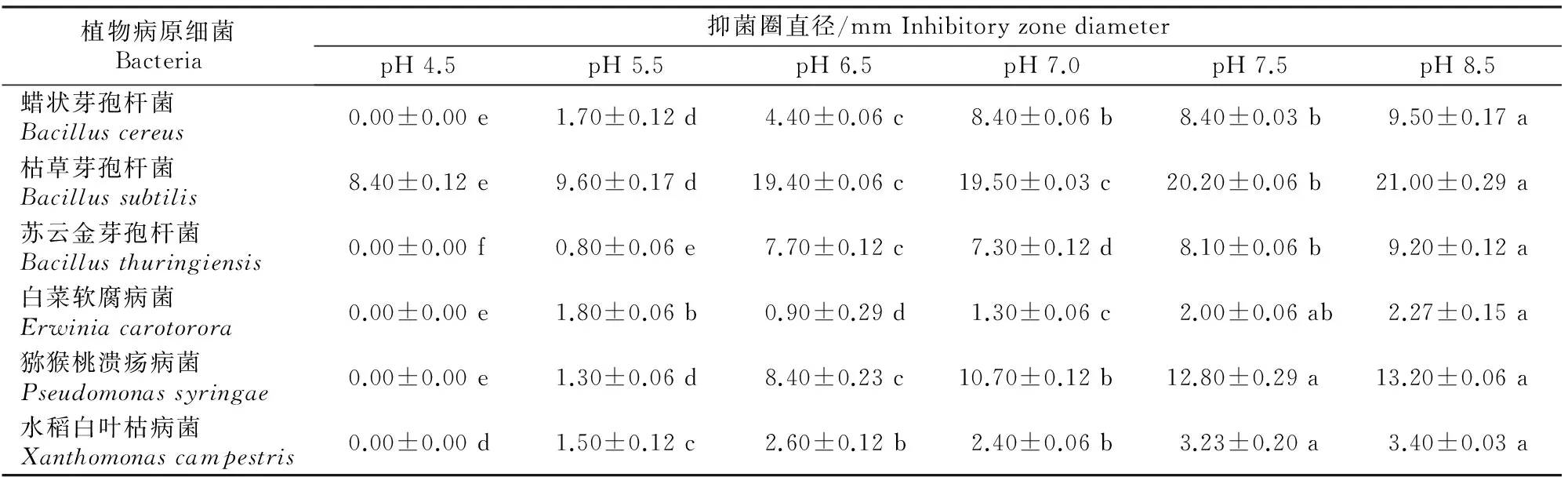
表 2 不同初始pH 条件下Xenorhabdus nematophila YL001发酵液对病原细菌的抑制作用
2.3X.nematophilaYL001发酵液对番茄灰霉病的防治效果
由图1可知,随着初始pH的升高,X.nematophilaYL001发酵液对番茄灰霉病的防治效果也呈上升趋势。各处理对番茄灰霉病菌的治疗作用为16.83%~44.81%,均低于50%,且低于对照药剂 (50%腐霉利1 000倍液)的治疗作用(83.22%);对番茄灰霉病的保护作用为45.17%~89.54%,其中在pH 8.5时保护作用达到89.54%,高于对照药剂的保护作用(78.69%)。不同初始pH下YL001发酵液对番茄灰霉病的治疗作用和保护作用存在差异,各处理对番茄灰霉病的保护作用优于治疗作用。
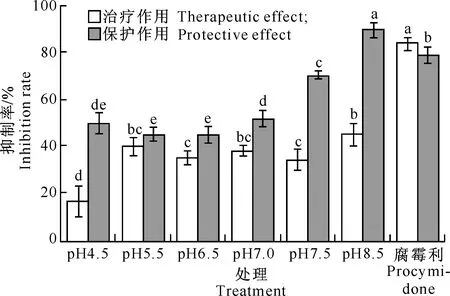
图 1 不同初始pH条件下Xenorhabdus nematophila
2.4X.nematophilaYL001发酵液乙酸乙酯提取物对番茄灰霉病的防治效果
由图2可知,随着初始pH的升高,X.nematophilaYL001发酵液乙酸乙酯提取物(2.5 mg/mL)对番茄灰霉病的防治效果也逐渐提高。各处理对番茄灰霉病的治疗作用为3.91%~39.94%,均低于50%,且低于对照药剂 (80%多菌灵1 mg/mL)的治疗作用(56.63%);对番茄灰霉病的保护作用为14.81%~61.22%,其中在初始pH 8.5时保护作用最好,防效为61.22%,但仍低于对照药剂的保护作用(72.86%)。不同初始pH条件下,YL001发酵液乙酸乙酯提取物对番茄灰霉病的治疗作用和保护作用存在差异,各处理对番茄灰霉病的保护作用优于治疗作用。
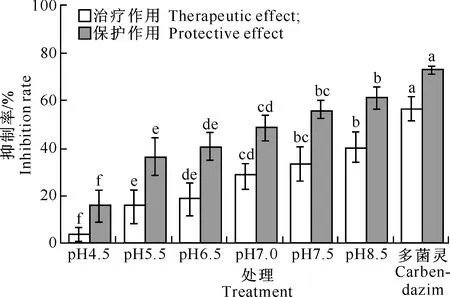
图 2不同初始pH条件下Xenorhabdusnematophila
YL001发酵液乙酸乙酯提取物对番茄灰霉病的防治效果
Fig.2Inhibitory effect of ethyl acetate extract of
XenorhabdusnematophilaYL001 fermentation
liquid onBotrytiscinereawith different initial pH values
2.5X.nematophilaYL001发酵液乙酸乙酯提取物对番茄灰霉病菌的毒力
由表3可以看出,不同初始pH条件下 YL001菌株发酵液乙酸乙酯提取物对番茄灰霉病菌菌丝生长有不同程度的抑制作用,其中在初始pH 8.5时,乙酸乙酯提取物对番茄灰霉病菌的抑制作用最强,EC50为1.29 mg/mL。
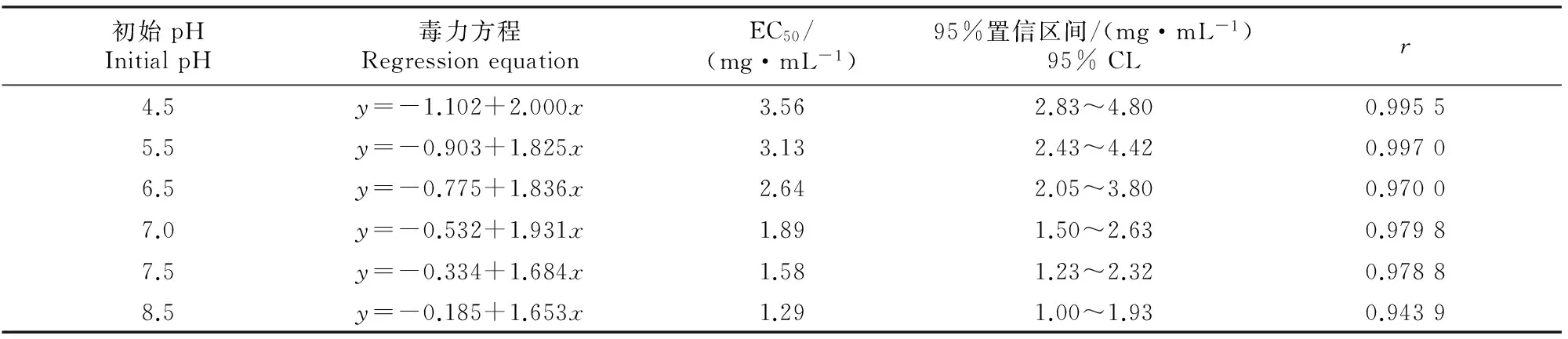
表 3 不同初始pH 条件下Xenorhabdus nematophila YL001发酵液乙酸乙酯提取物对番茄灰霉病菌的毒力
2.6X.nematophilaYL001发酵液乙酸乙酯提取物对枯草芽孢杆菌的抑制作用
由图3可见,不同初始pH培养条件下X.nema-tophilaYL001发酵液乙酸乙酯提取物(用甲醇溶解)对枯草芽孢杆菌的抑制作用随pH的增加逐渐递增。pH 8.5时,乙酸乙酯提取物对枯草芽孢杆菌的抑菌圈直径为14.65 mm,远高于pH 4.5时的2.45 mm,表明碱性条件可以提高YL001的抑菌活性。
2.7不同初始pH下X.nematophilaYL001发酵液代谢产物的差异
从图4可以看出,在不同初始pH条件下,X.nematophilaYL001发酵液乙酸乙酯提取物成分中乙腈类化合物(Rhabduscin)、酰胺类化合物(Nematophin)和吲哚类化合物(Indole6、Indole7、Indole8)的含量具有明显差异。
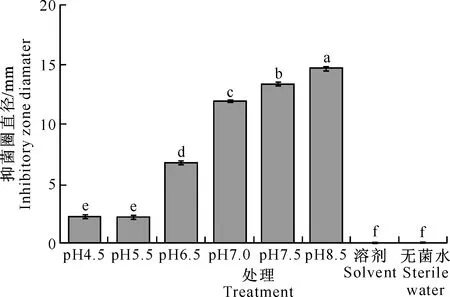
图 3 不同初始pH条件下Xenorhabdus nematophila
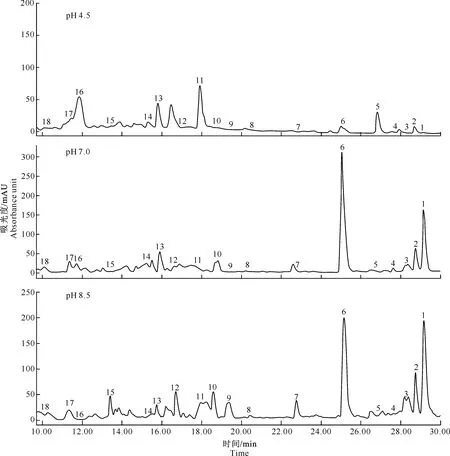
图 4pH 4.5、pH 7.0和pH 8.5培养条件下XenorhabdusnematophilaYL001发酵液代谢产物的差异
Fig.4Differential metabolite profiles ofXenorhabdusnematophilaYL001 fermentation liquid at pH of 4.5,7.0 and 8.5
保留时间在29.2 min(代谢峰1-Nematophin)、28.8 min(代谢峰2-Xenamatide)和16.77 min(代谢峰12-Rhabduscin)时,pH 8.5条件下的代谢峰高于pH 7.0和pH 4.5条件下;同时pH 4.5条件下,保留时间在29.2 min时没有代谢峰,说明pH 4.5条件下基本没有酰胺类化合物Nematophin生成。在保留时间分别为25.1 min(代谢峰6-Indole6)、26.6 min(代谢峰5-Indole7)、22.6 min(代谢峰7-Indole8) 时,pH 8.5、pH 7.0和pH 4.5培养条件下的代谢物轮廓存在明显差异。与pH 7.0和pH 4.5相比,在pH 8.5培养条件下多产生了代谢峰8,10和15,说明pH 8.5培养条件下有新物质产生。同时各培养条件下,其他代谢峰均存在显著差异,也进一步说明各培养条件下的次级代谢物种类和含量存在明显差异。从表4中LC-MS分析结果可以看出,在pH 8.5、pH 7.0和pH 4.5条件下各活性物质的相对含量也存在差异,尤其是在X.nematophilaYL001中起主要抑菌作用的活性物质,如乙腈类化合物和酰胺类化合物的含量, 在pH 8.5时分别比在pH 4.5时高28.50和17.52倍。

表 4 Xenorhabdus neamatophila YL001主要活性物质的相对含量
注:pH 8.5时各活性物质的含量被当作100.00。 同列数据后标不同小写字母代表(DMRT 法)在P0.05水平上有显著差异。
Note:The active substance contents at pH 8.5 were regarded as 100.00. Different lowercase letters in each column mean significant difference atP0.05level by Duncan’s Multiple Range Test.
3讨论
产生具有抑菌活性的次生代谢产物是线虫共生菌的普遍特征,不同种的共生菌产生的抑菌物质有较大差异,同一菌株在不同培养条件下的抑菌活性也有一定差异。这些差异主要是由pH、接种量、搅拌速度、溶氧量、培养基等培养条件通过影响共生菌的生长与代谢,进而影响抑菌活性物质的产生及其活性而造成的。嗜线虫致病杆菌产生的抑菌物质主要包括苯并吡喃类抗菌物质Xenocoumacin(XCN)、乙腈类化合物、酰胺类化合物、吲哚衍生物等,其中乙腈类化合物具有较强的抑制细菌活性,尤其是对枯草芽孢杆菌活性影响显著[26-27];Indole7对金黄色葡萄球菌抑制作用影响明显[26];酰胺类化合物对多种细菌和真菌表现出抗生素的活性,尤其是对枯草芽孢杆菌以及番茄灰霉病和辣椒疫霉病有明显的抑制作用[14]。
本研究结果表明,在不同初始pH条件下,X.nematophilaYL001胞外代谢产物的抑菌活性有显著差异,初始pH 8.5时YL001发酵液及其乙酸乙酯提取物离体及活体抑菌活性均最佳。这与李骞[28]的研究结果碱性条件更有利于保持X.nematophilaYL001代谢产物的稳定性及抑菌活性结果相符。LC-MS分析表明,不同初始pH条件下,X.nematophilaYL001发酵液中乙腈类化合物、酰胺类化合物、Indole6、Indole7以及Indole8等主要活性物质的含量均存在一定差异,其中在pH 8.5时乙腈类化合物和酰胺类化合物的含量分别比 pH 4.5 时高28.50和17.52倍,结合pH 8.5,7.0及4.5条件下HPLC代谢产物分析结果,进一步说明pH 8.5条件下YL001抑菌活性的提高可能是由于主要活性物质产量的升高或者新的活性物质产生所致。另外,在pH 8.5时,YL001菌株发酵液乙酸乙酯提取物对番茄灰霉病的EC50为1.29 mg/mL,低于Ng等[29]发现的X.bovieniiA2胞外代谢物乙酸乙酯提取物对病原真菌的EC50,但远高于Li等[14]发现的酰胺类化合物对番茄灰霉病的最小抑菌质量浓度(12 μg/mL)。这可能是由于不同种的共生菌产生的抑菌物质存在较大差异,同时也说明X.nematophilaYL001发酵液中活性成分的种类多于乙酸乙酯提取物中的活性成分,而对发酵液水溶性活性物质的含量和种类仍需进一步探讨。
共生菌中存在一种双组分信号转导系统CpxRA[30],主要感应细胞包膜压力、碱性pH等信号并调控抵御这些压力的相关基因的转录与表达。基于X.nematophilaATCC 19061、X.bovienii和P.luminescens全基因组序列分析[10-11],现已发现多种合成共生菌代谢产物的基因簇,如isnA、isnB编码的活性物质Isocyanide和Rhabduscin1[2,27]。本实验室也已研究证明共生菌YL001中存在isnA、isnB等生物合成基因簇[31-32],今后需要在不同pH对共生菌抑菌活性影响的研究基础上,通过分子生物学手段对不同pH条件下双组分信号转导系统CpxRA及次生代谢产物的生物合成基因的转录与表达进行分析,以期探明pH调控共生菌抑菌物质产生的分子机理,为共生菌抑菌物质产生的代谢调控奠定基础,并有望获得新的抑菌活性物质。
[参考文献]
[1]Thomas G M,Poinar G O.Xenorhabdusgen nov,a genus of entomopathogenic nematophilic bacteria of the family Enterobacteriaceae [J].International Journal of Systematic Bacteriology,1979,29(4):352-360.
[2]Crawford J M,Kontnik R,Clardy J.Regulating alternative lifestyles in entomopathogenic [J].Bacteria Current Biology,2010,20(1):69-74.
[3]Webster J M,Li J,Chen G.Xenomins novel heterocyclic compounds with antimicrobial and antineoplastic:5827872 [P].1998-10-27.
[4]Webster J M,Li J,Chen G.Anticancer property of dithiolopyrrolones:6020360 [P].2000-02-01.
[5]吕秋军,简恒,刘卫京,等.从嗜线虫杆菌分离的吲哚衍生物抗肿瘤活性的研究 [J].中国新药杂志,2002,11(11):850-852.
Lü Q J,Jian H,Liu W J,et al.Study on the anti-tumor activity of an indole derivative isolated fromXenorhabdus[J].Chinese Journal of New Drug,2002,11(11):850-852.(in Chinese)
[6]McInerney B V,Gregson R P,Lacey M,et al.Biologically active metabolites fromXenorhabdusspp:Ⅰ.Dithiolopyrrolone derivatives with antibiotic activity [J].Journal of Natural Product,1991,54(3):774-784.
[7]Hu K,Li J,Webster J M.Nematicidal metaboiltes produced byPhotorhabdusluminescens,bacterial symbiont of entomopathogenic nematodes [J].Nematology,1999,1(5):457-469.
[8]Akhurst R J.Morphological and functioncal dimorphism inXenorhabdusapp.,bacteria symbiotically associated with the insect pathogenic nematodesNeoaplectanaandHeterorhabditis[J].Journal of General Microbiology,1980,121(2):303-309.
[9]Chen C,Dunphy G B,Webster J M.Antifungal activity of twoXenorhabdusspeciesandPhotorhabdusluminescens,bacteria associated with nematodesSteinernemaspecies andHeterohabditismegidis[J].Biologicoal Contronl,1994,4(2):157-162.
[10]Duchaud E,Rusniok C,Frangeul L,et al.The genome sequence of the entomopathogenic bacteriumPhotorhabdusluminescens[J].Nature Biotechnology,2003,21(11):1307-1313.
[11]Chaston J M,Suen G,Tucker S L,et al.The entomopathogenic bacterial endosymbiontsXenorhabdusandPhotorhabdus:convergent lifestyles from divergent genomes [J].PLoS One,2011,6(11):1-13.e27909.
[12]Qiu X,Han R,Yan X,et al.Identification and characterization of a nov gene involved in the trans-specific nematicidal activity ofPhotorhabdusluminescensLN2 [J].Applied and Environmental Microbiology,2009,75(12):4221-4223.
[13]McInerney B V,Taylor W C,Lacey M J,et al.Biologically active metabolites fromXenorhabdusspp:2.Benzopyran-1-one derivatives with gastroprotective activity [J].Journal of Natural Products,1991,54(3):785-795.
[14]Li J X,Chen G H,Webster J M.Nematophin,a novel antimicrobial substance produced byXenorhabdusnematophilus(Enterobacteriaceae) [J].Canadian Journal of Microbiology,1997,43(8):770-773.
[15]Lang G,Kalvelage T,Peters A,et al.Linear and cyclic peptides from the entomopathogenic bacteriumXenorhabdusnematophilus[J].Journal of Natural Products,2008,71(6):1074-1077.
[16]Gualtieri M,Aumelas A,Thaler J O.Identification of a new antimicrobial lysine-rich cyclolipopeptide family fromXenorhabdusnematophila[J].Journal Antibiotics,2009,62(6):295-302.
[17]Fuchs S W,Proschak A,Jaskolla T W,et al.Structure elucidation and biosynthesis of lysine-rich cyclic peptides inXenorhabdusnematophila[J].Organic & Biomolecular Chemistry,2011,9(9):3130-3132.
[18]Vizcaino M I,Guo X,Crawford J M.Merging chemical ecology with bacterial genome mining for secondary metabolite discovery [J].Journal of Industrial Microbiology & Biotechnology,2014,41(2):285-299.
[19]Crawford J M,Portmann C,Kontnik R,et al.NRPS substrate promiscuity diversifies the xenematides [J].Organic Letters,2011,13(19):5144-5147.
[20]邱德文,焦宁宁,刘峥,等.致病杆菌D43菌株产素培养基及发酵 [J].中国生物防治,2006,22(1):58-62.
Qiu D W,Jiao N N,Liu Z,et al.Cultural medium and fermentation conditions ofXenorhabdussp strain D43 [J].Chinese Journal of Biological Control,2006,22(1):58-62.(in Chinese)
[21]杨秀芬,杨怀文,简恒,等.嗜线虫致病杆菌产生抗生素的培养基及条件 [J].微生物学通报,2001,28(1):12-16.
Yang X F,Yang H W,Jian H,et al.Effect of fermentation conditions on antibiotic production ofXenorhabdusnematophila[J].Microbiology,2001,28 (1):12-16.(in Chinese)
[22]Wang Y H,Fang X L,Cheng Y P,et al.Manipulation of pH shift to enhance the growth and antibiotic activity ofXenorhabdusnematophila[J].Journal of Biomedicine and Biotechnology,2011(1):672369.1-672369.9.
[23]王永宏,张兴.2株昆虫病原线虫共生菌的分离与初步分类鉴定 [J].西北农林科技大学学报(自然科学版),2006,34(12):174-180.
Wang Y H,Zhang X.Isolate and identify 2 entomopathogenic nematodes symbiotic bacteria strains [J].Journal of Northwest A&F University(Nat Sci Ed),2006,34(12):174-180.(in Chinese)
[24]许贤,王永宏,刘霞,等.昆虫病原线虫共生菌筛选及其发酵液抑菌活性初步研究 [J].西北农林科技大学学报(自然科学版),2006,34(7):50-54.
Xu X,Wang Y H,Liu X,et al.Entomopathogenic nematodes symbiotic bacteria screening and preliminary study of the fermented liquid antibacterial activity [J].Journal of Northwest A&F University(Nat Sci Ed),2006,34(7):50-54.(in Chinese)
[25]刘霞.昆虫病原线虫共生菌YL001菌株的代谢物及其抑菌活性研究 [D].陕西杨凌:西北农林科技大学,2006.
Liu X.Studies on the metabiolite and antifungal activity ofXenorhabdusnematophilaYL001 from entomopathogenic nematodes [D].Yangling,Shaanxi:Northwest A&F University,2006.(in Chinese)
[26]Ji D,Yi Y,Kang G H,et al.Identification of an antibacterial compound,benzylideneacetone,fromXenorhabdusnematophilaagainst major pant-pathogenic bacteria [J].FEMS Microbiology Letters,2004,239(2):241-248.
[27]Brady S F,Clardy J.Cloning and heterologous expression of isocyanide biosynthetic genes from environmental DNA [J].Angewandte Chemie-International Edition,2005,117(43):7225-7227.
[28]李骞.昆虫病原线虫共生菌YL001菌株发酵液中抑菌活性物质初步研究 [D].陕西杨凌:西北农林科技大学,2006.
Li Q.Preliminary study on activity substances with antibacterial and antifungal effect in fermentation broth [D].Yangling,Shaanxi:Northwest A&F University,2006.(in Chinese)
[29]Ng K K,Webster J M.Antimycotic ofXenorhabdusbovienii(Enterobacteriaceae) metabolites againstPhytophthorainfestanson potato [J].Canadian Journal of Plant Pathology,1997,19(2):123-132.
[30]Dorel C,Lejeune P,Rodrigue A.The Cpx system ofEscherichiacoli,a strategic signaling pathway for confronting adverse conditions and for settling biofilm communities [J].Research in Microbiology,2006,157(4):306-314.
[31]郭树奇.pH调控嗜线虫致病杆菌抑菌活性机理的初步研究 [D].陕西杨凌:西北农林科技大学,2015.
Guo S Q.Study on antibacterial mechanism ofXenorhabdusnematophilaregulated by pH [D].Yangling,Shaanxi:Northwest A&F University,2015.(in Chinese)
[32]汤倩.嗜线虫致病杆菌YL001cpxR基因敲除对其抑菌活性及生长代谢的影响 [D].陕西杨凌:西北农林科技大学,2015.
Tang Q.Affect of antibacterial activity and metabolism ofcpxRgene knockout strain ofXenorhabdusnematophilaYL001 [D].Yangling,Shaanxi:Northwest A&F University,2015.(in Chinese)
Effect of initial pH on antimicrobial activity and metabolism ofXenorhabdusneamatophilastrain YL001
GUO Shu-qi1,XU Peng1,LU Mei1,WANG Ze-yu2,WANG Yong-hong1,ZHANG Xing1
(1ResearchandDevelopmentCenterofBiorationalPesticides,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2High-TechSchool,Yangling,Shaanxi712100,China)
Abstract:【Objective】 This study aimed to provide theoretical basis for improving bacteriostatic activity of Xenorhabdus neamatophila YL001 strain through investigating the effect of initial pH on its antimicrobial activity.【Method】 Antifungal activities of fermented liquid and ethylacetate extract of X.nematophila YL001 under different initial pH values of 4.5,5.5,6.5,7.0,7.5 and 8.5 were measured using growth rate method,agar diffusion method,and biopsy method.The differences in metabolism of ethylacetate extract of X.neamatophila YL001 were also analyzed using HPLC and LC-MS.【Result】 Antimicrobial activities of fermented liquid and its ethylacetate extract were improved with the increase of initial pH.Fermented liquid of YL001 exhibited highest inhibitory effect on mycelia growth of Magnaporthe grisea,Phytophthora capsici,Botrytis cinerea,Physalospora piricola,Alternaria solani,Alternaria brassicae,and Bacillus subtilis at pH of 8.5.Ethylacetate extract of fermented liquid exhibited high inhibitory activity against Botrytis cinerea with EC50of 1.29 mg/mL and against Bacillus subtilis with antibacterial zone diameter of 14.65 mm.The therapeutic and protective effects of YL001 on B.cinerea were also improved with the increase of initial pH.The protective efficacy was higher than therapeutic efficacy.HPLC and LC-MS revealed that the production of metabolites was regulated by culture conditions.The metabolites of organic extracts from X.neamatophila YL001 had significant difference at pH values of 8.5,7.0 and 4.5.【Conclusion】 The initial pH significantly affected the antimicrobial activity and metabolism of X.neamatophila YL001,and alkaline condition was conductive to produce active substance.
Key words:Xenorhabdus neamatophila;initial pH;extracellular metabolites;antimicrobial activity
DOI:网络出版时间:2016-05-0314:0510.13207/j.cnki.jnwafu.2016.06.019
[收稿日期]2014-10-11
[基金项目]国家自然科学基金项目(31171910);陕西省自然科学基金重点项目(2014JZ004);中央高校基本科研创新重点项目(Z109021304)
[作者简介]郭树奇(1989-),男,陕西武功人,在读硕士,主要从事农药毒理学和微生物代谢研究。E-mail:guoshuqi1989@126.com [通信作者]王永宏(1968-),男,陕西凤翔人,研究员,博士,博士生导师,主要从事微生物制药及发酵技术研究。 E-mail:yhwang@nwsuaf.edu.cn
[中图分类号]S482.2+92
[文献标志码]A
[文章编号]1671-9387(2016)06-0132-09
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160503.1405.038.html
