嗜线虫致病杆菌YL001 cpxR基因敲除突变株的构建及其抑菌活性研究
2016-07-02张淑静郭蔷薇王永宏
汤 倩,张淑静,郭蔷薇,王永宏,张 兴
(西北农林科技大学 无公害农药研究服务中心/陕西省生物农药工程技术研究中心,陕西 杨凌712100)
嗜线虫致病杆菌YL001cpxR基因敲除突变株的构建及其抑菌活性研究
汤倩,张淑静,郭蔷薇,王永宏,张兴
(西北农林科技大学 无公害农药研究服务中心/陕西省生物农药工程技术研究中心,陕西 杨凌712100)
[摘要]【目的】 通过同源重组技术敲除嗜线虫致病杆菌(Xenorhabdus nematophila) YL001中cpxR基因,为进一步研究CpxR调节子调控抗菌物质产生的机理奠定基础。【方法】 通过融合PCR技术,将cpxR基因的上、下游同源片段及质粒pJCV53上的卡那抗性基因Kmr 3个片段连接,克隆到自杀载体pDM4中,将重组质粒转化到大肠杆菌S17-1λpir中,经接合转移导入嗜线虫致病杆菌内,通过同源重组敲除cpxR基因;采用琼脂扩散法和抑制菌丝生长速率法分别测定突变菌株对枯草芽孢杆菌和番茄灰霉病菌的抑制作用。【结果】 从X.nematophila YL001基因组中成功敲除cpxR基因,得到了ΔcpxR突变菌株;ΔcpxR突变菌株对枯草芽孢杆菌和番茄灰霉病菌的抑制作用较野生菌株分别提高了1.4和1.7倍。【结论】 CpxR负向调控嗜线虫致病杆菌YL001抗菌物质的产生。
[关键词]嗜线虫致病杆菌YL001;cpxR基因;基因敲除;抗菌活性
嗜线虫致病杆菌存在于昆虫病原线虫肠道内,与斯氏线虫(Steinernema)共生,属肠杆菌科革兰氏阴性细菌[1],其在代谢过程中会产生多种具有生物活性的抗生素类物质,如细菌素、几丁质酶、假肽类、二硫吡咯类等[2]。这些代谢产物不仅具有多种化学结构,而且在医药和农业上具有广泛的生物活性,如抗细菌、抗真菌、杀虫、杀线虫、抗溃疡、抗肿瘤和抗病毒活性等。这些化合物结构新颖,生物活性高,具备开发新型农药的潜质。
XenorhabdusnematophilaYL001是从陕西杨凌筛选昆虫病原线虫中分离鉴定的1株共生菌,前期研究发现, YL001 的发酵产物具有较强的抑菌活性,对番茄灰霉病菌(Botrytiscinerea)、辣椒疫霉病菌(Phytophthoracapsici)、油菜菌核病菌(Sclerotiniasclerotiorum)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、蜡状芽孢杆菌(Bacilluscereus)等病原真菌和细菌均具有不同程度的拮抗作用[3],具有较大的开发潜力。
近年来,随着分子生物学技术的发展,细菌、线虫和昆虫之间相互作用的分子基础得到了广泛而深入的研究。在X.nematophila中,3个主要调控子Lrp (Leucine responsive regulatory protein)、LrhA (LysR-type regulator)和CpxR(Two-component system CpxRA中一种反应调节子) 单独或协同形成级联调控网络,进而调控X.nematophila生活史的3个阶段(侵染、繁殖及转移)中细菌、线虫和昆虫之间相互作用所需基因的表达[4]。其中, Lrp作为一种主要的调控子,位于复杂调控网络的顶端,负向调控nilABC基因的表达,调控共生菌与线虫的共生关系,通过激活 Lrh 调控共生菌对寄主昆虫的致病性[5],同时Lrp对共生菌的细胞功能(营养与能量代谢、转运与分泌及信号转导)也有广泛影响[6]。LrhA 可激活共生菌与毒性相关基因的转录与表达,包括鞭毛的合成,毒素、溶血素、蛋白酶和酯酶的产生,还可以正向调控鞭毛主调控子 FlhDC 的表达[7-8]。CpxRA 正向调控lrhA、运动性相关基因、酯酶和相关定植因子基因的表达,负向调控溶血素、蛋白酶、 抗生素和菌毛蛋白的产生,从而影响共生菌的致病性和共生性[9-11]。虽然CpxRA调控某一基因的功能已经明确,但其具体调控抗生素产生的机理还不清楚,抗菌活性的提高是基因沉默后重新表达而产生新的抗生素还是原有抗生素含量有所提高,尚有待进一步研究。因此,本研究拟构建嗜线虫致病杆菌cpxR基因缺失突变菌株,以期进一步研究cpxR基因失活提高X.nematophila杀菌活性的机理,并为嗜线虫致病杆菌其他基因的敲除提供可行性依据。
1材料与方法
1.1材料
1.1.1菌株与质粒供试菌株嗜线虫致病杆菌(Xenorhabdusnematophila) YL001(氨苄抗性)、大肠杆菌(Escherichilacoli) DH5α、大肠杆菌(Escherichilacoli) S17-1λpir、枯草芽孢杆菌(Bacillussubtilis)、番茄灰霉病菌(Botrytiscinerea),以及质粒pJCV53、自杀质粒pDM4(氯霉素抗性),均由本实验室保存。本研究中如无特殊说明,抗生素使用质量浓度为:氨苄青霉素(Amp)150 μg/mL,氯霉素(Cm) 25 μg/mL,卡那霉素(Km) 50 μg/mL。
1.1.2培养基NBTA鉴别培养基:牛肉膏3 g,蛋白胨5 g,琼脂粉14 g,氯化三苯基四氮唑0.04 g,溴麝香百里酚蓝0.025 g,蒸馏水1 000 mL,pH 7.2~7.4。
NB 培养基:牛肉膏3 g,蛋白胨5 g,蒸馏水 1 000 mL,pH 7.2~7.4。
NA 培养基:牛肉膏3 g,蛋白胨5 g,琼脂粉15 g,蒸馏水1 000 mL,pH 7.2~7.4。
PDA 培养基:马铃薯 200 g,葡萄糖 20 g,琼脂粉 15 g,蒸馏水1 000 mL。
LB液体培养基:酵母提取物5 g,蛋白胨10 g,氯化钠10 g,蒸馏水1 000 mL,pH 7.2~7.4。
LB固体培养基:在液体培养基基础上添加15 g琼脂。
1.1.3主要试剂试验所用dNTPs、DNA分子量标准、ExTaq、PrimeSTAR高保真酶,购自TaKaRa公司;质粒提取试剂盒、基因组提取试剂盒、PCR产物(胶)回收试剂盒,购自天根公司;限制性内切酶、T4 DNA连接酶,购自NEB公司。其他生化试剂(分析纯)均为国产分析级。
1.1.4引物设计与合成本研究所用到的引物均由Primer Premier 5软件设计(表1)。由上海生物工程有限公司合成。
1.2cpxR突变菌株的构建、筛选及验证
1.2.1基因敲除质粒的构建以嗜线虫致病杆菌YL001基因组DNA 为模板,分别用上、下游引物cpxR-up-F/cpxR-up-R、cpxR-down-F/cpxR-down-R进行 PCR,扩增cpxR的上、下游片段U和D;同时以质粒pJCV53为模板,用引物Km-F/Km-R进行PCR,扩增卡那抗性基因。各片段扩增的反应条件如表2所示。扩增完毕使用PCR产物(胶)回收试剂盒回收纯化PCR产物。

表 1 cpxR基因突变株构建及鉴定所用的引物
注:黑体标记的碱基为保护碱基,横线标记的碱基为酶切位点。
Note:Black letters: protective base;Horizontal line marked letters represent restriction enzyme cutting sites.
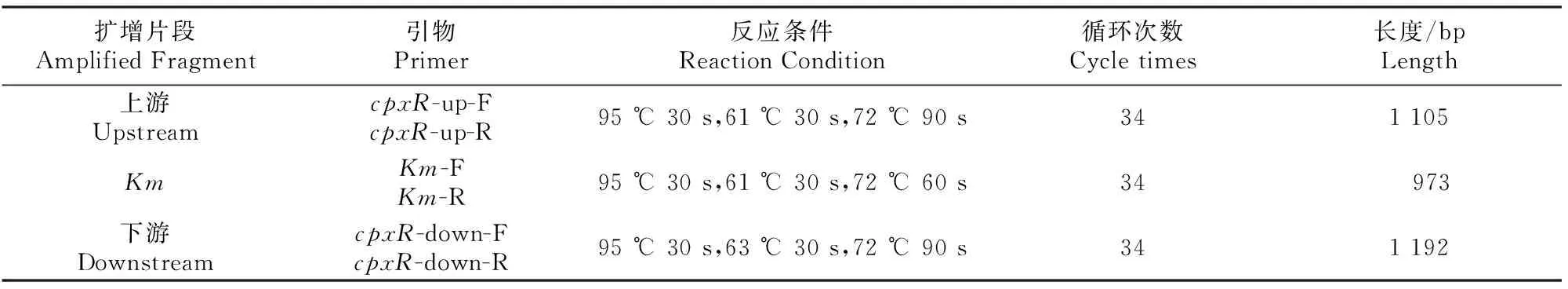
表 2 目的片段扩增的反应条件及产物长度
1.2.2融合PCR反应将纯化后的cpxR基因上、下游同源片段及卡那抗性基因3个片段按 1∶1∶1混合,不添加引物,用PrimeSTAR高保真酶进行互补融合,形成全长的融合PCR产物。PCR程序为:95 ℃ 3 min;95 ℃ 30 s,63 ℃ 30 s,72 ℃ 3 min,10个循环;72 ℃ 5 min。反应结束后,以上述产物为模板进行融合片段的全长扩增,引物对为cpxR-up-F/cpxR-down-R。PCR扩增程序为:95 ℃ 3 min;95 ℃ 30 s,63 ℃ 30 s,72 ℃ 3 min,34个循环;72 ℃ 5 min。最终切胶回收纯化PCR产物并将该片段克隆至T载体,进行菌落PCR鉴定,选取正确的阳性克隆测序。
分别以限制性内切酶SphⅠ和SacⅠ对pDM4质粒和融合片段进行双酶切,并用试剂盒纯化回收,将酶切后的质粒和片段按适当的比例混合,加入T4连接酶于16 ℃过夜连接,再将连接产物用热激法转化到大肠杆菌S17-1λpir感受态细胞中,转化产物在37 ℃、200 r/min条件下活化1 h后,取100 μL涂布于LB平板(含25 μg/mL氯霉素、50 μg/mL卡那霉素)上,37 ℃倒置培养至长出单菌落。通过PCR鉴定和测序分析,筛选出含有融合片段且测序正确无误的重组质粒pDM4cpxR-up-Km-cpxR-down,鉴定引物为cpxR-up-F/cpxR-down-R。
1.2.3接合转移及突变菌株的鉴定将含有重组质粒的大肠杆菌 S17-1λpir以1%接种量转接入新鲜的LB培养基(含Km 50 μg/mL,Cm 25 μg/mL)中,37 ℃振荡培养至A600为0.4~0.6。同时将受体菌嗜线虫致病杆菌YL001于28 ℃过夜活化后以1%接种量转接入LB液体培养基,28 ℃培养至A600为0.4~0.6。将大肠杆菌和嗜线虫致病杆菌等体积混合,室温、4 000 r/min离心3 min收集菌体,再用100~200 μL不加抗生素的LB液体悬浮。将所有菌悬液铺在一张孔径为0.45 μm的硝酸纤维素膜上,待菌液被充分吸收后将其紧贴在LB平板上,28 ℃倒置培养8 h左右,进行结合转移的第一轮重组。然后用LB液体培养基洗涤滤膜,洗下的菌悬液涂布于LB平板(含Amp 150 μg/mL,Km 50 μg/mL)上,28 ℃培养2~3 d,进行第一轮重组接合子的筛选。计算接合转移频率:接合转移频率=接合子数/供体菌数。
在供体菌大肠杆菌与受体菌嗜线虫致病杆菌的比例为2∶1的条件下,将接合时间设为2,4,6,8,10,12,14 h共7个处理,研究接合时间对转移频率的影响。
挑取第一轮重组接合成功的接合子,接种于LB液体培养基中,28 ℃、180 r/min培养至对数中期,将菌液稀释1 000倍后取100 μL涂布于含5%蔗糖、50 μg/mL Km的LB平板上,28 ℃培养至出现单菌落,该单菌落即为第二轮重组成功的克隆(即卡那霉素抗性基因Kmr成功置换cpxR基因),该克隆即为cpxR基因敲除的突变株ΔcpxR。通过cpxR基因内部引物对NB-F/NB-R以及外部引物对WB-F/WB-R对该菌落进行PCR鉴定。
1.3突变菌株发酵液的抑菌活性测定
1.3.1对病原真菌菌丝生长的抑制活性采用生长速率法[12-13]测定突变株发酵液对番茄灰霉病菌菌丝生长的抑制作用。将发酵液以10%的比例接入冷却至40~50 ℃的PDA培养基中,制成平板,以加无菌发酵培养基的PDA为对照。从培养5 d的供试病原菌菌落边缘,用打孔器取直径4 mm的菌块,置于平板中央,于 25 ℃黑暗条件下培养,5 d后测量菌落的直径,计算抑制率。计算公式为:
菌落生长直径(mm)=测量直径-4.0(菌饼直径);
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.3.2对病原细菌的抑制活性采用琼脂扩散法[14-15]测定突变株发酵液对供试枯草芽孢杆菌的抑菌活性。将熔化的NA培养基冷却至40~50 ℃,加入体积分数1.5%的供试病原细菌摇匀,每皿(直径90 mm)倒入15 mL培养基,制成平板,在带菌平板上打3个直径7.5 mm 的孔,每孔加入70 μL发酵液,以发酵培养基为对照,28 ℃培养48 h,十字交叉法测量抑菌圈大小。
2结果与分析
2.1cpxR基因敲除载体的构建
用引物对cpxR-up-F/cpxR-up-R扩增cpxR基因上游同源片段(1 105 bp)、Km-F/Km-R扩增卡那抗性基因(973 bp)、cpxR-down-F/cpxR-down-R扩增cpxR基因下游同源片段(1 192 bp),扩增后回收纯化PCR产物。将回收纯化后的3个片段按 1∶1∶1混合,首先不添加引物,用PrimeSTAR高保真酶进行互补融合,形成融合PCR产物。之后利用引物对cpxR-up-F/cpxR-down-R,以上述所得产物为模板,进行融合片段的全长扩增,成功融合的片段大小为3 270 bp。PCR产物的1%琼脂糖电泳结果如图1所示。

图 1 目的片段及其融合片段的PCR扩增
对融合片段与pDM4质粒进行双酶切、连接,然后转化至大肠杆菌S17-1λpir中,待长出单菌落后,摇菌提取质粒,以质粒为模板,用引物对cpxR-up-F/cpxR-down-R来鉴定阳性克隆,可以扩增出融合片段,其验证结果如图2所示,说明已成功构建cpxR基因敲除重组载体pDM4cpxR-up-Km-cpxR-down。
2.2接合转移及突变株鉴定
由于嗜线虫致病杆菌对卡那霉素敏感,同时含有同源重组载体的大肠杆菌S17-1λpir对氨苄霉素敏感,因此在氨苄霉素和卡那霉素双重筛选压力下生长起来的菌落可以初步判断为一次重组克隆。
在含有5%蔗糖的LB平板上挑取少量单克隆菌落作为模板,用位于cpxR基因编码区的内部引物对NB-F/NB-R及外部引物对WB-F/WB-R进行PCR鉴定,并以嗜线虫致病杆菌YL001野生株基因组DNA为对照,结果(图3)显示,与阳性对照相比,以突变株基因组DNA为模板,采用cpxR内部引物进行PCR扩增时,并无扩增片段出现,而采用外部引物进行PCR扩增时,其扩增产物比以野生株基因组DNA为模板时的扩增产物大约300 bp,说明卡那抗性基因Kmr已成功替换了目标基因cpxR,该克隆即为cpxR基因敲除后的突变株ΔcpxR。
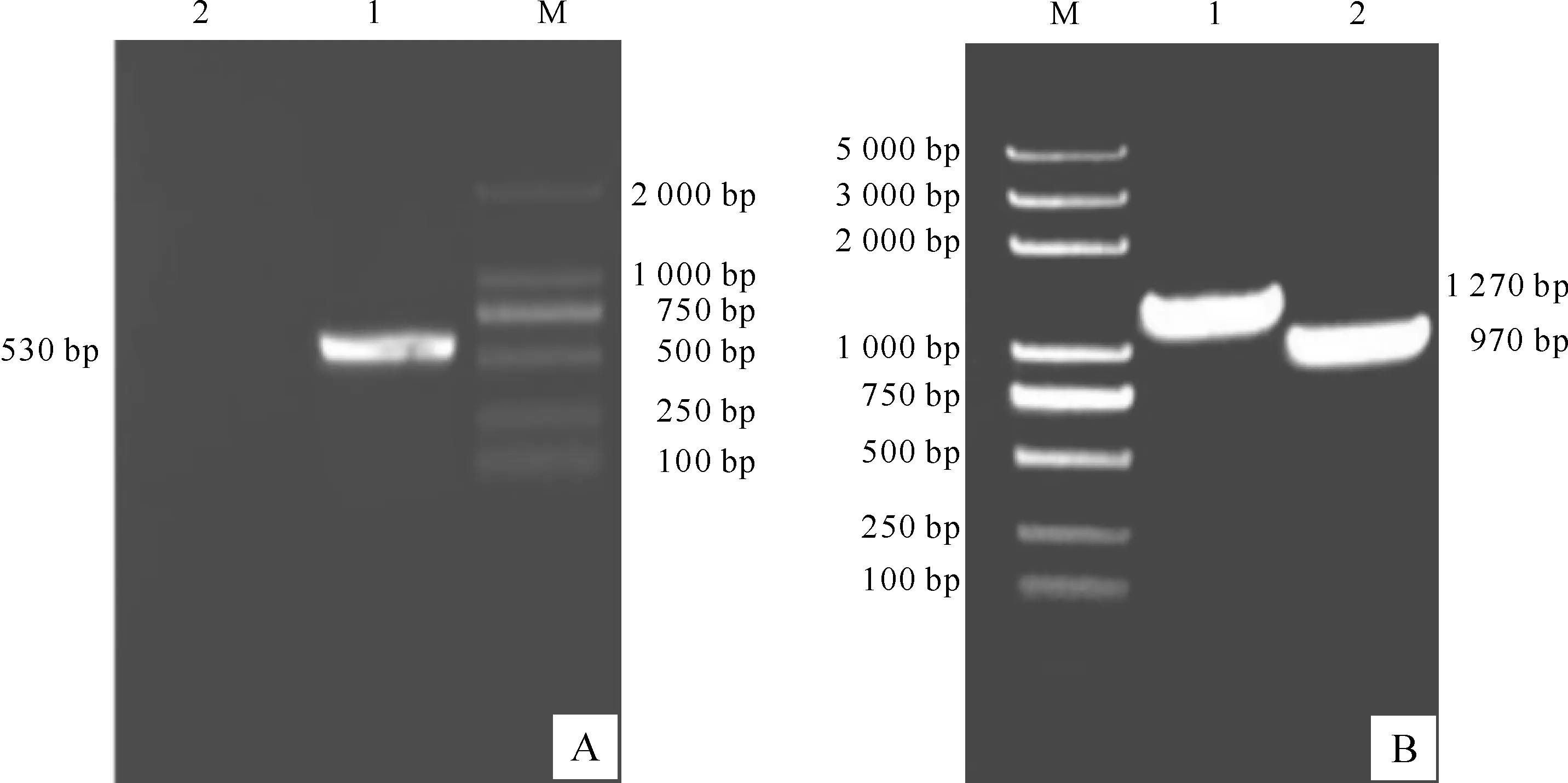
图 3cpxR基因敲除突变株的鉴定
A.cpxR基因内部引物扩增结果;B.cpxR基因外部引物扩增结果;M.DL2000 Marker;1.野生菌株YL001;2.突变菌株ΔcpxR
Fig.3Identification ofXenorhabdusnematophilaYL001 ΔcpxR
A.PCR with internal primers;B.PCR with external primers;M.DL2000 Marker;1.Wild type strain YL001;2.Mutant strain
当供体菌(含有同源重组载体的大肠杆菌S17-1λpir)和受体菌(X.nematophilaYL001)接合时间为12 h时,接合转移频率最大,为1×10-5(图4)。出现这种现象的原因可能是接合时间过长时,供体菌的生长速度远高于受体菌,以至受体菌数目远小于供体菌,从而降低了接合转移的频率;而接合时间过短时,因重组质粒可能未完全进入受体细菌而导致接合频率不高。
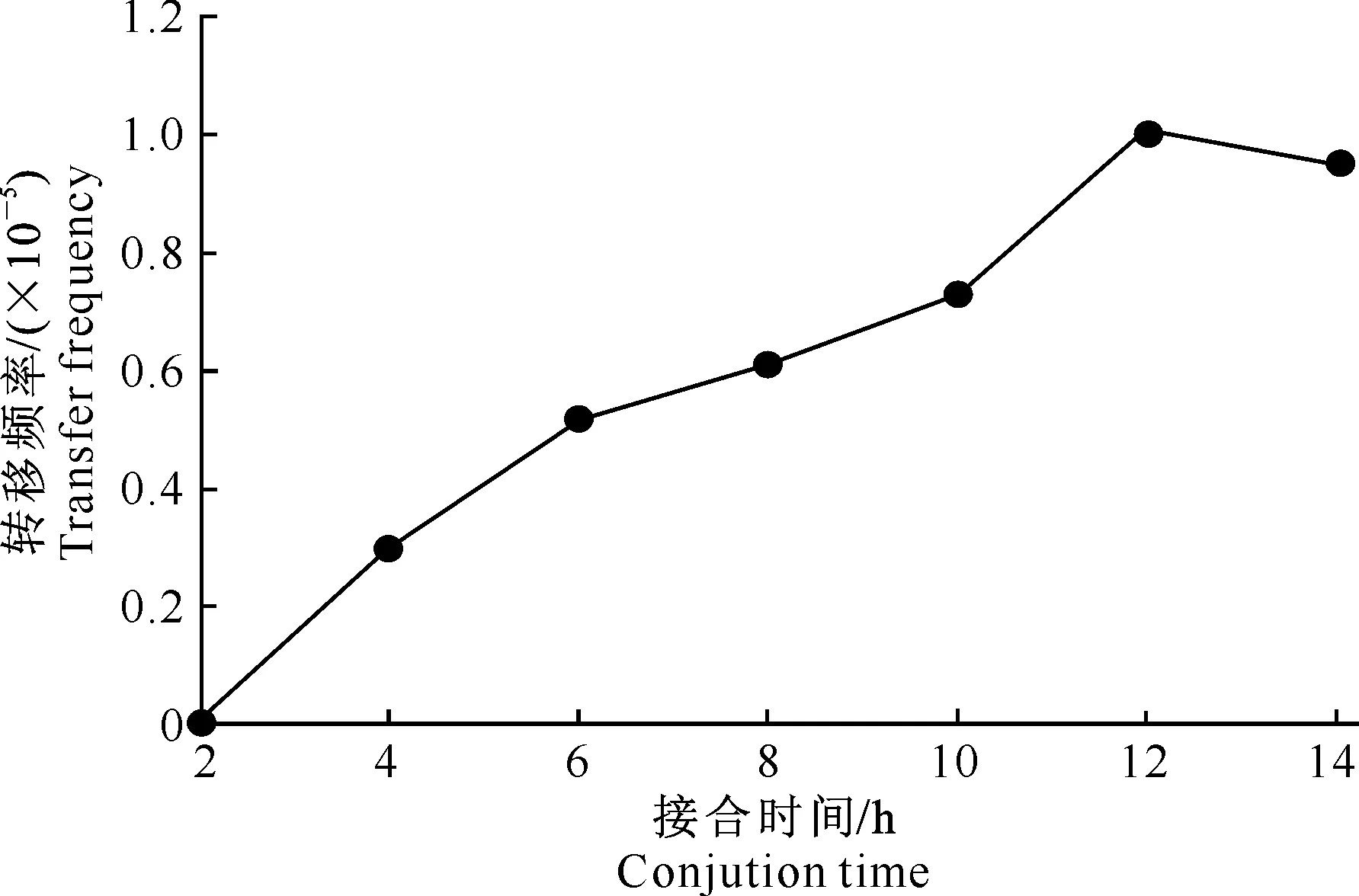
图 4接合时间对转移频率的影响
Fig.4Effect of conjunction time on transfer frequency
2.3ΔcpxR及野生菌株YL001对番茄灰霉病菌菌丝生长的抑制作用
图5表明,野生菌株YL001发酵液对番茄灰霉病菌菌丝的抑制率为50.02%,突变菌株发酵液对番茄灰霉病菌的抑制率为88.26%,是野生菌株的1.7倍。
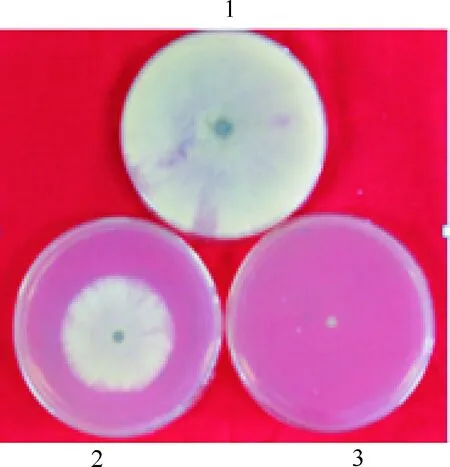
图 5野生菌株YL001和ΔcpxR突变菌株发酵液
对番茄灰霉病菌的抑制作用
1.空白对照;2.野生菌株YL001;3.ΔcpxR突变菌株
Fig.5Inhibitory effect of wild strain YL001 and
ΔcpxRagasintBotrytiscinerea
1.CK;2.Wild type strain YL001;3.Mutant strain ΔcpxR
2.4ΔcpxR及野生菌株YL001对枯草芽孢杆菌的抑制作用
图6显示,野生菌株YL001发酵液对枯草芽孢杆菌的抑菌圈直径为23.17 mm,突变菌株发酵液对枯草芽孢杆菌的抑菌圈直径为30.89 mm,是野生菌株的1.4倍。
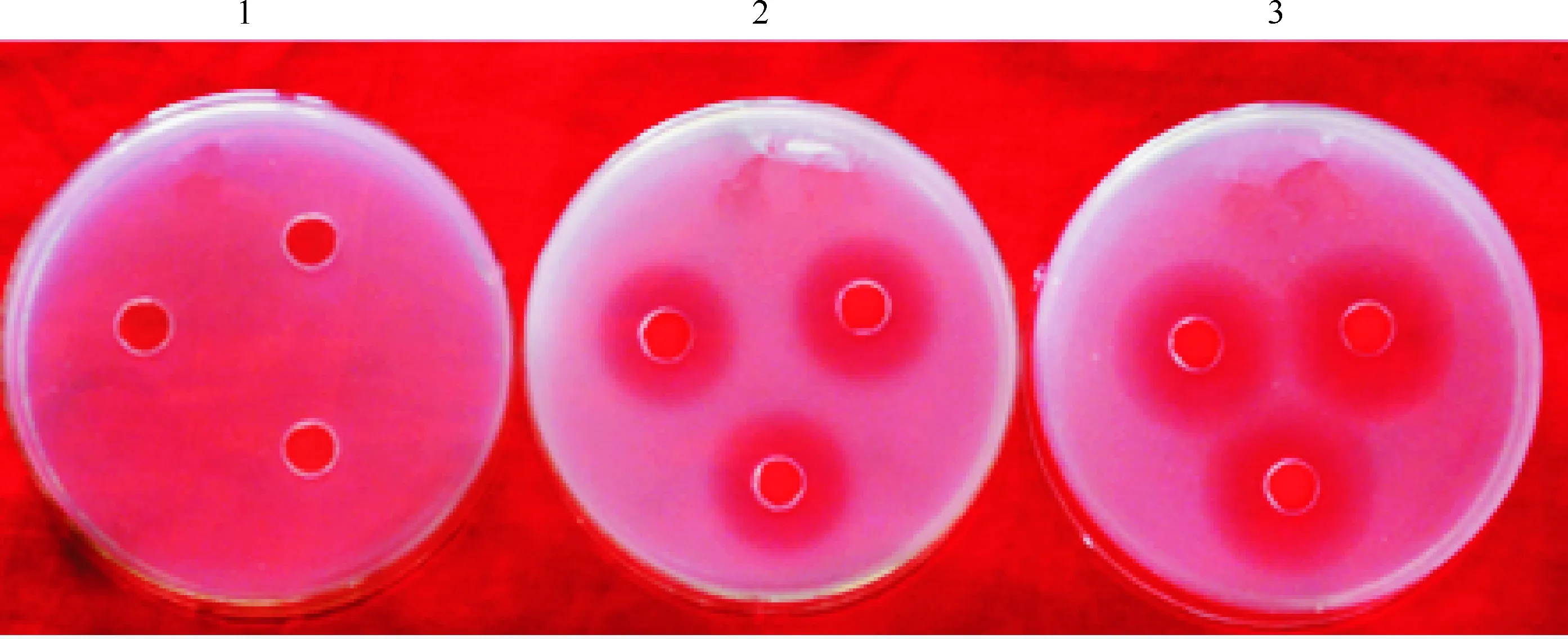
图 6 野生菌株YL001和ΔcpxR突变菌株发酵液对枯草芽孢杆菌的抑制作用
3讨论
嗜线虫致病杆菌是一种新型的生物防治资源,构建无痕突变株对其产生抗生素相关基因的研究至关重要。本研究利用含反向筛选基因sacB的pDM4质粒,通过同源重组技术构建了cpxR基因缺失株。sacB基因编码的果聚糖蔗糖酶能催化蔗糖水解成果聚糖,果聚糖对革兰氏阴性菌都有致死作用,故含有sacB基因的细菌不能在蔗糖平板上生长[16]。整合了pDM4质粒的嗜线虫致病杆菌中,只有发生2次重组的突变株才能在含有蔗糖的培养基中生长。
构建重组DNA片段的传统方法包括利用合适的限制性内切酶连接重组和通过加连接子连接重组等,如Herbert等[11]利用酶切连接的方法将X.nematophilacpxR基因上游、链霉素抗性基因和cpxR基因下游3个片段连接在一起,克隆至自杀载体pKR100,构成pKRcpxRStr重组质粒。但上述2种方法不但费时费力,而且对于长片段的连接有时难以找到合适的酶切位点。而使用融合PCR,将3个DNA片段放在同一个反应中进行聚合酶链式反应进行扩增,不需要限制性内切酶消化和连接酶处理,为同源重组DNA片段的构建提供了快速简捷的途径[17-18]。本研究利用该方法,成功构建重组自杀载体pDM4-up-Km-down,并对该片段进行测序,测序结果与融合前基因片段序列完全一致,确保后续其与可以致病杆菌染色体基因组发生同源重组。
由于在自然条件下还未鉴定出可独立生活的X.nematophila,因此这些细菌在一般条件下比较脆弱,只有在温和条件下才能较好生长[19]。嗜线虫致病杆菌的脆弱性使其很难用电穿孔法进行载体DNA的转化,人们尝试了很多条件下的电击穿孔法但均未成功,将质粒转入致病杆菌细胞的最可靠方法是用大肠杆菌进行接合转移[20]。本研究利用接合转移成功构建了cpxR基因缺失株,为致病杆菌其他基因的敲除提供了依据。
在实验室条件下进行微生物培养时,许多代谢物的生物合成基因保持沉默,使得一些有价值的化合物不能产生,而这些隐藏的生物合成途径受到严格的控制,其仅在特殊条件下可被激活[21]。昆虫病原线虫共生菌基因组分析表明,发光杆菌的基因组中含有33个与次生代谢物合成有关的基因簇,嗜线虫致病杆菌中含有16个与次生代谢产物合成有关的基因簇[22]。目前从发光杆菌和嗜线虫致病杆菌中分离鉴定的次生代谢产物的数量远少于其生物合成基因簇的数量,这种差异可能源于代谢调节控制。在细菌中总调控子通过级联调节系统调控基因的转录,其可控制小分子物质的产生[23]。Kontnik等[24]研究了发光杆菌次生代谢物产生的下游调控,发现HexA(LysR类型的转录调节子)基因失活突变可显著提高一些小分子物质的含量,且突变菌株可产生一些新的代谢产物。CpxR是CpxRA双组份信号转导系统中的调节蛋白,也是一种转录调节子。在大肠杆菌中,CpxR可调控100多个基因的转录与表达[25];在嗜线虫致病杆菌中,CpxR正向调控细胞的运动性、酯酶活性及该菌与线虫共生所需相关基因的转录,负向调控溶血素与蛋白酶的产生及抗菌活性[11]。因此,本研究构建的cpxR基因缺失突变株为后续进一步明确cpxR基因失活对提高嗜线虫致病杆菌杀菌活性的机理奠定了基础。
[参考文献]
[1]Thomas G M,Poinar G O.Xenorhabdusgen.nov,a genus of entomopathogenic nematophilia bacteria of the family Enterobacteriaceae [J].International Journal of Systematic Bacteriology,1979,29:352-360.
[2]魏明敏,邱德文,曾红梅,等.嗜线虫致病杆菌Xna基因同源重组载体的构建及遗传转化体系的建立 [J].生物技术通报,2009(4):91-95.
Wei M M,Qiu D W,Zeng H M,et al.Construction of homologous recombinant vector ofXnagene and establishment of genetic transformation system ofXenorhabdusnematophila[J].Biotechnology Bulletin,2009(4):91-95.(in Chinese)
[3]方香玲.昆虫病原线虫共生菌的鉴定、培养及其抑菌活性研究 [D].陕西杨凌:西北农林科技大学,2008.
Fang X L.Study on identification,culture and antimicrobial activity of entomopathogenic bacteria [D].Yangling,Shannxi:Northwest A&F University,2008.(in Chinese)
[4]Richards G R,Goodrich-Blair H.Masters of conquest and pillage:Xenorhabdusnematophilaglobal regulators control transitions from virulence to nutrient acquisition [J].Cellular Microbiology,2009,11(7):1025-1033.
[5]Cowles C E,Richards G R,Martens E C,et al.The global regulator Lrp contributes to mutualism,pathogenesis and phenotypic variation in the bacteriumXenorhabdusnematophila[J].Cellular Microbiology,2007,9(5):1311-1323.
[6]Lu X J.Examining pathogenic and mutualistic regulatory netw-orks in the bacteriumXenorhabdusnematophila[D].Madison,USA:University of Wisconsin-Madison,2012.
[7]Park D,Forst S.Co-regulation of motility,exoenzyme and ant-ibiotic production by the EnvZ-OmpR FlhDC-FliA pathway inXenorhabdusnematophila[J].Molecular Microbiology,2006,61(6):1397-1412.
[8]Richards G R,Herbert E E,Park Y J,et al.Xenorhabdusnem-atophilalrhA is necessary for motility,lipase activity,toxin expression,and virulence inManducasextainsects [J].Journal of Bacteriology,2008,190(14):4870-4879.
[9]Herbert E E,Goodrich-Blair H.CpxRA contributes toXenorh-abdusnematophilavirulence through regulation of lrhA and modulation of insect immunity [J].Applied and Environmental Microbiology,2009,75(12):3998-4006.
[10]Herbert E E,Andersen A W,Goodrich-Blair H.CpxRA influencesXenorhabdusnematophilacolonization initiation and outgrowth inSteinernemacarpocapsaenematodes through regulation of thenillocus [J].Applied and Environmental Microbiology,2009,75(12):4007-4014.
[11]Herbert E E,Cowles K N,Goodrich-Blair H.CpxRA regulates mutualism and pathogenesis inXenorhabdusnematophila[J].Applied and Environmental Microbiology,2007,73(24):7826-7836.
[12]许贤,王永宏,刘霞,等.昆虫病原线虫共生菌筛选及其发酵液抑菌活性初步研究 [J].西北农林科技大学学报(自然科学版),2006,34(7):50-54.
Xu X,Wang Y H,Liu X,el al.Screening of symbiotic bacteria of entomopathogenic nematode and the antimicrobial activity of its fermentation liquid [J].Journal of Northwest A&F University(Nat Sci Ed),2006,34(7):50-54.(in Chinese)
[13]刘霞.昆虫病原线虫共生菌 YL001菌株的代谢物及其抑菌活性研究 [D].陕西杨凌:西北农林科技大学,2006.(in Chinese)
Liu X.Studies on the metabolite and antifungal activity ofXenorhabdusnematophilusYL001 from entomopathogenic nematodes [D].Yangling,Shaanxi:Northwest A&F University,2006.(in Chinese)
[14]Dongjin D,Yi Y,Kang G H,et al.Identification of an antibacterial compound,benzylideneacetone fromXenorhabdusnematophilaagainst major plant-pathogenic bacteria [J].FEMS Microbiology Letters,2004,239(2):241-248.
[15]王永宏,张兴.2株昆虫病原线虫共生菌代谢物的抑菌作用 [J].西北农林科技大学学报(自然科学版),2007,35(2):125-130.
Wang Y H,Zhang X.Studies on antimicrobial activity of metabolites of symbiotic bacteria associated with entomopathogenic nematodes [J].Journal of Northwest A&F University (Nat Sci Ed),2007,35(2):125-130.(in Chinese)
[16]刘霞,高鹤,杨琳,等.副溶血性弧菌基因敲除方法的建立及应用 [J].中国实验动物学报,2011,19(3):188-192.
Liu X,Gao H,Yang L,el at.Establishment of a suicide vector-based gene knockout method in studies ofVibrioparahaemolyticus[J].Acta Laboratorium Animalis Scientia Sinica,2011,19(3):188-192.(in Chinese)
[17]王力华,付士红,唐青,等.三重融合PCR法构建感染性辛德毕斯嵌合病毒cDNA克隆 [J].病毒学报,2006,22(2):107-113.
Wang L H,Fu S H,Tang Q,el at.Construction of infectious chimeric cDNA clone of sindbis virus by triple fusion PCR [J].Journal of Virology,2006,22(2):107-113.(in Chinese)
[18]李敏,杨谦.一种高效构建同源重组DNA片段的方法:融合PCR [J].中国生物工程杂志,2007,27(8):53-58.
Li M,Yang Q.A Rapid method for generation of homologous recombinant fragments:fusion PCR [J].China Biotechnology,2007,27(8):53-58.(in Chinese)
[19]李宗泽.伯氏致病杆菌YL002的抗菌活性研究及其CpxRA基因的敲除 [D].陕西杨凌:西北农林科技大学,2011.
Li Z Z.Mutation ofCpxRAgene inXenorhabdusbovieniiYL002 and study on antimicrobial activity [D].Yangling,Shaanxi:Northwest A&F University,2011.(in Chinese)
[20]Xu J,Hurlbert R E.Toxicity of irradiated media forXenorhabdussp. [J].Applied and Environmental Microbiology,1990,56(3):815-818.
[21]Scherlach K,Hertweck C.Triggering cryptic natural product biosynthesis in microorganisms [J].Organic and Biomolecular Chemistry,2009,7(9):1753-1760.
[22]Duchaud E,Rusniok C,Frangeul L,et al.The genome sequen-ce of the entomopathogenic bacteriumPhotorhabdusluminescens[J].Nature Biotechnology,2003,21(11):1307-1313.
[23]Martinez A A,Collado V J.Identifying global regulators in transcriptional regulatory networks in bacteria [J].Current Opinion in Microbiology,2003,6(5):482-489.
[24]Kontnik R,Crawford J M,Clardy J.Exploiting a global regulator for small molecule discovery inPhotorhabdusluminescens[J].ACS Chemical Biology,2010,5(7):659-665.
[25]Wulf D P,McGuire A M,Liu X,et al.Genome-wide profiling of promoter recognition by the two-component response regulator CpxR-P inEscherichiacoli[J].The Journal of Biological Chemistry,2002,277(29):26652-26661.
Construction ofcpxRgene deletion mutant strain ofXenorhabdusnematophilaYL001 and study of its antimicrobial activity
TANG Qian,ZHANG Shu-jing,GUO Qiang-wei,WANG Yong-hong,ZHANG Xing
(Research&DevelopmentCenterofBiorationalPesticide,NorthwestA&FUniversity/ShaanxiResearchCenterofBiopesticideEngineering&Technology,Yangling,Shaanxi712100,China)
Abstract:【Objective】 The cpxR gene of nematode pathogenic bacteria Xenorhabdus nematophila YL001 was knocked out by allelic exchange to provide basis for researching regulatory mechanism of CpxR on production of antimicrobial substances.【Method】 In this study,the upstream and downstream flanking DNA fragments of target gene and the kanamycin resistant gene Kmr were fused by PCR before being cloned into the suicide vector pDM4.The recombinant plasmid was introduced into Escherichila coli strain S17-1λpir and transferred into X.nematophila by conjugation.Then,the inhibitory effect of the mutant strain against Bacillus subtilis and Botrytis cinerea was determined.【Result】 The ΔcpxR mutant strain was obtained successfully,and the antimicrobial activities of mutant strains against B.subtilis and B.cinerea were increased by 1.4 and 1.7 times compared with those of the wild strain.【Conclusion】 CpxR negatively regulates the production of antimicrobial substances of X.nematophila YL001.
Key words:Xenorhabdus nematophila YL001;cpxR;gene knockout;antimicrobial activity
DOI:网络出版时间:2016-05-0314:0510.13207/j.cnki.jnwafu.2016.06.018
[收稿日期]2014-11-21
[基金项目]国家自然科学基金项目(31171910);陕西省自然科学基金重点项目(2014JZ004);中央高校基本科研项目(ZD2013003)
[作者简介]汤倩(1990-),女,河南开封人,在读硕士,主要从事微生物源农药研究。E-mail:tangqian229@126.com [通信作者]王永宏(1968-),男,陕西凤翔人,研究员,博士生导师,主要从事生物源农药研究。 E-mail:yhwang@nwsuaf.edu.cn
[中图分类号]S482.2+92
[文献标志码]A
[文章编号]1671-9387(2016)06-0125-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160503.1405.036.html
