壳聚糖磷脂酰胆碱对痴呆大鼠学习能力和海马区白细胞介素-1β表达的影响
2016-06-29孟庆慧
郭 鹤 孟庆慧
(菏泽医学专科学校护理系基础护理学教研室,山东 菏泽 274000)
壳聚糖磷脂酰胆碱对痴呆大鼠学习能力和海马区白细胞介素-1β表达的影响
郭鹤孟庆慧
(菏泽医学专科学校护理系基础护理学教研室,山东菏泽274000)
〔摘要〕目的观察壳聚糖磷脂酰胆碱对治疗经海马内注射Aβ25~35的健康Wistar大鼠所诱导的阿尔茨海默病(AD)大鼠海马内白细胞介素(IL)-1β的表达数量以及该药物对AD大鼠学习记忆能力的干预疗效。方法对健康Wistar大鼠经两侧海马内注射Aβ25~35诱导建立AD大鼠炎性痴呆模型,Morris水迷宫以及免疫组织化学方法分别观察AD模型大鼠经药物治疗前后学习记忆能力以及海马内炎性表达因子IL-1β的表达状况。结果对照组和药物组大鼠的平均逃避潜伏期(AEL)比AD模型组显著缩短、2 min内跨越原平台次数和在靶象限时间比模型组明显延长(P<0.05)。模型组大鼠海马区IL-1β阳性量高于对照组(P<0.01),药物组IL-1β阳性表达较模型组显著下降(P<0.05)。 结论壳聚糖磷脂酰胆碱对改善AD大鼠学习记忆能力和注射Aβ25~35后诱导的炎性反应均有一定的治疗作用。
〔关键词〕壳聚糖磷脂酰胆碱;阿尔茨海默病;白细胞介素-1β;炎性反应
阿尔茨海默病(AD)病因较为复杂,特征性的病理学改变是发生神经原纤维缠结(NFT)、大量老年斑(SP)形成以及神经元的丢失〔1〕。然而,现今仍缺乏有效的防治药物以及有效的治疗手段。近些年来,有研究表明,大脑内部的炎症反应在AD的发生发展中起着非常重要的作用〔2,3〕。因此,抑制脑内炎性因子的产生成为当前防治AD药物研究的热点之一。Aβ25~35的凝聚状态具有毒性作用,它能引起神经元损伤、学习记忆能力损害。本研究采用大鼠左右两侧海马立体定位定向注射Aβ25~35的方法建立AD大鼠动物模型,研究壳聚糖磷脂酰胆碱对AD大鼠的抗感染治疗作用,为临床应用壳聚糖磷脂胆碱治疗AD提供一定的实验依据。
1材料与方法
1.1动物与分组购买山东鲁抗医药股份有限公司实验动物部的Wistar大鼠30只,SPF级,6~8月龄,体重(350±30)g,标准条件下饲养〔(20±2)℃,湿度50%~60%〕,随机分为对照组、模型组和药物组(n=10)。
1.2主要药品、试剂及仪器Aβ25~35(美国 Sigma公司);IL-1β抗体(美国Biowoild公司);免疫组化试剂盒(北京中杉金桥生物技术公司)。DMS-2Morris水迷宫系统(中国医学科学院药物研究所);江湾Ⅰ型C脑立体定向仪(第二军医大学);超薄组织切片机和DME型光学显微镜(德国Leica公司)。
1.3方法
1.3.1Aβ25~35孵育无菌条件下,用生理盐水将Aβ25~35稀释。37℃条件下连续孵育7 d,变为有毒性的凝聚态Aβ25~35。
1.3.2模型制备及处理方法参照大鼠脑立体定位图谱,将模型组和药物组大鼠用10%水合氯醛3.5 ml/kg麻醉后,固定头部于脑立体定位仪,按照常规先备皮消毒切开表层皮肤,暴露大鼠的前囟部位,再用牙科钻钻孔后将10 μl注入两侧海马内,每一侧各注入药物Aβ25~355 μl,前囟后(AP)=-3.5 mm,左右旁开(ML)=2.5 mm,进针深度(DV)=3.0 mm。对照组经以上同样操作注射5 μl 0.9%生理盐水。造模完成后,给予药物组150 mg·kg-1·d-1的壳聚糖磷脂酰胆碱灌胃,其他两组给予2 ml 0.9%生理盐水灌胃,实验时间为4 w。
1.3.3行为学观察本实验目的为检测大鼠的学习记忆能力情况。实验分为3个阶段,每一次实验时间为6 d(定位航行试验为期5 d,空间探索实验为期1 d)。前者实验目的是记录各组大鼠寻找平台用的时间,称为大鼠的逃避潜伏期。后者的实验目的是检测大鼠在2 min内跨原平台位置的次数以及在靶象限的停留时间。
1.3.4免疫组织化学法染色根据大鼠体重用10%水合氯醛3.5 ml/kg通过腹腔注射将其麻醉后固定,心脏取血2 ml后,先用200~300 ml的0.9%生理盐水灌注,再用300~400 ml的4℃冰4%多聚甲醛进行大鼠心脏灌注,待大鼠四肢变僵硬后,剪断头部剖开取脑,置于4%多聚甲醛中固定。固定后采用冠状面切取海马部位标本,缓慢流水冲洗过夜,经75%~85%~90%~100%梯度酒精脱水,二甲苯Ⅰ、二甲苯Ⅱ透明,浸蜡,包埋,切片(4 μm),免疫组化PV法染色检测,一抗IL-1β浓度1∶100。
1.4统计学方法采用SPSS16.0软件行单因素方差分析。
2结果
2.1水迷宫实验结果随着训练次数的增加,各组大鼠对平台位置产生了记忆,各组大鼠的平均逃避潜伏期(AEL)逐渐缩短。造模之前水迷宫实验结果显示,第1~2天各组大鼠寻找平台所用时间逐渐缩短,第3~5天各组趋于稳定,各组所用时间相比并没有显著差异(P>0.05),空间探索实验结果亦无明显统计学差异(P>0.05)。造模7 d后,定位航行实验结果显示,AD模型组和药物组大鼠AEL较造模前比明显延长,与对照组有显著差异(P<0.05)。空间探索实验结果显示模型组和药物组大鼠在单位时间内跨越原平台次数以及在靶象限停留时间明显减少(P<0.05)。药物治疗4 w后,药物组大鼠AEL时间较模型组明显减少(P<0.05),见表1、表2。
2.2免疫组织化学染色结果模型组大鼠海马区细胞排列紊乱,细胞数目和层数减少,胞核固缩,细胞核染色加深,炎性因子IL-1β大量表达(46.40±4.62),细胞染色深,棕黄色,胞质表达。对照组阳(10.70±2.91)性表达量明显少于模型组,药物干预治疗后药物组(28.70±3.56)IL-1β表达量较模型组明显减少(P<0.05),见图1。

表1 各组空间探索实验成绩
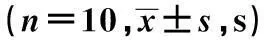
表2 各组水迷宫逃避潜伏期成绩
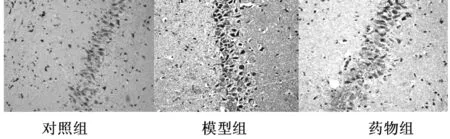
图1 各组海马CA1区IL-β表达(DAB,×200)
3讨论
Aβ是AD形成和发展的重要因素〔4,5〕。 也有学者认为,NFT和轴索缺乏营养等病理性变化以及相应临床症状的出现均晚于Aβ的形成,而且较高浓度的Aβ能引起神经元变性和死亡,发生炎性反应。近年研究表明,脑内的炎性反应贯穿于AD慢性病程的整个过程,胶质细胞激活活化是脑内炎症反应较为显著的特征,它具有诱导一系列炎性细胞活化,增殖的功能〔6,7〕。White等〔8〕实验研究表明,胶质细胞活化后释放的IL-1β引发炎症反应是 AD 早期发展变化和进展的关键病理炎性因子。在Aβ刺激下,小胶质细胞被激活产生的IL-1β能上调小胶质细胞表达释放其他细胞因子,还可诱导产生前列腺素、NO、APP等的生成增加,进一步造成Aβ堆积。Goshen等〔9〕研究证实海马区内出现大量IL-1β,是出现炎症反应的重要标志。IL-1β是细胞内发挥重要作用的免疫调节因子,在异常沉积的老年斑周围积聚了大量的小胶质细胞和星形胶质细胞,激活的胶质细胞能够释一氧化氮(NO),TNFα,IL-1β等炎症因子〔10~12〕。在AD患者大脑中IL-1β主要由激活的小胶质细胞释放产生〔13,14〕,炎性分子作用于小胶质细胞又可促进其他炎性分子的产生,所以这种现象称为交互作用。因为交互作用持续存在因此促进了AD脑内慢性炎症反应的形成和炎性因子产物水平会持续升高,高水平的炎性因子产物对AD脑损伤与淀粉蛋白变性产生广泛的影响。有实验研究证明AD老年斑中发现存在的大量IL-1β蛋白及其mRNA等。闫恩志等〔15,16〕研究报道,IL-1β表达增加后可通过激活的小胶质细胞和星形胶质细胞使iNOS 和环氧化酶的表达增加。所以,IL-1β是炎性反应中的一个重要因子。本实验之前的研究结果提示壳聚糖磷脂酰胆碱可能具有抑制或延迟IKKβ/NF-κB通路激活,降低炎症因子激活增生,起到保护神经胶质细胞作用〔17〕。本次实验研究的结果显示壳聚糖磷脂酰胆碱药物组海马内炎性因子IL-1β表达降低,同时Morris水迷宫测试成绩有明显改善,提示壳聚糖磷脂酰胆碱药物组对AD大鼠空间学习记忆能力有改善作用。
综上,在体条件下Aβ25~35诱导AD大鼠脑组织小胶质细胞增生、活化后,IL-1β大量表达,实验结果表明,壳聚糖磷脂胆碱能够减少炎性因子IL-1β的表达,可改善AD大鼠学习记忆能力,这说明壳聚糖磷脂胆碱能够抑制AD大鼠的脑部炎性反应,可能是防治AD的有效途径之一,但由于本实验属于小样本研究,具体的临床应用还需要进行更进一步的探讨。
4参考文献
1Braak H,Braak E.Frequency of stages of Alzheimer-related lesions in different age categories〔J〕.Neurobiol Aging,1997;18(4):351-5.
2Tuppo EE,Arias HR.The role of inflammation in Alzheimer’s disease〔J〕.Biochem Cell Biol,2005;37(2):289-305.
3Liu L,Chan C.The role of inflammasome in Alzheimer's disease〔J〕.Ageing Res Rev,2014;15(5):6-15.
4孙博,费洪新,姜波,等.阿尔茨海默病发病机制初探〔J〕.中医药信息,2014;31(3):26-30.
5孟庆慧.Aβ诱导AD大鼠的炎症机制及乙酰葛根素和壳聚糖磷脂酰胆碱的干预作用〔D〕.济南:山东大学,2013.
6Ransohoff RM,Cardona AE.The myeloid cells of the central nervous system parenchyma〔J〕.Nature,2010;468:253-62.
7Galimberti D,Scarpini E.Inflammation and oxidative damage in Alzheimer’s disease:friend or foe〔J〕?Front Biosci(ScholEd),2011;3:252-66.
8White JA,Manelli AM,Holmberg KH,etal.Differential effects of oligomeric and fibrillar amyloid-beta 1-42 on astrocyte-mediated inflammation〔J〕.Neurobiol Dis,2005;18(3):459-65.
9Goshen I,Yirmiya R.Interleukin-1(IL-1):a central regulator of stress responses〔J〕.Front Neuroendocrinol,2009;30(1):30-45.
10Li Y,Liu L,Barger SW,etal.Interleukin-1 mediates pathological effects of microglia on tau phosphorylation and on synap-tophysin synthesis in cortical neurons through a p38-MAPK pathway〔J〕.J Neurosci,2003;23(5):1605-11.
11Guo J T,Yu J,Grass D,etal.Inflammation-dependent cerebral deposition of serum amyloid a protein in a mouse model of amyloidosis〔J〕.J Neurosci,2002;22(14):5900-9.
12 Lee JW,Lee YK,Yuk DY,etal.Neuro-inflammation in-duced by lipopolysaccharide causes cognitive impairment through enhancement of beta-amyloid generation〔J〕.J Neuroinflam,2008;29(5):37.
13邬烈铭.老年性痴呆患者认知功能与血清炎性细胞因子浓度的相关研究〔J〕.中华临床医师杂志(电子版),2012;11(6):105.
14刘恺,牛艳丽,邓锦波.小胶质细胞与阿尔茨海默病〔J〕.解剖学杂志,2014;37(2):258-61.
15闫恩志,范莹,隋海娟,等.阿魏酸钠对脂多糖引起的大鼠海马炎症反应的抑制作用及其机制探讨〔J〕.中成药,2013;35(2):211-5.
16Matousek SB,Ghosh S,Shaftel SS,etal.Chronic IL-1β-mediated neuroinflammation mitigates amyloid pathology in a mouse model of Alzheimer's disease without inducing overt neurodegeneration〔J〕.J Neuroimmune Pharmacol,2012;7(1):156-64.
17郭鹤,孟庆慧,汪娟娟,等.壳聚糖磷酯酰胆碱对AD大鼠海马中iNOS和IKKβ表达的影响〔J〕.中国老年学杂志,2013;33(9):2073-6.
〔2014-12-11修回〕
(编辑曹梦园)
〔中图分类号〕R749
〔文献标识码〕A
〔文章编号〕1005-9202(2016)10-2348-03;
doi:10.3969/j.issn.1005-9202.2016.10.015
第一作者:郭鹤(1985-),女,助教,硕士,主要从事老年性痴呆研究。
