黄芩茎叶总黄酮对阿尔茨海默病大鼠海马神经元Bax和Bcl-2蛋白表达的影响
2016-06-29王瑞婷董雅洁左彦珍关丽华
王瑞婷 董雅洁 左彦珍 关丽华 丁 实
(承德医学院药理教研室,河北 承德 067000)
黄芩茎叶总黄酮对阿尔茨海默病大鼠海马神经元Bax和Bcl-2蛋白表达的影响
王瑞婷董雅洁左彦珍关丽华丁实
(承德医学院药理教研室,河北承德067000)
〔摘要〕目的探讨黄芩茎叶总黄酮(SSTF)对大鼠海马注射淀粉样蛋白Aβ25~35所致神经元Bax和Bcl-2蛋白表达的影响。方法40只雄性Wistar大鼠按随机数字表法分为对照组、模型组、SSTF 50 mg/kg、100 mg/kg组,每组10只。模型组、SSTF组大鼠于灌胃第8天双侧海马注射Aβ 10 μg,对照组大鼠海马注射生理盐水,大鼠于灌胃20 d后处死。采用TUNEL法观察大鼠海马神经元凋亡;免疫组化、Western印迹检测海马组织中Bax、Bcl-2的表达,采用光密度值(IOD)表示实验结果。结果模型组大鼠海马细胞凋亡IOD较对照组明显升高(P<0.01),50、100 mg/kg给药组IOD较模型组明显降低(P<0.01);免疫组化及Western印迹结果显示模型组Bax表达较对照组明显升高(P<0.01),SSTF 50、100 mg/kg组Bax表达较模型组明显降低(P<0.01);模型组Bcl-2较对照组明显降低(P<0.01),SSTF 50、100 mg/kg组Bcl-2表达较模型组明显升高(P<0.01)。结论大鼠海马注射Aβ25~35可引起海马神经元凋亡,其机制可能与Aβ 上调凋亡基因Bax表达、降低抗凋亡基因Bcl-2表达有关。SSTF可减轻Aβ引起的神经元凋亡,其机制可能与其调控Bax、Bcl-2表达有关。
〔关键词〕阿尔茨海默病;淀粉样蛋白;黄芩茎叶总黄酮;神经元凋亡;Bax;Bcl-2
淀粉样蛋白(Aβ)作为阿尔茨海默病(AD)发病的始动因子已得到广泛的认可〔1〕。前期研究已显示黄芩茎叶总黄酮(SSTF)能减轻海马注射Aβ引起的大鼠学习记忆能力减退,减轻海马CA1区神经元的脱失和超微结构损伤,且其效应与SSTF的抗氧化作用有关〔2,3〕。体内凋亡和抗凋亡失衡与神经退行性疾病有关,有研究报道Aβ体内、体外均可引起神经元凋亡〔4,5〕,也有实验研究黄酮类化合物的体内、体外抗神经元凋亡作用〔6〕,但SSTF体内对神经元凋亡的影响未见报道。本研究探讨SSTF对Aβ致AD大鼠海马神经元凋亡及与凋亡相关蛋白Bax、Bcl-2表达的影响。
1材料与方法
1.1实验动物雄性Wistar大鼠40只,10~12周龄,体质量(280±20)g,动物证号0289310,北京华阜康生物科技股份有限公司提供,许可证号SCXK(京)2009-0004,SPF级,全部实验在SPF动物实验室进行,实验室合格证号:SYXK(冀2009-0022)。动物室温度(22±2)℃,湿度(50±5)%,自由摄食饮水。
1.2试剂Aβ25~35购自Sigma公司,HPLC≥97%,SSTF由承德医学院中药研究所提供,纯度61.88%。脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)细胞凋亡检测试剂盒购自罗氏公司,山羊抗兔Bcl-2多抗(Lot:K2206)、山羊抗兔Bax多抗(Lot:E1607)、小鼠β-actin 单抗购自 SANTA CRUZ公司。SP9000、SP9002免疫组化试剂盒、山羊抗兔IgG/辣根过氧化物酶标记(Lot:73399)购自中杉金桥公司。RIPA强裂解液购自碧云天生物技术研究所,BCA蛋白定量试剂盒购自上海炎彬化工科技有限公司。ECL超敏发光液购自北京普利莱基因技术有限公司,PVDF膜Millipore 公司产品。
1.3试剂的配制Aβ25~351 mg溶于500 μl无菌生理盐水(2 g/L),-20℃保存,临用前置于37℃孵育5~7 d成凝胶态。黄芩茎叶总黄酮溶于蒸馏水中,调pH值为中性,现用现配,用前置室温,摇匀。
1.4方法
1.4.1实验动物分组及AD模型制作雄性Wistar 大鼠40只,随机数字表法分为对照组、模型组、SSTF 50、100 mg/kg组,每组10只。对照组和模型组大鼠给予蒸馏水灌胃,给药组灌胃总黄酮,1次/d,连续20 d,于大鼠前囟后(AP)-3.5 mm,左右旁开(ML)±2 mm,进针深度(DV)2.7 mm定位海马CA1区,灌胃第8天对照组双侧海马各注射5 μl的无菌生理盐水,其他组双侧海马各注射Aβ25~355 μl含10 μg制作AD模型。所有动物于灌胃第20天处死,每组取4只大鼠脑组织制作石蜡标本。
1.4.2TUNEL检测石蜡切片脱蜡、水合,细胞通透,加入TUNEL反应液,加converter-POD,DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。以胞质或胞核着棕黄色为凋亡阳性细胞。
1.4.3免疫组化切片经二甲苯脱蜡,梯度酒精水合,95℃水浴抗原修复,滴加Ⅰ抗孵育37℃ 2.5 h,Ⅰ抗浓度分别为兔抗Bax多抗(1∶100)、兔抗Bcl-2多抗(1∶75)。Ⅱ抗孵育37℃ 15 min,DAB显色,苏木素复染,中性树胶封片,用PBS液代替一抗为阴性对照。
1.4.4TUNEL、免疫组化阳性细胞累积光密度测定每组选取4只大鼠脑组织石蜡标本,光镜下每个标本选注射部位附近海马CA1区2张切片,400倍视野下采用image-pro plus软件进行光密度测定。
1.4.5Western印迹蛋白提取及定量:称取每组6只大鼠的海马组织0.15~0.2 g加1 ml PBS-NaF,研磨(冰上操作)、离心、裂解、蛋白定量采用BCA试剂盒,按说明书操作。制胶、上样、凝胶电泳、转膜、封闭过夜,Ⅰ抗孵育,Ⅰ抗浓度分别为兔抗Bax多抗(1∶200)、兔抗Bcl-2多抗(1∶100)、β-actin单抗(1∶1 000),Ⅱ抗孵育2 h,Ⅱ抗浓度山羊抗兔IgG/辣根过氧化物酶标记1∶3 000,显影、定影。 光密度值测定:胶片扫描后采用Gelpro4软件测定灰度值,每个组织每个指标的灰度值与该组织的β-actin灰度值相比。
1.5统计学方法采用SPSS11.5软件进行单因素方差分析。
2结果
2.1SSTF对大鼠海马神经元凋亡的影响TUNEL检测发现模型组大鼠海马神经元多数细胞核呈棕黄色,对照组大鼠海马神经元核着色细胞少,着色浅,SSTF组较模型组着色浅,着色细胞少,见图1。模型组IOD〔(40.41±9.1)×103〕较对照组〔(7.77±1.8)×103〕明显升高(P<0.01);SSTF 50 mg/kg和100 mg/kg组IOD〔(20.80±4.4)×103vs(12.56±4.5)×103〕明显低于模型组(P<0.01)。
2.2SSTF对大鼠海马神经元Bax、Bcl-2表达的影响(免疫组化)模型组大鼠海马CA1区Bax免疫组化IOD较对照组明显升高;SSTF组IOD较模型组明显降低,见表1。Bax在大鼠海马神经元胞质呈棕黄色颗粒状,模型组海马CA1区多数神经元胞质黄染,较对照组着色深,SSTF组较模型组着色浅,见图2。Bcl-2在大鼠海马神经元胞质中呈棕黄色,模型组海马CA1区着色细胞数比对照组少,着色浅,SSTF组较模型组着色细胞多,着色深,见图3。模型组海马CA1区Bcl-2免疫组化IOD明显低于对照组,SSTF组IOD明显高于模型组,见表1。

图1 大鼠海马CA1区神经元凋亡(TUNEL,×400)
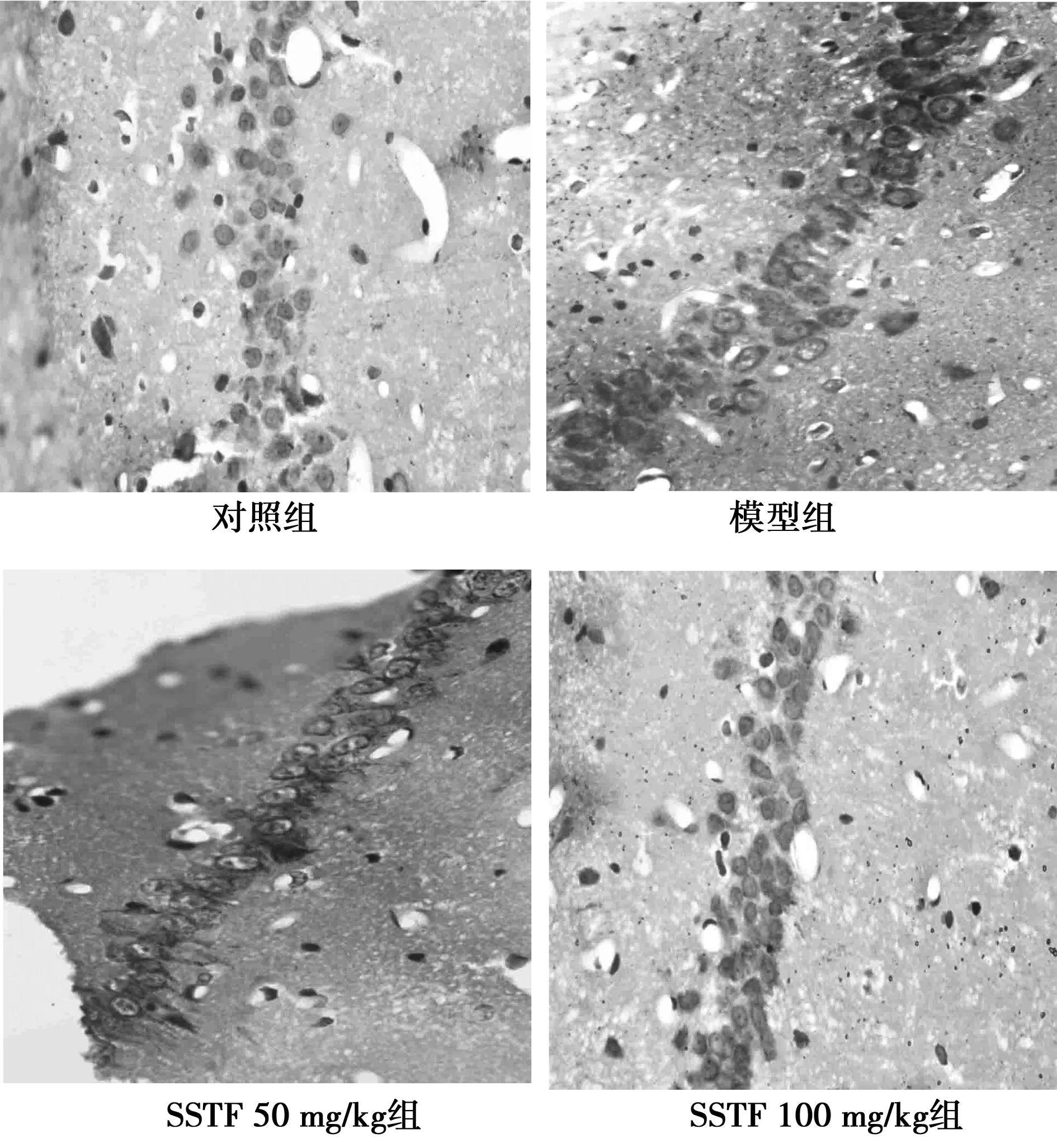
图2 大鼠海马CA1区Bax表达(DAB,×400)

组别BaxBcl-2对照组20.78±5.17115.24±24.56模型组144.51±30.451)21.45±5.271)SSTF50mg/kg组87.65±24.562)46.27±8.372)SSTF100mg/kg组52.17±12.782)76.74±18.192)
与对照组比较:1)P<0.01;与模型组比较:2)P<0.01

图3 大鼠海马CA1区神经元Bcl-2表达(IHC,×400)
2.3SSTF对大鼠海马组织中Bax、Bcl-2表达量的影响(Western印迹)模型组大鼠海马组织中Bax/β-actin明显高于对照组;SSTF组明显低于模型组;模型组大鼠海马组织中Bcl-2/β-actin明显低于对照组,SSTF组明显高于模型组;模型组Bax/bcl-2较对照组明显升高,SSTF组较模型组明显降低,见表2,图4。

表2 黄芩茎叶总黄酮对大鼠海马CA1区神经元Bax,Bcl-2
与对照组比较:1)P<0.01;与模型组比较:2)P<0.05,3)P<0.01

1~4:SSTF 50、100 mg/kg组、模型组、对照组图4 大鼠海马组织中Bax,Bcl-2 的表达(Western印迹)
3讨论
线粒体凋亡途径主要有P53蛋白、Bax蛋白、Bcl-2蛋白及caspase的参与〔7,8〕。Caspase-3是凋亡执行的关键因子,它的激活与细胞色素C(cyt-c)自线粒体释放、线粒体损伤、神经元凋亡密切相关〔9〕。Bcl-2基因家族中Bcl-2蛋白与Bax蛋白是一对互相拮抗的蛋白,Bcl-2具有明显抑制凋亡作用,而Bax则促进凋亡,Bax,Bcl-2 通过影响线粒体外膜通透性来调节cyt-c 释放,Bax占优势时,cyt-c自线粒体释放,导致凋亡发生一系列瀑布反应〔10〕。Aβ也可引起线粒体呼吸链的复合体Ⅲ(泛醌-细胞色素C-还原酶)、Ⅳ(细胞色素C氧化酶,COX)活性降低〔11〕,其活性降低会导致ATP产生下降,过多的电子直接使氧分子O2产生超氧阴离子O2-和其他ROS〔14〕,线粒体内膜上的心肌磷脂作为线粒体膜的唯一磷脂也是ROS的靶点,ROS的升高引起心肌磷脂过氧化,氧化的心肌磷脂与cyt-c结合力下降,引起cyt-c完全释放〔12〕。本实验结果提示Aβ可能通过影响Bax,Bcl-2表达,影响线粒体外膜通透性,调节cyt-c释放,引起神经元凋亡;Silva等〔13〕研究发现AD患者线粒体内Aβ寡聚体含量增加,加速了线粒体损伤。TAT-XIAP可通过减少Aβ引起的海马神经元凋亡而改善大鼠学习记忆能力〔14〕。前期实验结果证明Aβ可以引起ROS增多〔15〕,因此Aβ也可能通过ROS引起cyt-c释放,诱导凋亡。本文结果显示SSTF较模型组大鼠海马神经元凋亡明显减少,Bax表达下调,Bcl-2上调,Bax/Bcl-2比值明显降低,提示SSTF通过对抗Aβ引起的凋亡相关基因改变来减轻神经元凋亡。前期研究结果显示SSTF具有明显的抗氧化作用〔2〕,因此推测SSTF的抗凋亡作用也可能通过抗氧化,降低ROS产生而减轻神经元凋亡。有研究报道通过上调超氧化物歧化酶、谷胱甘肽过氧化物酶活性可减少细胞的凋亡〔16〕。Zhu等〔17〕研究发现一种黄酮糖苷Hibifolin能够抑制Aβ引起的皮层神经元中caspase-3,7的激活,抑制Ca2+流动,减少DNA断裂。丁振禹等〔18〕研究发现三羟基异黄酮可影响APP695基因转染PCI2细胞Bax和Bcl-2蛋白表达。
黄酮类化合物除了从抗氧化、抗凋亡机制减轻Aβ引起的神经毒性外,也有研究显示通过影响Aβ生成、Aβ原纤维形成起到保护神经元作用。Jung等〔19〕研究了从槐属植物中提取的总黄酮能抑制β分泌酶活性,淀粉样蛋白前体(APP)通过β、γ分泌酶裂解产生Aβ,因此抑制β分泌酶活性可减少Aβ生成。Naiki等〔20〕采用离体实验研究了五种黄酮类化合物的作用,能够抑制Aβ原纤维的形成及增强原纤维的不稳定性。Aβ在体内以可溶性状态存在时没有毒性,形成原纤维丝后会产生毒性。Lemkul等〔21〕也证实桑黄素可以结合到原纤维的末端阻断新的肽附着,能渗入到疏水中心在天冬氨酸与赖氨酸处裂解,干扰主链上的氢键而影响原纤维丝的形成。
本文显示SSTF可减轻Aβ引起的神经元凋亡,其作用机制与其影响凋亡相关基因表达、抗氧化作用有关,本研究结果为进一步研发黄芩茎叶总黄酮用于神经退行型疾病的预防和治疗提供了实验依据。黄芩茎叶总黄酮的抗凋亡作用与凋亡通路中信号转导间关系仍需进一步研究。
4参考文献
1Lv G,Cui B,Lan H,etal.Diarylethene based fluorescent switchable probes for the detection of amyloid-β pathology in Alzheimer's disease〔J〕.Chem Commun(Camb),2015;51(1):125-8.
2王瑞婷,张建新,董雅洁.黄芩茎叶总黄酮对AD大鼠模型海马神经元超微结构的影响及抗氧化作用〔J〕.中国老年学杂志,2010;30(7):926-8.
3金春慧,袁建民,程灶火.漆黄素改善阿尔茨海默病模型小鼠学习记忆障碍的细胞内信号通路〔J〕.中华行为医学与脑科学杂志,2012;21(10):865-8.
4Javier Miguel-Hidalgo J,Paul IA,Wanzo V,etal.Memantine prevents cognitive impairment and reduces Bcl-2 and caspase 8 immunoreactivity in rats injected with amyloid β(1-40)〔J〕.Eur J Pharmacol,2012;692(1-3):38-45.
5Xu J,Zhang R,Zuo P,etal.Aggravation effect of isoflurane on Aβ(25-35)-induced apoptosis and tau hyperphosphorylation in PC12 cells〔J〕.Cell Mol Neurobiol,2012;32(8):1343-51.
6Huang HC,Xu K,Jiang ZF,etal.Curcumin-mediated neuroprotection against amyloid-β-induced mitochondrial dysfunction involves the inhibition of GSK-3β〔J〕.J Alzheimers Dis,2012;32(4):981-96.
7Kazuchika Nishitsuji,Takami Tomiyama,Kenichi Ishibashi,etal.The E693Δ mutation in amyloid precursor protein increases intracellular accumulation of amyloid β oligomers and causes endoplasmic reticulum stress-induced apoptosis in cultured cells〔J〕.Am J Pathol,2009;174(3):957-69.
8Silva DF,Selfridge JE,Lu J,etal.Mitochondrial abnormalities in Alzheimer's disease:possible targets for therapeutic intervention〔J〕.Adv Pharmacol,2012;64:83-126.
9Musatov A,Robinson NC.Susceptibility of mitochondrial electron-transport complexes to oxidative damage.Focus on cytochrome c oxidase〔J〕.Free Radic Res,2012;46(11):1313-26.
10Todt F,Cakir Z,Reichenbach F,etal.Differential retrotranslocation of mitochondrial Bax and Bak〔J〕.EMBO J,2015;34(1):67-80.
11Evstafieva AG,Garaeva AA,Khutornenko AA,etal.A sustained deficiency of mitochondrial respiratory complex Ⅲ induces an apoptotic cell death through the p53-mediated inhibition of pro-survival activities of the activating transcription factor 4〔J〕.Cell Death Dis,2014;5:e1511.
12Jacquemin G,Margiotta D,Kasahara A,etal.Granzyme B-induced mitochondrial ROS are required for apoptosis〔J〕.Cell Death Differ,2015;22(5):862-74.
13Silva DF,Santana I,Esteves AR,etal.Prodromal metabolic phenotype in MCI cybrids:implications for Alzhermer’s disease〔J〕.Curr Alzheimer Res,2013;10(2):180-90.
14夏春波,蒋常文,刘源劫,等.TAT-XIAP融合蛋白对学习记忆障碍大鼠的影响及其机制〔J〕.中华行为医学与脑科学杂志,2013;22(7):587-90.
15王瑞婷,关丽华,周健,等.黄芩茎叶总黄酮对Aβ25~35致大鼠学习记忆损伤及海马抗氧化酶活性的影响〔J〕.神经药理学报,2011;1(2):14-8.
16Zhao J,Xu S,Song F,etal.2,3,5,4'-tetrahydroxystilbene-2-O-β-d-glucoside protects human umbilical vein endothelial cells against lysophosphatidylcholine-induced apoptosis by upregulating superoxide dismutase and glutathione peroxidase〔J〕.UBMB Life,2014;66(10):711-22.
17Zhu JT,Choi RC,Xie HQ,etal.Hibifolin,a flavonol glycoside,prevents beta-amyloid-induced neurotoxicity in cultured cortical neurons〔J〕.Neurosci Lett,2009;461(2):172-6.
18丁振禹,赵翠香,王凤斌,等.三羟基异黄酮对APP695基因转染PCI2细胞Bax和Bcl-2蛋白表达的影响〔J〕.中华行为医学与脑科学杂志,2013;22(9):791-3.
19Jung HA,Yokozawa T,Kim BW,etal.Selective inhibition of prenylated flavonoids from Sophora flavescens against BACE1 and cholinesterases〔J〕.Am J Chin Med,2010;38(2):415-29.
20Naiki H,Hasegawa K,Ono K,etal.A search for antiamyloidogenic compounds based on a nucleation-dependent polymerization model〔J〕.Yakugaku Zasshi,2010;130(4):503-9.
21Lemkul JA,Bevan DR.Destabilizing Alzheimer's A beta 42 protofibrils with morin:mechanistic insights from molecular dynamics simulations〔J〕.Biochemistry,2010;49(18):3935-46.
〔2015-03-17修回〕
(编辑苑云杰/曹梦园)
基金项目:河北省科技厅资助项目(08276101D-21)
〔中图分类号〕R962
〔文献标识码〕A
〔文章编号〕1005-9202(2016)10-2337-04;
doi:10.3969/j.issn.1005-9202.2016.10.011
第一作者:王瑞婷(1969-),女,教授,博士,硕士生导师,主要从事植物药抗痴呆作用研究。
