猴头菌菌丝体萜类物质提取优化及抗氧化研究
2016-06-29何晋浙
何晋浙,沈 强
(浙江工业大学 海洋学院,浙江 杭州 310014)
猴头菌菌丝体萜类物质提取优化及抗氧化研究
何晋浙,沈强
(浙江工业大学 海洋学院,浙江 杭州 310014)
摘要:为了提高猴头菌菌丝体中萜类物质提取率,通过酶解和酸解关键技术对猴头菌菌丝体进行前处理,再通过溶剂回流提取方法进行工艺参数优化;为了研究猴头菌菌丝体中萜类物质的抗氧化性能,采用体外抗氧化活性法测定萜类物质的超氧阴离子、DPPH·和ABTS+·自由基清除能力.实验结果表明:酶解和酸解相结合的前处理,够显著提高猴头菌菌丝体中萜类物质的提取率;通过单因素试验和响应面分析法(RSM)实验,得到优化的回流提取工艺条件为料液比1∶36 g/mL,提取温度63 ℃,提取时间92 min,猴头菌菌丝体中萜类小分子活性物质的提取率从1.80%提高到3.39%;萜类物质清除超氧阴离子的半数效应质量浓度EC50=0.926 mg/mL;清除DPPH·自由基的半数效应质量浓度EC50=1.206 mg/mL;清除ABTS+·自由基的半数效应质量浓度EC50=0.403 mg/mL.该研究可为猴头菌菌丝体中萜类物质的工业提取和应用提供新的参考.
关键词:萜类物质;酶解和酸解;响应面分析;抗氧化活性
猴头菌在分类学上隶属菌物界,担子菌门,担子菌纲,猴菌目,猴菌科,猴菌属[1-2].猴头菌的药效成分主要有多糖、低聚糖、甾醇、脂肪酸等,具有降血糖、增强人体免疫力、保肝护胃、保护神经、抗氧化和抗癌等功效[3-5].据文献报道,从猴头菌菌丝体提取分离出来的猴头菌菌丝体中萜类物质其主要组成为猴头菌素[6-7],具有刺激神经生长因子、抗氧化和抗菌效用等药理学作用,尤其对阿尔茨海默病(老年痴呆症)的治疗、外围神经细胞再生起到重要促进作用[8-12],目前对于治疗老年痴呆症的食用天然产物的研究已成为国内外的热点[13].由于猴头菌菌丝体中萜类物质提取率极低,如文献报道采用的溶剂回流提取、微波提取、超声提取和超临界提取率均小于2.4%[8-12],且提取成本高,使猴头菌菌丝体中萜类物质进一步提取与开发利用成为瓶颈.
针对猴头菌菌丝体中萜类物质提取率低这一关键技术点,采用了纤维素酶酶解和酸水浸泡的关键技术,通过破坏猴头菌菌丝体细胞结构,再进行溶剂回流提取猴头菌菌丝体中萜类物质;采用体外抗氧化活性法测定萜类物质的超氧阴离子、DPPH·及ABTS+·自由基的清除能力,评价其抗氧化活性.
1材料与方法
1.1材料与试剂
猴头菌菌丝体粉末60目,北京福尔康生物技术研究所.
乙醇(体积分数为95%)、盐酸、乙酸、硫酸、香兰素、无水乙醇、高氯酸、石油醚和乙酸乙酯等均为分析纯,国药集团化学试剂有限公司;纤维素酶(1.8×104 U/g),和氏璧微生物技术有限公司;野黄芩苷标准品,Sigma公司;1,1-二苯基-2-苦基肼自由基(DPPH) 、ABTS,美国Sigma 公司.
1.2主要仪器设备
UV-7504紫外可见分光光度计,上海欣茂仪器有限公司;恒温水浴锅,上海信森实验仪器有限公司;AL-104电子天平,METTLER TOLEDO有限公司;RE-2000A旋转蒸发仪,上海亚荣盛华仪器厂.
1.3提取工艺流程与方法
1.3.1工艺流程
猴头菌菌丝体粉末→称量→纤维素酶酶解→高温灭酶→酸水浸泡24 h→蒸干水分→溶剂回流提取→过滤→定容→紫外可见分光光度计测定OD值(紫外分光光度法).
1.3.2不同方法对猴头菌菌丝体粉末中萜类物质提取率的影响
1) 乙醇回流提取法
准确称取干燥猴头菌菌丝体粉末10 g(精确到0.000 1 g),转移到500 mL圆底烧瓶中,加入体积分数为95%的乙醇100 mL,在回流提取装置中回流提取(提取料液比1∶ 20 g/mL,提取时间60 min,提取温度60 ℃,乙醇体积分数95%,),过滤,乙醇定容至250 mL.
2) 酶解前处理乙醇回流提取法
准确称取干燥猴头菌菌丝体粉末10 g(精确到0.000 1 g),置于250 mL烧杯中,加水100 mL,用盐酸调节pH到4.5,加入0.1 g纤维素酶,恒温水浴锅内50 ℃酶解90 min,煮沸灭活10 min.转移到500 mL圆底烧瓶中,旋转蒸发至干,加入体积分数为95%的乙醇100 mL,溶剂回流提取(提取料液比1∶20 g/mL,提取时间60 min,提取温度60 ℃,乙醇体积分数95%),过滤,乙醇定容至250 mL.
3) 酸水浸提前处理乙醇回流提取法
准确称取干燥猴头菌菌丝体粉末10 g(精确到0.000 1 g),置于250 mL烧杯中,加水100 mL,用盐酸调节pH值到2,浸泡24 h,转移到500 mL圆底烧瓶中,旋转蒸发至干,加入体积分数为95%的乙醇100 mL,溶剂回流提取(提取料液比1∶20 g/mL,提取时间60 min,提取温度60 ℃,乙醇体积分数95%),过滤,乙醇定容至250 mL.
4) 酶解加酸水浸提前处理乙醇回流提取法
准确称取干燥猴头菌菌丝体粉末10 g(精确到0.000 1 g),置于250 mL烧杯中,加水100 mL,用盐酸调节pH值到4.5,加入0.1 g纤维素酶,50 ℃酶解90 min,煮沸灭活10 min.用盐酸调节pH值到2,浸泡24 h,转移到500 mL圆底烧瓶中,旋转蒸发至干,加入体积分数为95%的乙醇100 mL,溶剂回流提取(提取料液比1∶20 g/mL,提取时间60 min,提取温度60 ℃,乙醇体积分数95%),过滤,乙醇定容至250 mL.
实验重复3次,采用SPSS18.0软件对四种不同前处理对猴头菌菌丝体中萜类物质提取率进行统计学分析.
1.4猴头菌菌丝体中萜类物质定性鉴定
取乙醇提取液进行薄层色谱分析,展开剂为乙酸乙酯和石油醚体系,显色分别为萜类物质通用指示剂硫酸乙醇和香兰素硫酸乙醇.硅胶板上显示出紫红色斑点,说明提取液中含有猴头菌菌丝体中萜类物质[14].
取乙醇提取液1 mL至具塞试管中,挥发掉溶剂,加入0.4 mL 冰醋酸-香草醛溶液(5 g香草醛溶于冰醋酸,定容到100 mL)和1.5 mL高氯酸,70 ℃水浴15 min后,加入5 mL无水乙醇,充分震荡后,用无水乙醇作为空白对照,在400~800 nm范围内进行紫外全扫描.在540 nm附近若出现最大吸收峰,说明提取液中含有猴头菌菌丝体中萜类物质[15-17].
1.5萜类成分的测定和提取率计算
采用紫外分光光度法测定猴头菌菌丝体中萜类物质提取率[18-20].
以野黄芩苷为标准品,分别用溶剂无水乙醇配制质量浓度分别为4.0,8.0,12.0,16.0,20.0 μg/mL标准溶液,在210 nm处进行紫外测定,进行标准工作曲线制作.
标准曲线如图1 所示.回归方程:y=0.080 1x-0.033 3,R2=0.999 8,表明野黄芩苷在4~20 μg /mL 范围内线性关系良好.

图1 野黄芩苷标准品质量浓度测定标准曲线Fig.1 Calibration plot of scutellarin
猴头菌菌丝体中萜类物质提取率=(萜类小分子质量浓度×体积×稀释倍数)/原料质量×100%.
1.6单因素实验设计
以料液比、乙醇体积分数、提取温度及提取时间为单因素,对猴头菌菌丝体中萜类物质提取进行研究[21].
1.6.1料液比条件控制
准确称取干燥猴头菌菌丝体粉末10 g(精确到0.000 1 g),置于250 mL烧杯中,加水100 mL,用盐酸调节pH值到4.5,加入0.1 g纤维素酶,50 ℃酶解90 min,煮沸灭活10 min.用盐酸调节pH值到2,浸泡24 h,转移到500 mL圆底烧瓶中,旋转蒸发至干,采用不同料液比(1∶ 10,1∶ 20,1∶ 30,1∶ 40,1∶ 50 g/mL)提取,回流提取设定条件:提取时间60 min,提取温度60 ℃,乙醇体积分数95%.
1.6.2乙醇体积分数条件控制
准确称取干燥猴头菌菌丝体粉末10 g(精确到0.000 1 g),置于250 mL烧杯中,加水100 mL,用盐酸调节pH值到4.5,加入0.1 g纤维素酶,50 ℃酶解90 min,煮沸灭活10 min.用盐酸调节pH值到2,浸泡24 h,转移到500 mL圆底烧瓶中,旋转蒸发至干,用不同提取乙醇体积分数(45%,55%,65%,75%,85%,95%)提取,回流提取设定条件:料液比1∶30 g/mL,提取温度60 ℃,提取时间60 min.
1.6.3温度条件控制
准确称取干燥猴头菌菌丝体粉末10 g(精确到0.000 1 g),置于250 mL烧杯中,加水100 mL,用盐酸调节pH值到4.5,加入0.1 g纤维素酶,50 ℃酶解90 min,煮沸灭活10 min.用盐酸调节pH值到2,浸泡24 h,转移到500 mL圆底烧瓶中,旋转蒸发至干,用不同温度(50,60,70,80,90 ℃)提取,回流提取设定条件:提取时间60 min,料液比1∶30 g/mL,乙醇体积分数65%.
1.6.4时间条件控制
准确称取干燥猴头菌菌丝体粉末10 g(精确到0.000 1 g),置于250 mL烧杯中,加水100 mL,用盐酸调节pH值到4.5,加入0.1 g纤维素酶,50 ℃酶解90 min,煮沸灭活10 min.用盐酸调节pH值到2,浸泡24 h,转移到500 mL圆底烧瓶中,旋转蒸发至干,用不同提取时间(30,60,90,120,150 min)提取,回流提取设定条件:料液比1∶30 g/mL,提取温度70 ℃,乙醇体积分数65%.
1.7Box-Behnken 试验设计
根据Box-Benhnken 的中心组合实验设计原理,试验辅助软件采用Design Expert8.0.6,选取料液比、提取温度、提取时间对猴头菌菌丝体中萜类物质提取率影响显著的三个因素, 在单因素试验的基础上采用三因素三水平的响应面分析方法,试验因素水平及编码如表1所示.
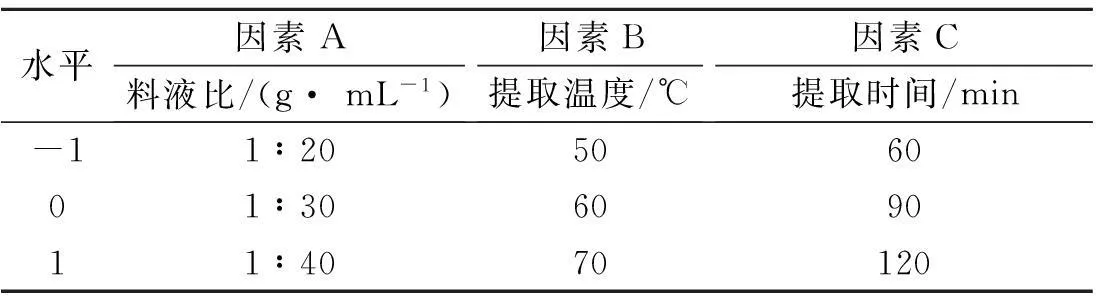
表1 Box-Behnken试验设计因素编码及水平
1.8抗氧化活性的测定
参照邵芬娟等[22]的方法,配置与样品浓度相应的不同浓度的BHT和PG溶液作为对照.
1.8.1清除超氧阴离子自由基能力测定
在弱碱性条件下,邻苯三酚自氧化,O2-·清除剂能使邻苯三酚自氧化产物在λ=325 nm吸收峰处受抑制[23].
分别取3 mL TRIS-HCL缓冲溶液(50 mmol/L,pH=8.2)于试管中,25 ℃水浴中预热20 mim,取出后立即加入2 mL样品溶液和1 mL的5 mmol/L邻苯三酚,混匀后25 ℃水浴保温40 min,在325 nm下测吸光值.清除率为
C=[A0-(A1-A2)]/A0×100%
式中:A0为未加样液的邻苯三酚的吸收值;A1为待测样品吸收值;A2为未加邻苯三酚的样液吸收值.
1.8.2对自由基DPPH·的清除作用
DPPH是一种比较稳定的自由基,其乙醇溶液呈紫色,在517 nm处有有一强吸收峰,自由基清除剂的存在使其褪色.
移取1 mL样品溶液于试管中,加入2 mL用无水乙醇配制的0.1 mmol/L DPPH溶液,摇匀后室温放置30 min,于517 nm处测定吸光值.清除率为
C=[1-(A1-A0)/A2]×100%
式中:A2为2 mL DPPH·溶液与2 mL乙醇溶液混合后的吸光度;A1为2 mL样品溶液与2 mL DPPH·溶液混合后的吸光度;A0为2 mL样品溶液与 2 mL无水乙醇混合后的吸光度.
1.8.3清除ABTS+·自由基的测定
ABTS经活性氧氧化后生成稳定的蓝绿色阳离子自由基ABTS+·,抗氧化物质与ABTS+·发生反应而使反应体系褪色,这种自由基在734 nm处有最大吸光度,在734 nm处测定吸光度便可以定量分析样品的抗氧化能力[24].
移取1 mL样品溶液于试管中,加入3 mL ABTS+·工作液(7 mmol/L ABTS二铵盐溶液和4.9 mmol/L过硫酸钾溶液1∶1混合均匀,避光反应12 h,1∶50的比例稀释),摇匀后静置1 h,在734 nm处测吸光值.清除率为
C=[1-(A1-A0)/A2]×100%
式中:A2为2 mL ABTS+· 溶液与2 mL乙醇混合后的吸光度;A0为2 mL乙醇溶液与2 mL样品液的吸光度;A1为2 mL ABTS+·溶液与2 mL样品溶液混合后的吸光度.
2结果与讨论
2.1不同前处理对猴头菌菌丝体中萜类物质提取率的影响
不同前处理对猴头菌菌丝体中萜类物质提取率的影响,如表2所示.
表2不同前处理对猴头菌菌丝体中萜类物质提取率的影响
Table 2Comparison of the yield of small molecule terpenoids active substances with different pretreatment

方法1)提取率/%乙醇回流提取法1.793±0.017酶解前处理乙醇回流提取法2.579±0.025酸水浸提前处理乙醇回流提取法2.789±0.030酶解加酸水浸提前处理乙醇回流提取法3.193±0.033
注:1) 乙醇的体积分数为95%.
结果得出酶解加酸水浸提前处理后再用溶剂提取与直接溶剂提取两者间的提取率差异达到显著水平(P<0.05).
2.2单因素试验分析
2.2.1料液比对猴头菌菌丝体中萜类物质提取的影响
由图2可看出:猴头菌菌丝体中萜类物质提取率随着料液比的增大先增大后趋于平稳,当料液比超过1∶30 g/mL时,再增大料液比,提取率趋于稳定.可能因为1∶30 g/mL溶剂已将萜类物质溶出完全,综合考虑萜类物质提取率、溶剂用量和能量损耗等因素,故选择料液比1∶30 g/mL为宜.

图2 溶剂回流提取法中料液比对猴头菌菌丝体中萜类物质提取的影响Fig.2 Effect of material liquid ratio on yield of terpenoids substances from hericium erinaceum by heating in water bath
2.2.2乙醇体积分数对猴头菌菌丝体中萜类物质提取的影响
由图3可看出:45%乙醇对猴头菌菌丝体中萜类物质提取率相对不高,而高体积分数乙醇对于猴头菌菌丝体中萜类物质提取率影响并不是很大,乙醇体积分数为65%时,萜类物质提取率略高于其他乙醇体积分数提取率,由此认为,溶剂回流提取猴头菌菌丝体中萜类物质的乙醇体积分数为65%左右为宜.
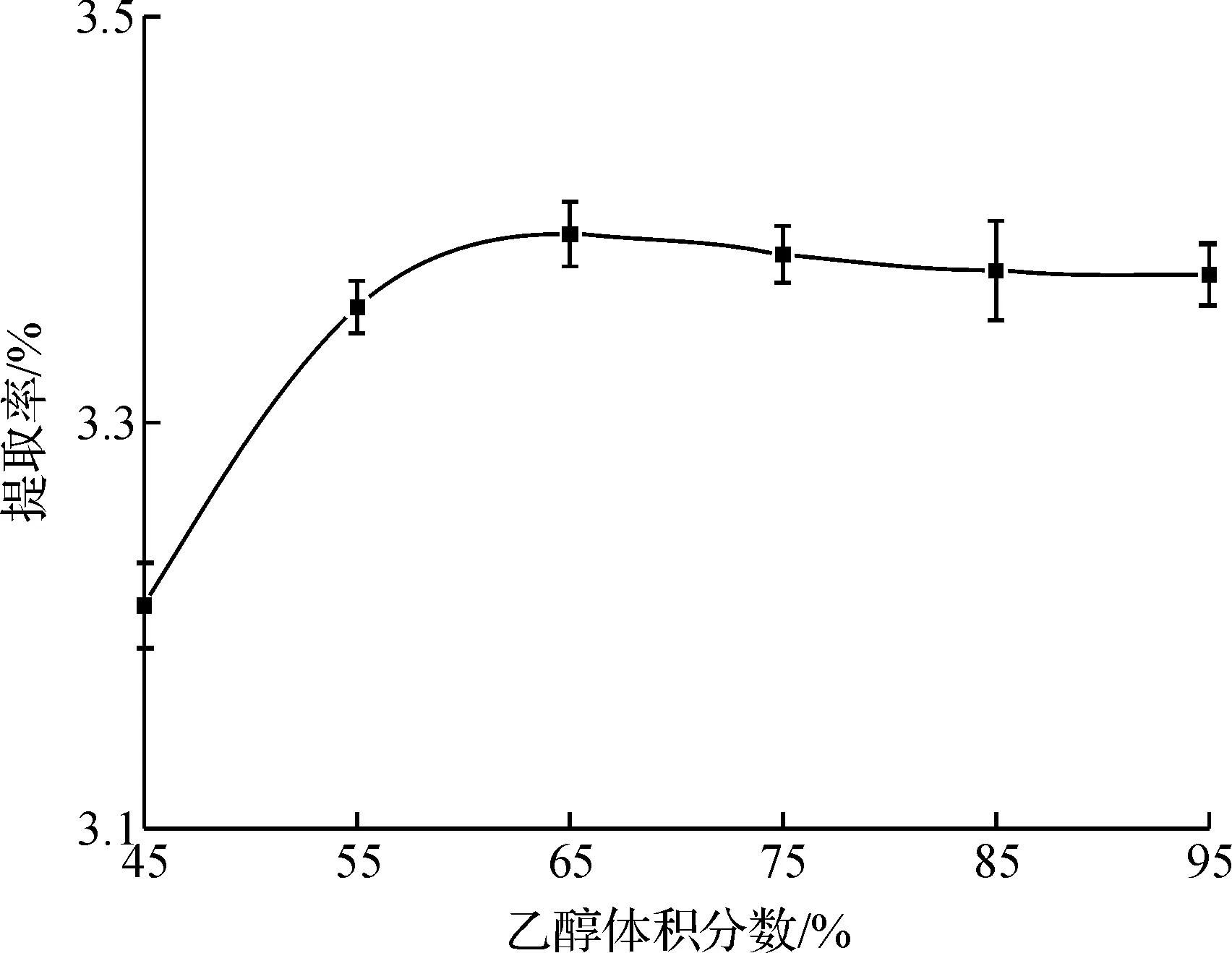
图3 溶剂回流提取法中乙醇体积分数对猴头菌菌丝体中萜类物质提取的影响Fig.3 Effect of ethanol concentration on yield of terpenoids substances from hericium erinaceum by heating in water bath
2.2.3温度对猴头菌菌丝体中萜类物质提取的影响
由图4可看出:随着温度的升高,猴头菌菌丝体中萜类物质提取率先增大后减小,当温度为70 ℃时,萜类物质的提取率达到最大.可能的原因是在50~70 ℃的温度范围内,升高温度能有效加快分子运动,增大细胞壁的摩擦力,破壁效应增强,利于萜类物质的提取,当温度继续升高时,高温会破坏提取液中的部分萜类物质,导致提取率的下降,因此,选择70 ℃为较佳的提取温度.

图4 溶剂回流提取法中温度对猴头菌菌丝体中萜类物质提取的影响Fig.4 Effect of temperature on yield of terpenoids substances from hericium erinaceum by heating in water bath
2.2.4时间对猴头菌菌丝体中萜类物质提取的影响
由图5可看出:随着提取时间的增长,猴头菌菌丝体中萜类物质提取率先增大后趋于平稳,当时间为90 min左右时,萜类物质提取率达到最大值.其中的原因可能是当提取时间较短时,萜类物质的提取不完全,当提取时间过长时,使萜类物质完全被提取出来了,综合考虑选择90 min左右为宜.
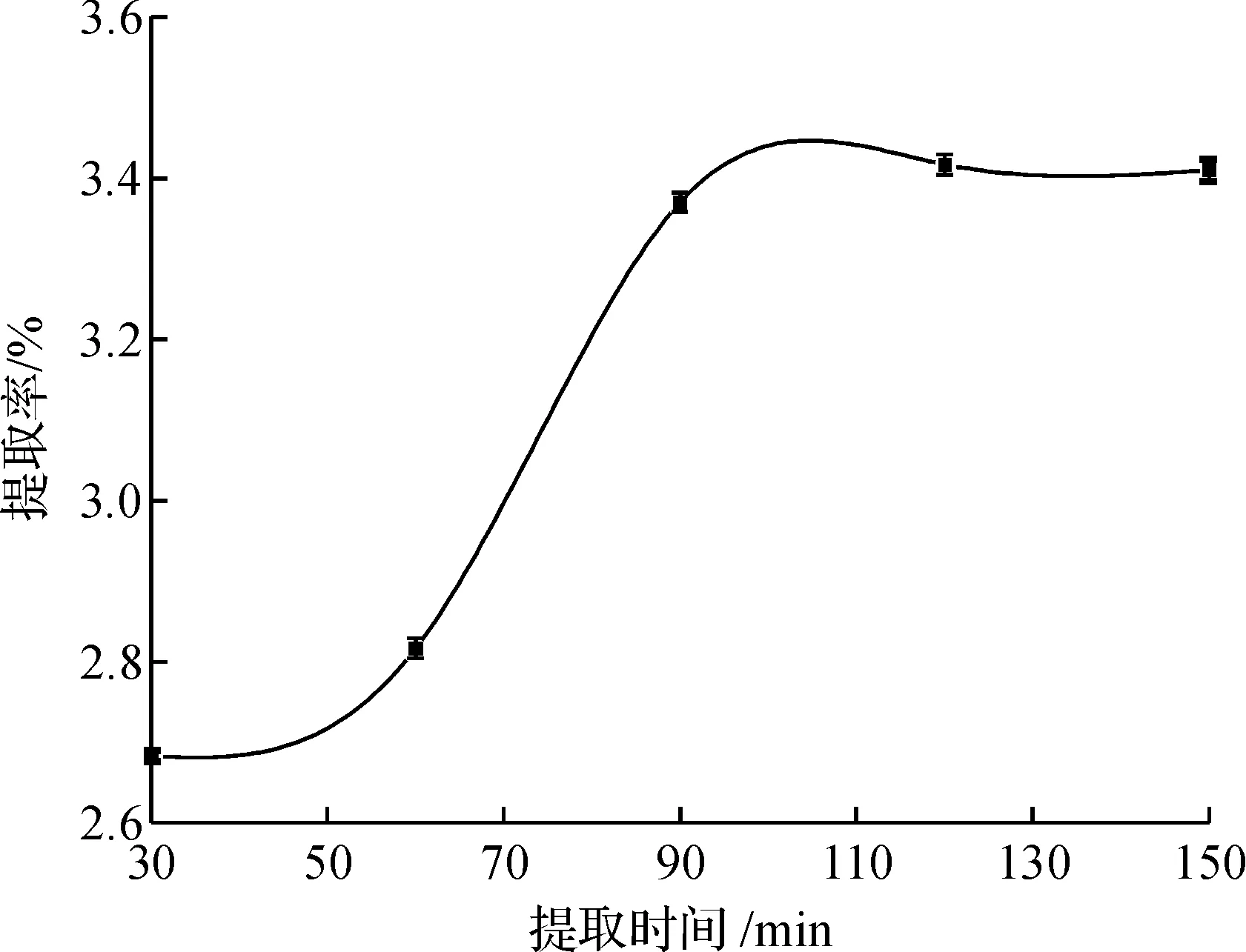
图5 溶剂回流提取法中时间对猴头菌菌丝体中萜类物质提取的影响Fig.5 Effect of time on yield of terpenoids substances from hericium erinaceum by heating in water bath
2.3响应面分析
根据Box-Behnken 中心组合试验设计原理,综合分析单因素,选取对猴头菌菌丝体萜类物质提取率影响较大的料液比、提取时间和提取温度3 因素,设计3 因素3 水平的响应面分析试验,如表3所示.
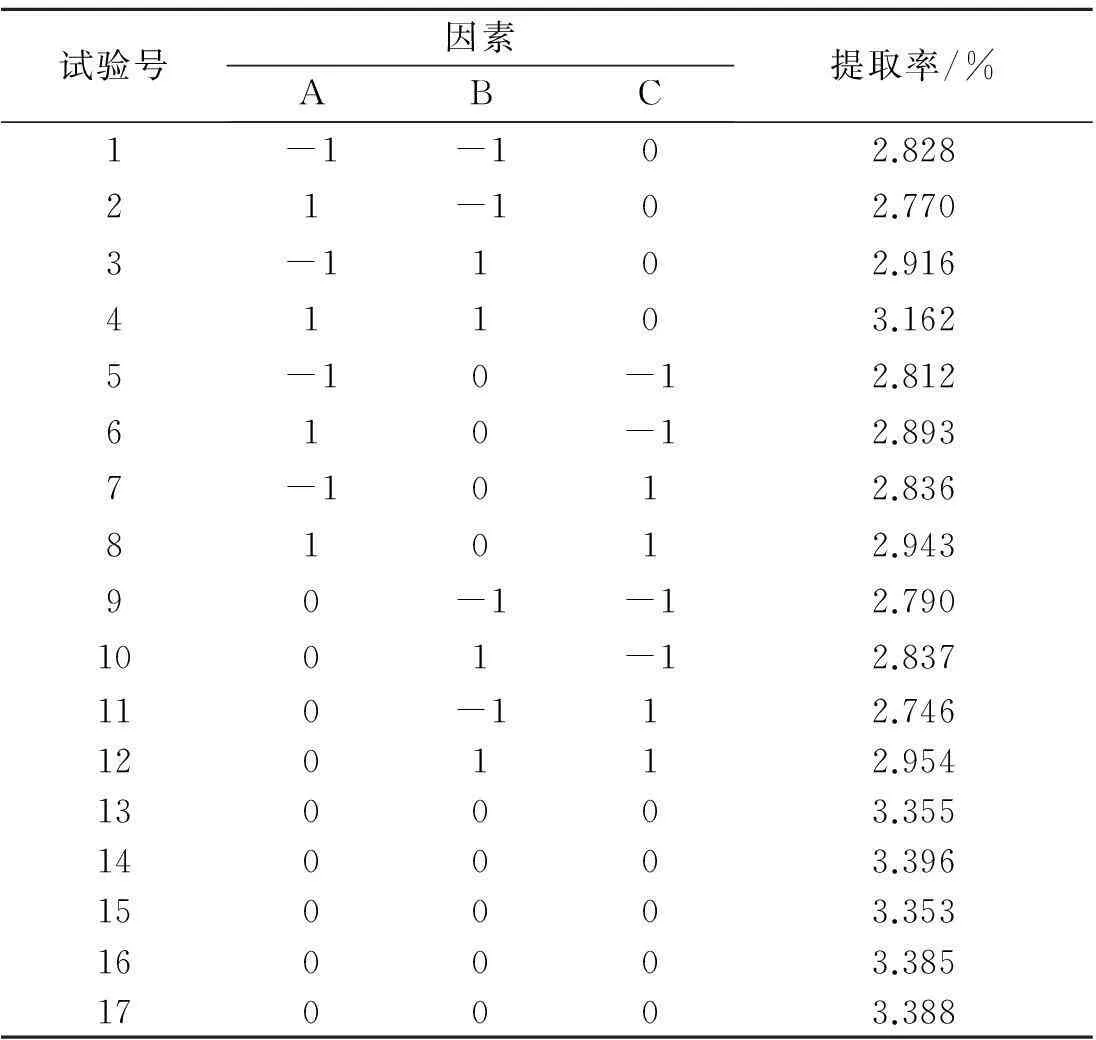
表3 响应面分析方案及试验结果
以3次实验所得猴头菌菌丝体中萜类物质提取率的平均值为响应值(Y),在实验设计与实验结果(表3)中, 其中试验号1~12是析因实验, 试验号13~17是中心实验, 用来估计实验误差.Y对表3进行二次回归响应面分析,建立多元二次响应面回归方程Y=-8.682 27+0.082 295X1+0.271 70X2+0.051 078X3-2.085 75×10-3X12-2.478 25×10-3X22-3.286 94×10-4X32+7.600 10-4X1X2+2.166 67×10-5X1X3+1.341 67×10-4X2X3,各因素的方差分析见表4.

表4 二次响应面回归模型方差分析
注:1) Prob>F.
回归方程也是高度显著的,相关系数R2=99.23%, 说明响应值(提取率)的变化有99.23%来源于所选变量, 即提取温度、料液比和提取时间.方差分析表明,方程模型极显著P<0.000 1,失拟项不显著P>0.05,表4说明方程拟合度良好,实验误差小,其他因素对结果的影响较小.
由表4可以看出:各因素中一次项X2是高度显著的, 其次是二次项X1X2.通过得出的模型,回流提取猴头菌菌丝体中萜类物质最优条件: 料液比1∶ 35.77 g/mL,提取温度T=63 ℃, 提取时间t=92.06 min,提取率3.35%.考虑到实际操作的便利,猴头菌菌丝体中萜类物质最佳提取工艺条件修正为料液比1∶ 36 g/mL,提取温度63 ℃,提取时间为92 min.为了验证模型的有效性,在修正条件下提取,试验重复3次验证,平均得率为3.39%,与理论预测值相比相对误差在1.2%左右.因此, 采用RSM法优化得到的回流提取条件参数准确可靠, 具有实用价值.
对于三个因素,选取其中一个为固定值时,其他两因素及其交互作用对吸光度影响的响应曲面及等高线图如图 6~8 所示.直观地反映了各因素对响应值的影响, 由等高线图可以看出存在极值的条件应该在圆心处.比较三组图可知:提取温度(X2)对猴头菌菌丝体中萜类物质提取率的影响最为显著, 表现为曲线较陡;而料液比(X1)与提取时间(X3)次之,现为曲线较为平滑, 且随其数值的增加或减少, 响应值变化较小.

图6 料液比和提取温度交互作用对提取率影响的响应面Fig.6 The response surface for the effect of cross-interaction between material liquid ratio and extraction temperature on yield of terpenoids substances from hericium erinaceum

图7 料液比和提取时间交互作用对提取率影响的响应面Fig.7 The response surface for the effect of cross-interaction between material liquid ratioand extraction time on yield of terpenoids substances from hericium erinaceum

图8 提取温度和提取时间交互作用对吸光度影响的响应面Fig.8 The response surface for the effect of cross-interaction between extraction temperature and extraction time on yield of terpenoids substances from hericium erinaceum
2.4猴头菌菌丝体萜类物质抗氧化性
2.4.1清除超氧阴离子自由基能力
由图9可知:萜类物质具有一定的抗氧化能力,但是在低质量浓度0.1~1.0 mg/mL与标准脂溶性抗氧化剂BHT、PG相比,它的抗氧化能力远远小于BHT和PG,随着质量浓度增加到1.5 mg/mL时,萜类物质对于超氧阴离子的清除能力已趋于和BHT、PG等标准抗氧化剂相同.猴头菌菌丝体萜类物质清除超氧阴离子的半数效应质量浓度EC50=0.926 mg/mL.
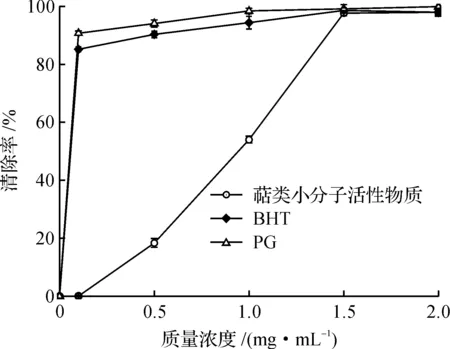
图9 萜类物质质量浓度、BHT与PG对超氧阴离子的清除率的比较Fig.9 Superoxide anion scavenging rate of terpenoids substances, BHT and PG under different concentrations
2.4.2清除DPPH·自由基的活力
由图10可知:萜类物质在低质量浓度0.1~1.5 mg/mL条件下,对于DPPH·自由基子的清除能力远远小于标准脂溶性抗氧化剂BHT和PG,随着质量浓度增加到2 mg/mL时,萜类物质对于DPPH·自由基的清除能力已和BHT、PG等标准抗氧化剂非常接近,可见猴头菌菌丝体萜类物质对DPPH·自由基的清除能力较强.猴头菌菌丝体萜类物质清除DPPH·自由基的半数效应质量浓度EC50=1.206 mg/mL.

图10 萜类物质、BHT与PG对DPPH·的清除率的比较Fig.10 DPPH scavenging rate of terpenoids substances, BHT and PG under different concentrations
2.4.3清除ABTS+·自由基的活
由图11可知:萜类物质在低质量浓度0.1~0.5 mg/mL条件下,对于ABTS+·自由基自由基子的清除能力远远小于标准脂溶性抗氧化剂BHT、PG,随着质量浓度增加到1~2 mg/mL时,萜类物质对于ABTS+·自由基的清除率达到80%左右,可见猴头菌菌丝体萜类物质对ABTS+·自由基有一定程度的清除能力.猴头菌菌丝体萜类物质清除ABTS+·自由基的半数效应质量浓度EC50=0.403 mg/mL.
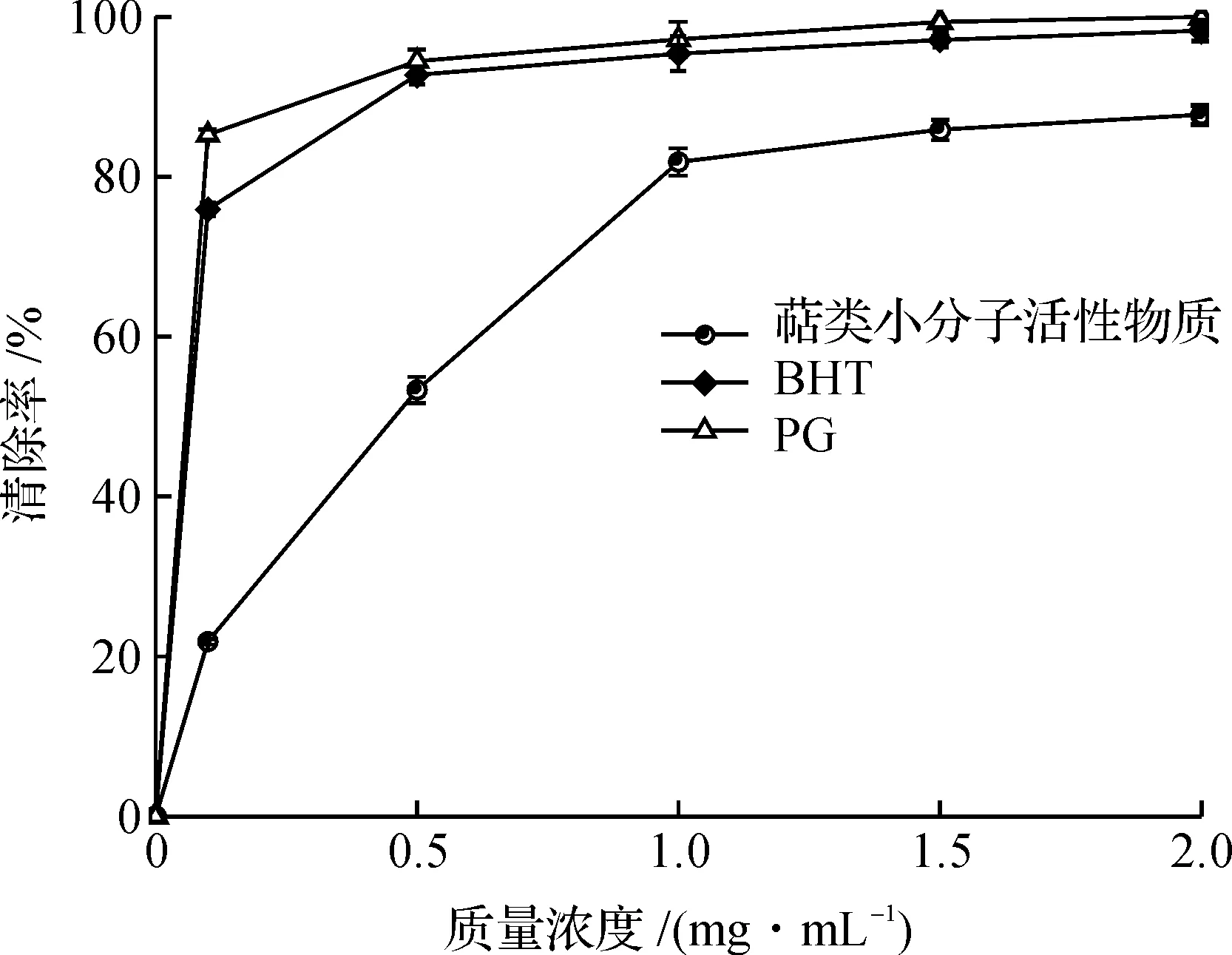
图11 萜类物质、BHT与PG对ABTS+·自由基的清除率的比较Fig.11 ABTS scavenging rate of terpenoids substances, BHT and PG under different concentrations
3结论
本实验通过对发酵品种猴头菌菌丝体中萜类物质的关键提取工艺技术的研究,可得出:利用纤维素酶水解和酸水解复合前处理可显著提高猴头菌菌丝体中萜类物质回流提取提取率.在单因素实验分析的基础上,进行料液比、温度和时间的三因素三水平响应面法(RSM)的回流提取工艺参数的优化研究,得出:经酶解和酸解复合处理后的猴头菌菌丝体再经乙醇回流提取,可使猴头菌菌丝体中萜类物质的提取率从1.80%显著提高到3.39%左右.猴头菌菌丝体中萜类物质提取工艺影响因素影响大小依次是提取温度>料液比>时间.其优化工艺条件:料液比1∶36 g/mL,提取温度63 ℃,提取时间为92 min.同时猴头菌菌丝体中萜类物质的抗氧化实验证明:随着萜类物质质量浓度的增大,其清除自由基的能力增强,其清除超氧阴离子的半数效应质量浓度EC50=0.926 mg/mL;清除DPPH·自由基的半数效应质量浓度EC50=1.206 mg/mL;清除ABTS+·自由基的半数效应质量浓度EC50=0.403 mg/mL.猴头菌菌丝体中萜类物质具有很高的营养和药用价值,提高猴头菌菌丝体中萜类物质提取率,将会使得资源得到充分利用和为猴头菌菌丝体中萜类物质的工业制备提供了发展前景.猴头菌菌丝体萜类物质表现出较好的抗氧化活性,可以作为一种天然抗氧化剂应用在食品和保健品工业中.
参考文献:
[1]袁胜东,罗霞,余梦瑶,等.猴头菌生物活性成分及药理作用研究进展[J].安徽农业科学,2011,39(15):8926-8928.
[2]李洁莉,邱建勇.猴头菌及其提取物有关甾醇类化合物初探[J].中国生化药物杂志,2001,22(3):124-126.
[3]王晓玉,蒋秋燕,凌沛学,等.猴头菌活性成分及药理作用研究进展[J].中国生化药物杂志,2010(1):70-72.
[4]张鹏,图力古尔,包海鹰.猴头菌属真菌化学成分及药理活性研究概述[J].菌物研究,2011,9(1):54-62.
[5]王鸿,潘超,周峰,等.海洋真菌Penicillium citrinum MNP 12010101代谢产物的分离鉴定和活性研究[J].浙江工业大学学报,2014,42(4):409-412.
[6]尚晓冬,王国艳,潘伟,等.猴头菌小分子活性成分研究进展[J].食用菌学报,2012,19(1):79-91.
[7]麻兵继,徐俊蕾,文春南,等.猴头菌子实体化学成分研究[J].天然产物研究与开发,2012,24(9):1165-1168.
[8]KAWAGISHI H, SHIMADA A, SHIRAI R, et al. Erinacines a, b and c, strong stimulators of nerve growth factor(NGF)-synthesis, from the mycelia of Hericium erinaceum[J]. Tetrahedron letters,1994,35(10):1569-1572.
[9]KAWAGISHI H, SHIMADA A, HOSOKAWA S, et al. Erinacines e, f, and g, stimulators of nerve growth factor(NGF)-synthesis, from the mycelia of Hericium erinaceum[J]. Tetrahedron letters,1996,37(41):7399-7402.
[10]KAWAGISHI H, MASUI A, TPOKOYAMA S, et al. Erinacines j and k from the mycelia of Hericium erinaceum[J]. Tetrahedron,2006,62(36):8463-8466.
[11]SAITOT, AOKI F, HIRAI H, et al. Erinacine e as a kappa opioid receptor agonist and its new analogs from a basidiomycete, Hericium ramosum[J]. The journal of antibiotics,1998,51(11):983-990.
[12]SHIMBO M, KAWAGISHI H, YOKOGOSHU H. Erinacine a increases catechola mine and nerve growth factor content in the central nervous system of rats[J]. Nutrition research,2005,25(6):617-623.
[13]路强强.猴头菌次生代谢产物及其生物活性研究[D].杨凌:西北农林科技大学,2013.
[14]姚乾元,贾元印.香草醛-浓硫酸薄层色谱显色剂的改进[J].中药通报,1986(7):25-47.
[15]刘海霞,赵雁武,王峰,等.植物甾醇中三萜类化合物的含量测定[J].食品工业科技,2008(6):280-283.
[16]邓韵,蔡妙颜,田野,等.溪黄草不同溶剂提取物中总二萜含量的测定[J].现代食品科技,2005,21(2):153-154.
[17]马凤森,刘丹,吴小娟,等.雷公藤总三萜测定的方法学比较研究[J].浙江工业大学学报,2015,43(3):293-297.
[18]杜永峰,周健,姚秉华.紫外分光光度法测定黄芩中黄芩苷的含量[J].化学分析计量,2008,17(5):43-45.
[19]成英,胡建平.紫外-可见分光光度法测定续随子种子中大环二萜类化合物[J].湖北农业科学,2013(4):927-928.
[20]徐大光,阴志刚,侯晓强,等.紫外-可见分光光度法在药物分析中的应用及进展[J].中国医学物理学杂志,2007,23(6):432-433.
[21]何荣军,赵月钧,赵瑞娜,等.海葵免疫活性多糖的闪式提取工艺研究[J].浙江工业大学学报,2015,43(4):389-392.
[22]邵芬娟,闫桂琴,张直峰,等.翅果油树叶片中总生物碱抗氧化活性研究[J].西北植物学报,2008,28(7):1339-1342.
[23]韩少华,朱靖博,王妍妍.邻苯三酚自氧化法测定抗氧化活性的方法研究[J].中国酿造,2009,28(6):155-157.
[24]朱玉昌,焦必宁.ABTS法体外测定果蔬类总抗氧化能力的研究进展[J].食品与发酵工业,2005,31(8):77-80.
(责任编辑:陈石平)
Extracting technology and antioxidant activity of terpenoids substances from Hericium erinaceum
HE Jinzhe, SHEN Qiang
(College of Ocean, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:In order to increase the yield of terpenoids substances from hericium erinaceum, we developed a new method for the extraction of terpenoids substances from Hericium erinaceum with fermentation which was pretreated with enzymatic and acid hydrolysis and then optimized by the method of ethyl alcohol reflux extraction through mono-factorial experiment and response surface methodology (RSM). The antioxidant activities were measured by the superoxide action for the scavenging capacity of both DPPH· and ABTS+· radicals. The pretreatment with enzymatic and acid hydrolysis can significantly help increase the extraction yield of terpenoids substances from Hericium erinaceum mycelia material. The optimum process parameters for extraction process were obtained: ethanol concent ration 65%, liquid material ratio 1∶36 g/mL, extracting temperature 63 ℃ and extracting time 92 min. The yield of substances from hericium erinaceum was increased to 3.39% from 1.80%. The terpenoids substances showed significant antioxidant activities. The EC50of superoxide action, DPPH· and ABTS+· were 0.926 mg/mL, 1.206 mg/mL and 0.403 mg/mL, respectively. This work can provide a new perspective on the extraction of terpenoids from Hericium erinaceum mycelia material and also has a potential industrial application.
Keywords:active small molecules terpenoids substances; enzymatic and acid hydrolysis; response surface analysis;antioxidant activity
收稿日期:2015-11-04
基金项目:国家863子项目(2014A,022205)
作者简介:何晋浙(1959—),女,浙江诸暨人,副教授,研究方向为天然产物的分离纯化、结构鉴定,E-mail:hjzgd@zjut.edu.cn.
中图分类号:Q819
文献标志码:A
文章编号:1006-4303(2016)03-0326-08
