度洛西汀中间体生物转化菌株研究
2016-06-29欧志敏杨根生
欧志敏,杨 策, 杨根生
(浙江工业大学 药学院,浙江 杭州 310014)
度洛西汀中间体生物转化菌株研究
欧志敏,杨策, 杨根生
(浙江工业大学 药学院,浙江 杭州 310014)
摘要:(S)-DHTP是合成抗抑郁药物度洛西汀的关键手性中间体,采用微生物土壤筛菌法从土壤中筛选得到一株能够将DKTP不对称地还原为(S)-DHTP的菌株,26S rDNA序列分析鉴定,该菌株属于假丝酵母属,命名为热带假丝酵母Candida tropicalis zjut 22.该菌株能够高效地还原DKTP生成度洛西汀关键手性中间体,底物转化率>90%,(S)-DHTP对映体过量值e.e.>99%,相比于化学法,生物转化合成反应条件更温和而且对环境的污染小.利用单因素和正交试验对其培养基进行优化,菌体干菌质量浓度可达14 g/L(菌体干重/发酵液体积).
关键词:度洛西汀;生物转化法;(S)-DHTP;热带假丝酵母
抑郁症以显著持久的心境低落为主要特征,属于一种情感性精神障碍的综合征,临床症状主要为情绪低落、躯体不适、思维迟钝等以至于产生自杀行为,其高发病率、高复发率和高自杀率严重困扰患者的生活质量和威胁社会和谐稳定[1].世界卫生组织(WHO)预测到2020年抑郁症将成为仅次于心脏病的第二大疾病[2].度洛西汀,其化学名称为(S)-N-甲基-3-(1-氧萘基)-3-(2-噻吩基)-1-丙胺,是一种可以双重抑制5-羟色胺和去甲肾上腺素再摄取作用的抗抑郁药[3].由美国礼来制药公司开发,于2004年被美国FDA批准首次上市并用于治疗严重抑郁症.目前发现不仅可以治疗抑郁症,还可用于治疗广泛性焦虑症、妇女应激尿失禁症以及糖尿病外周神经病性疼痛和纤维肌痛等神经病学相关疾病[4].度洛西汀耐受性和安全性较好,疗效确切显效快,用药方案简便,并且副反应少,其两种对映异构体中只有S型度洛西汀具有抗抑郁药理活性[5].(S)-N,N-二甲基-3-羟基-3-(2-噻吩基)丙胺((S)-DHTP)是合成抗抑郁症药物度洛西汀的重要中间体,采用微生物转化法合成手性药物中间体具有成本低廉、立体选择性好、环境友好等优点[6].本研究利用生物转化法生产度洛西汀中间体(S)-N,N-二甲基-3-羟基-3-(2-噻吩基)丙胺, 以N,N-二甲基-3-酮-3-(2-噻吩)-1-丙胺(DKTP)为底物, 筛选高效转化菌株,合成度洛西汀的关键中间体(S)-N,N-二甲基-3-羟基-3-(2-噻吩基)丙胺((S)-DHTP),进而优化菌种培养条件,为度洛西汀的合成开辟经济高效途径.
1材料与方法
1.1材料
初筛平板培养基:麦芽汁10 g/L,酵母粉3 g/L,蛋白胨5 g/L,琼脂20 g/L,苯乙酮1 mol/L(过滤除菌).
复筛液体培养基:酵母粉3 g/L,硫酸铵5 g/L,硫酸镁0.25 g/L,磷酸氢二钾1 g/L,磷酸二氢钾1 g/L,DKTP 1 mol/L(过滤除菌待培养一段时间后加入).
固体种子培养基:葡萄糖10 g/L,麦芽汁10 g/L,酵母粉3 g/L,蛋白胨5 g/L,琼脂20 g/L.
斜面保存培养基:葡萄糖10 g/L,麦芽汁10 g/L,酵母粉3 g/L,蛋白胨5 g/L,琼脂20 g/L.
主要化学试剂:DHTP外消旋体标准品、DKTP标准品,浙江九洲医药有限公司;乙腈、乙二胺等,华东医药股份有限公司;苯乙酮, 国药集团化学试剂有限公司.
1.2方法
1.2.1采集土样
土壤采集自浙江工业大学的校园,采集时, 铲去地表土层3~5 cm,取5~10 cm深层土样10 g,装入灭菌的牛皮纸袋,4 ℃保存.
1.2.2菌种筛选
初筛时将土壤稀释液均匀涂布到初筛平板培养基上,培养几天后,将初筛平板培养基上长出的颜色与形状不同的菌落分别接种至复筛液体培养基中进行复筛,培养12 h左右向复筛液体培养基中补加1 mol/L的DKTP[7].
1.2.3菌种鉴定
菌株经固体种子培养基接种培养后,交由上海生工生物工程公司测序进行菌种鉴定,通过邻接系统进化树进行分析.菌种鉴定实验过程如下:
1) 基因组DNA提取,按SK8257(酵母)试剂盒操作.
2) PCR扩增供试菌26S rDNA D1/D2 区域序列.
3) 凝胶电泳.1%琼脂糖电泳,150 V,100 mA,20 min电泳观察.
4) 纯化回收.PCR产物电泳条带切割所需DNA目的条带,按SK8131试剂盒方法纯化,PCR产物用PCR引物直接测序.
1.3培养条件优化
1.3.1单因素试验
将热带假丝酵母菌种Candidatropicaliszjut 22接种到液体种子培养基中培养24 h,得到其一级种子液.以10%的接种量接种种子液至大小为1 000 mL的三角摇瓶中,放入恒温振荡培养箱中二级发酵培养,三角摇瓶的装液量为其标定容量的60%.培养过程中保持恒温振荡摇床的温度30 ℃,转速120 r/min不变.分别按以下条件进行二级发酵培养实验:
1) 最佳碳源的选择:分别以葡萄糖、蔗糖、果糖、麦芽汁和淀粉作为二级液体培养基的碳源,质量浓度为30 g/L,其余培养基组份不变.
2) 优化碳源质量浓度:选择出最佳的碳源后,分别按5,10,20,30,40,50,60 g/L的碳源质量浓度进行优化,其余培养基组份不变.
3) 最佳氮源的选择:分别以5 g/L硫酸铵、磷酸二氢铵、磷酸氢二铵、尿素为无机氮源,其余培养基组份不变.
4) 优化氮源质量浓度:选择出最佳的氮源后,分别按5,10,15,20,25,30 g/L的氮源质量浓度进行优化,其余培养基组份不变.
5) 无机磷质量浓度的选择:在发酵培养基中分别控制磷酸氢二钾和磷酸二氢钾的质量浓度为1,2,4,6,8,10 g/L,其余培养条件不变.
Candidatropicaliszjut 22分别按上述方案,在恒温振荡摇床中培养24 h后,离心二级发酵液得到菌体测定干菌质量浓度.
1.3.2正交试验
将热带假丝酵母菌种Candidatropicaliszjut 22接种到液体种子培养基中培养24 h,得到其一级种子液.以10%的接种量接种种子液至大小为1 000 mL的三角摇瓶中,放入恒温振荡培养箱中进行二级发酵培养,按三角摇瓶标定容量的60%装液.培养过程中保持恒温振荡摇床的温度30 ℃,转速120 r/min不变.选择葡萄糖(A)、酵母粉(B)、磷酸盐(C)、硫酸铵(D) 4个因素,每个因素各选择4个不同的质量浓度水平,确定四因素四水平的正交表设计实验方案(表1)[8].
表1正交实验因素水平
Table 1Orthogonal experiment consisting of four factors and four levels

g/L
1.3.3测定方法
1) 底物和产物的分析方法
采用高效液相色谱(HPLC)分析,色谱条件:OD-H (5 μm) 0.46 mm×250 mm手性色谱柱,流动相用V(正己烷)∶V(乙醇)∶V(四氟乙酸)∶V(二乙胺)=95∶5∶0.2∶0.1,流速为1 mL/min,检测波长为240 nm[7].
2) 测定二级发酵液的湿菌质量浓度
将二级发酵液摇晃均匀,用吸量管吸取4 mL的发酵液样品放入离心管中,称重为W1.离心管配平后在台式离心机上以6 000 r/min的转速离心15 min,将发酵液样品离心后的上清液倒入另外的干净离心管中,称重为W2.计算湿菌质量浓度,其计算式为
C1= (W1-W2) ÷4×1 000
(1)
3) 测定发酵液的干菌质量浓度
将上述步骤离心管中所得的酵母泥,加入少量纯净水搅拌让菌体完全分散在水中后,倒入已知重量的坩埚中.将坩埚置于恒温干燥箱中,在135 ℃左右条件下干燥数小时至恒重,称重与坩埚重量之差为W.计算干菌质量浓度,其计算式为
C2= W/V
(2)
式中:C1为湿菌质量浓度,g/L; C2为干菌质量浓度,g/L;W为恒重后称量重量,g;V为样品的体积,L.
2结果与分析
2.1转化底物DKTP制备产物(S)-DHTP菌株的筛选
产物外消旋体标准品用高效液相色谱进行测定,由图1可知:标准品(S)-DHTP 出峰大约在24.33 min处,(R)-DHTP 出峰在35.06 min处.高效液相色谱检测筛选出的菌株对底物DKTP的转化能力和产物构型.由图2可知:(S)-DHTP 出峰在24.53 min处,DKTP出峰在40.39 min处.初筛平板培养基上有12株初始菌株长出,分别挑出经复筛液体培养基培养后,得到7株菌株.其中:命名为Candidautiliszjut 125,Candidapseudotropicaliszjut 114,Rhodotorulaqlutiniszjut 210,Candidafamatazjut 227四种菌株转化底物得到的产物为R型;命名为Candidapseudotropicaliszjut 102,Candidapseudotropicaliszjut 107的菌株转化底物所得产物构型为S型,但转化率与e.e.值均不高于40%.研究过程中筛选到一株对底物转化效果较好的菌株,该菌株可不对称转化底物DKTP成目的产物(S)-DHTP,e.e.值大于99%.分离纯化该菌株后送上海生工进行菌种鉴定.

图1 标准品的高效液相色谱图谱Fig.1 High performance liquid chromatography chart of standard sample

图2 供试菌株转化所得产物的高效液相色谱图谱Fig.2 HPLC chart of the product converted by isolated strain
2.2菌种鉴定
将供试菌株26S rDNA序列与NCBI数据库进行BLAST比对,发现该菌株序列与Candidatropicalis具有99%的同源性.根据BLAST同源性对比结果以及MEGA6.0软件分析计算,得到供试菌株的系统发育树,确定供试菌株在系统发育学上的地位.该菌株与其他种属酵母菌间的系统进化关系如系统进化树所示(图3),再结合供试菌卵圆形的细胞形状和边缘整齐、表面光滑平坦、粘稠湿润的菌落形态学特征,确定该菌株属于假丝酵母属,命名为Candidatropicaliszjut 22[9].

图3 供试菌株与酵母其他种属间的系统进化树Fig.3 Phylogenetic tree about isolated strain and other yeasts
2.3培养条件优化
选择不同的碳源、氮源种类及其质量浓度、无机磷质量浓度进行二级发酵实验,通过测定比较发酵液的干菌质量浓度,从而确定最佳的的培养基组份.
2.3.1单因素实验
1) 碳源种类和最佳质量浓度对Candidatropicaliszjut 22细胞生长的影响
不同微生物有着各自生长或产酶的最佳碳源,因此考察了培养基中碳源种类对提高菌体干菌质量浓度的影响.通过实验数据比较得出葡萄糖为较合适的碳源(图4),说明微生物Candidatropicaliszjut 22能够优先利用单糖——葡萄糖进行生长,采用葡萄糖为碳源可以获得较高的菌体质量浓度.选择葡萄糖为最佳碳源,改变其质量浓度,进一步研究有利于Candidatropicaliszjut 22生长的最佳葡萄糖质量浓度,图5结果表明30 g/L葡萄糖为最佳碳源质量浓度.
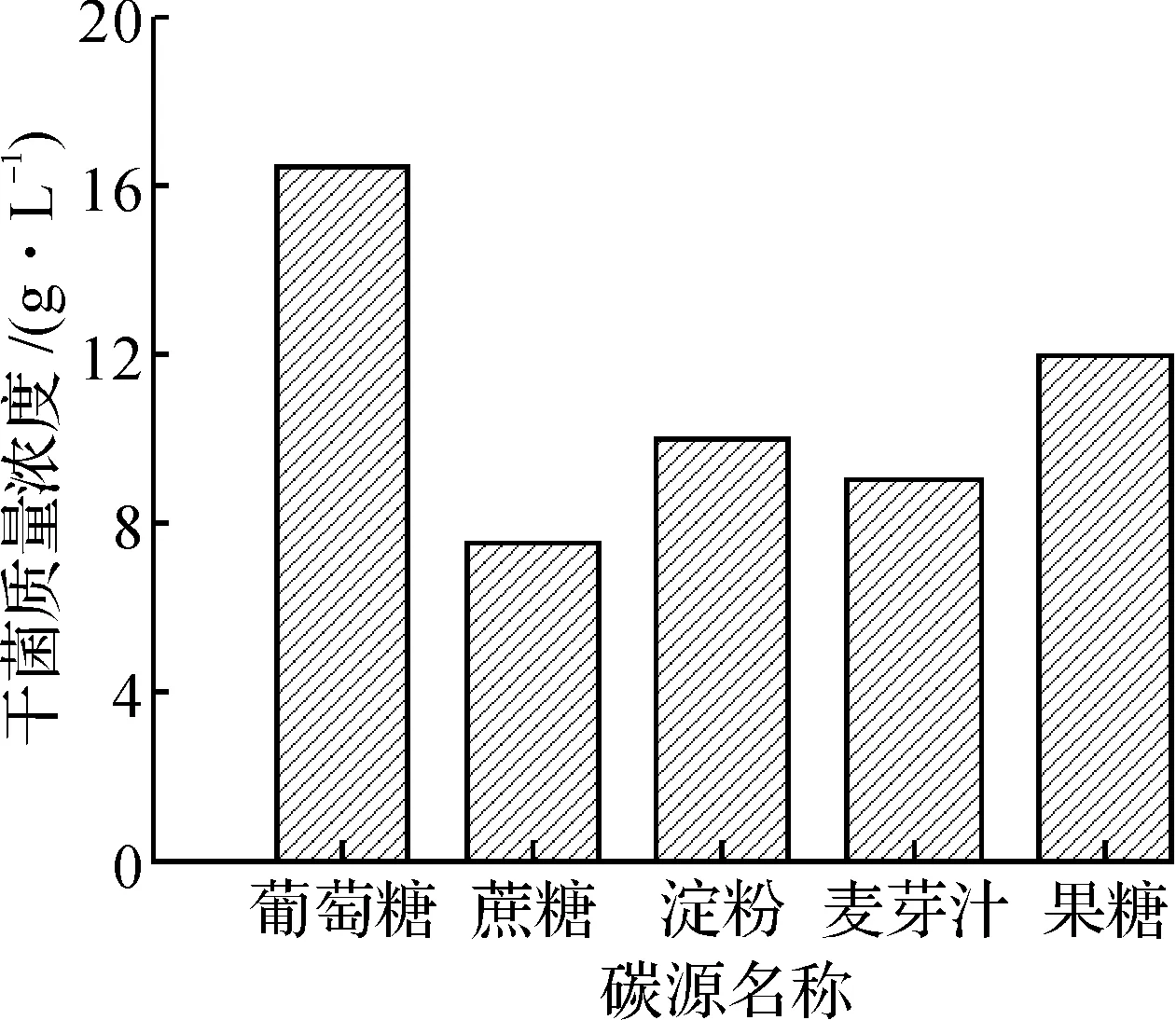
图4 碳源种类对菌体生长的影响Fig.4 Effect of different carbon on cell growth
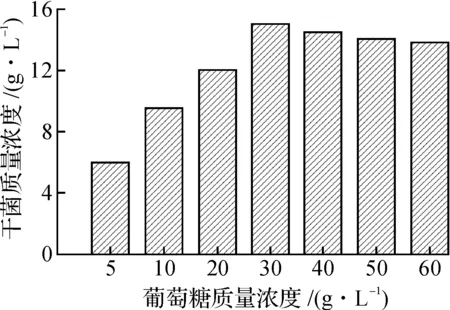
图5 葡萄糖的质量浓度对菌体生长的影响Fig.5 Effect of glucose concentration on cell growth
2) 氮源的种类和质量浓度对Candidatropicaliszjut 22生长的影响
氮源是微生物生长代谢和生物合成的第二大物质和必不可少的营养源,可以为菌体代谢生长和RNA积累提供必需的氨基酸和核苷前体.不同种类的氮源对微生物细胞的生长有很大差别,因此考察了培养基中不同氮源对菌体干菌质量浓度的影响.图6显示不同种类的氮源对细胞生长的影响显著不同,速效氮源硫酸铵为最佳的氮源.硫酸铵质量浓度对细胞生长的影响如图7所示,5 g/L的硫酸铵为最佳氮源质量浓度[10].
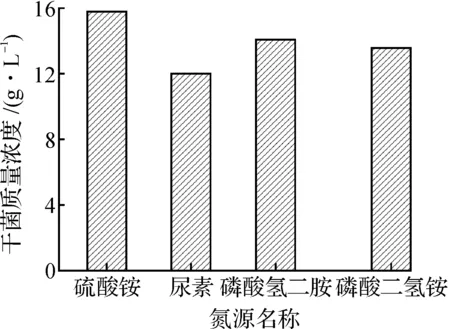
图6 氮源种类对菌体生长的影响Fig.6 Effect of different nitrogen source on cell growth

图7 硫酸铵质量浓度对菌体生长的影响Fig.7 Effect of (NH4)2SO4 concentration on cell growth
3) 无机磷质量浓度的选择
磷酸盐是菌体生长的主要限制营养成分,对菌体生长阶段的细胞内碱性磷酸酶活力,丙酮酸质量浓度,糖类底物的代谢和发酵液的pH值有着一定程度的影响,它的质量浓度调节是控制次级代谢产物合成的重要手段.低质量浓度的磷酸盐可以促进菌体的生长,随着磷酸盐质量浓度的提高,会产生饱和作用,并对菌体的生长产生抑制作用.通过实验数据比较得到不同磷酸氢二钾与磷酸二氢钾质量浓度对菌体生长的影响,选择2 g/L为较适宜无机磷质量浓度(图8).
2.3.2正交实验对菌体质量浓度和转化率的影响
通过选择葡萄糖(A)、酵母粉(B)、磷酸盐(C)、硫酸铵(D)4个因素,分别以4个不同质量浓度水平确定四因素四水平正交表进行实验,结果如表2所示.
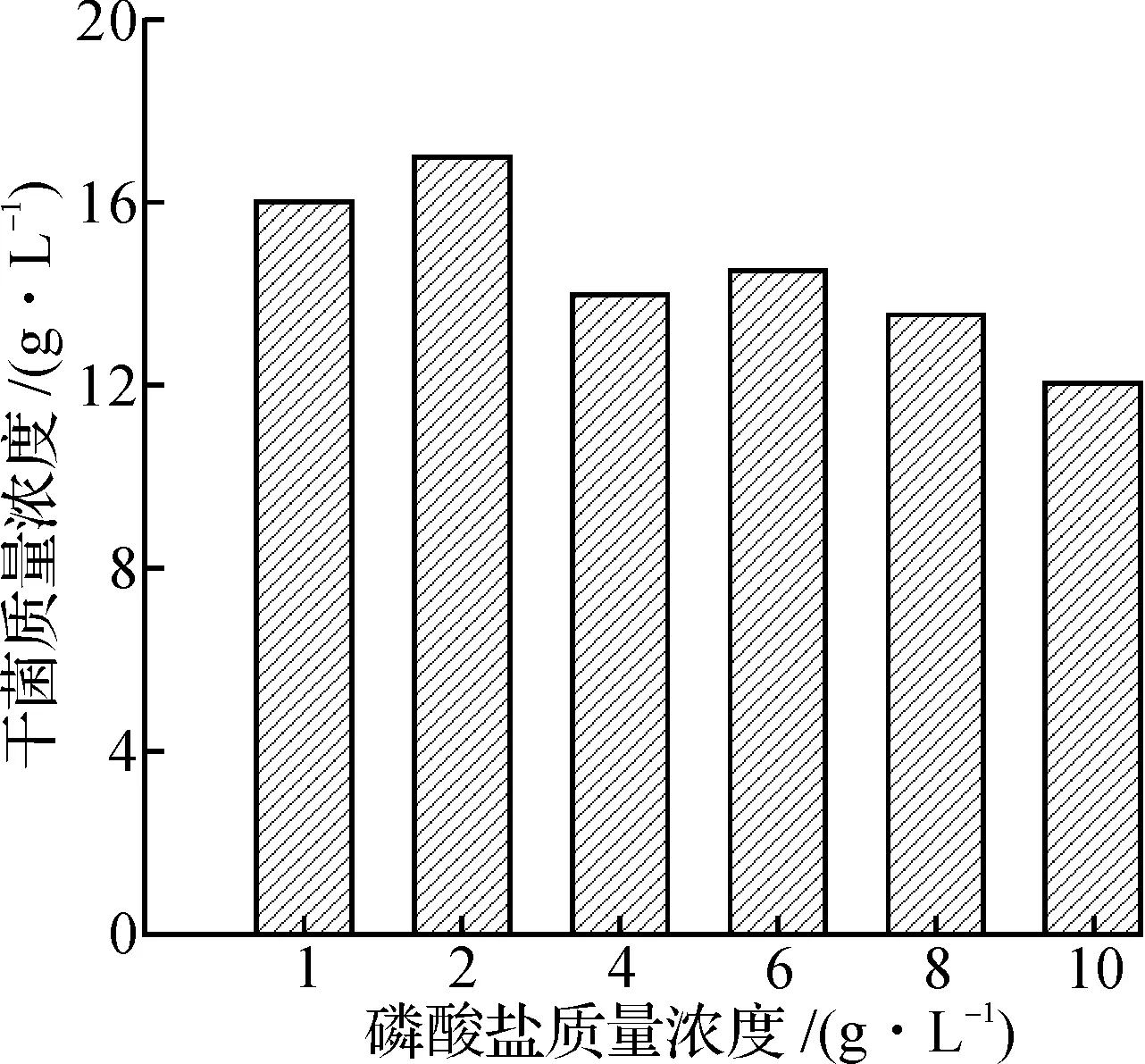
图8 不同磷酸盐浓度对菌体生长的影响Fig.8 Effect of phosphate concentration on cell growth

实验编号因素水平ABCD实验结果转化率/%干菌质量浓度/(g·L-1)1111178.6110.842122283.4611.363133389.6212.244144481.2211.565212376.3111.456221483.0412.857234194.4216.368243282.8914.029313472.829.8510324376.8910.0311331275.885.8212342183.248.6313414273.545.9214423180.556.6115432470.346.7816441375.926.43
正交实验结果分析(表3)中,K1,K2,K3,K4分别为各因素对应列上1,2,3,4水平效应考察的综合平均值,各因素中4个不同水平对干菌质量浓度和底物转化率影响的大小由相应的K值大小反映.R是极差,值为同一因素中最大K值与最小K值之差,各因素对干菌质量浓度和底物转化率的影响主次由极差的大小判断,R值的大小表明相应因素对实验结果的影响程度,R值越大,则相应因素对实验结果的影响越大,反之亦然.比较各因素下极差值R的大小,可以得到影响菌体干菌质量浓度的因素主次顺序为:葡萄糖>磷酸盐>硫酸铵>酵母粉.影响菌体对底物转化率的因素主次顺序为:葡萄糖>硫酸铵>酵母粉>磷酸盐.分析结果表明,在得到较高菌体质量浓度的培养条件下,相应也能得到较高的转化率.菌体的最佳培养条件为A2B3C4D1,即最优的培养基配比为:碳源葡萄糖30 g/L,氮源硫酸铵5 g/L,酵母粉10 g/L,磷酸二氢钾4 g/L,磷酸氢二钾4 g/L.菌种二级发酵液在恒温振荡培养箱中,120 r/min转速和30 ℃温度条件下培养36 h,菌体对底物的转化率可达到90%左右,菌体的干菌质量浓度可以达到14 g/L以上[11].

表3 正交实验结果分析
3结论
本研究筛选得到一株假丝酵母Candidatropicaliszjut 22,该菌株能不对称还原底物DKTP生成手性药物度洛西汀的关键中间体(S)-DHTP,具有高转化率和较好的对映体过剩值(转化率>95%,e.e.>99%).使微生物转化法生产度洛西汀手性中间体变得经济可行.通过单因素试验,确定了适合所筛假丝酵母菌株Candidatropicaliszjut 22菌体生长的液体培养基中最佳碳源、氮源以及无机盐的组份和质量浓度.然后通过正交试验法优化了培养基中各组份的配比,从而确定了最优液体培养基组成.10%接种量下,接种菌种在恒温振荡培养箱中,在120 r/min和30 ℃的条件下摇瓶培养36 h,菌体对底物的转化率可达到90%左右,可以得到14 g/L以上的菌体干菌质量浓度.本研究为进一步将Candidatropicaliszjut 22应用于DKTP的不对称转化合成度洛西汀关键手性中间体(S)-DHTP奠定基础.
参考文献:
[1]童凌斐.酶法合成西汀类手性中间体及其最佳反应参数的研究[D].武汉:华中科技大学,2010.
[2]国效峰,赵靖平,陈晋东.度洛西汀:一种新型抗抑郁药[J].中国新药与临床杂志,2006,25(7):552-554.
[3]薛瑞,徐晓丹,李诺敏,等.度洛西汀抗抑郁活性评价及毒性研究[J].中国药理学通报,2010,26(11):1471-1475.
[4]李龙,邱贵森,蒋泰龙,等.化学酶法合成盐酸度洛西汀的研究进展[J].化工进展,2014,33(7):1839-1842.
[5]何山震.手性抗抑郁药物度洛西汀的合成研究[D].广州:中山大学,2008.
[6]杨凤萍,许善峰,沈云霞,等.微生物转化法生产度洛西汀中间体手性醇菌株的鉴定[J].微生物学通报,2012,39(2):211-218.
[7]SONI P, BANERJEE UC. Biotransformations for the production of the chiral drug (S)-Duloxetine catalyzed by a novel isolate of Candida tropicalis[J].Biotechnologically relevant enzymes and proteins,2005,67:771-777.
[8]张立涛.热带假丝酵母高产核糖核酸的连续发酵及提取纯化工艺研究[D].济南:山东大学,2013.
[9]马云,吴立飞,陈连升,等.对氟肉桂酸降解菌株HZW-3的分离鉴定和初步特性研究[J].浙江工业大学学报,2013,41(5):478-481.
[10]梅建凤,金航,李靓,等.生物转化法提高积雪草中积雪草酸的质量分数[J].浙江工业大学学报,2015,43(5):573-577.
[11]马云,洪骏.尼古丁降解菌株HZN7的最佳生长条件及土壤中降解特性[J].浙江工业大学学报,2015,43(5):537-542.
(责任编辑:刘岩)
Screening, identification and cultivation of microorganisms for preparation of duloxetine chiral intermediate
OU Zhimin, YANG Ce, YANG Gensheng
(College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:(S)-DHTP is key chiral intermediate for synthesis of duloxetine. A biotransformation method was used to screen fungus from soil in order to obtain a fungus capable of reducing N,N-dimethyl-3-keto-3-(2-thienyl)-1-propanamine (DKTP) to (S)-DHTP, a key precursor to synthesize duloxetine. A fungus was obtained which was capable of asymmetrically reduce DKTP to (S)-DHTP with high yield (more than 90%) and high enantiometric excess (more than 99%). The DNA sequence of 26S rDNA identification showed that the fungus belong to the Genus of Candida, and was named as Candida tropicalis zjut 22. The screened fungus could efficiently and asymmetrically reduce DKTP to (S)-DHTP. Compared with the chemical method, the reaction conditions of the microbial transformation are mild and environmentally friendly. The medium content was optimized by Univariate Orthogona and Orthogonal experimental analysis. The concentration of cells can reach up to 14 g/L (cell dry weight/volume of fermentation).
Keywords:duloxetine;biotransformation;(S)-DHTP;Candida tropicalis
收稿日期:2015-11-23
基金项目:浙江省自然科学基金资助项目(LY15B060005)
作者简介:欧志敏(1973—),女,辽宁铁岭人,教授,博士,研究方向为生化制药和酶工程,E-mail:oozzmm@zjut.edu.cn.
中图分类号:R971.43
文献标志码:A
文章编号:1006-4303(2016)03-0340-06
