拟除虫菊酯对斑马鱼氧化代谢相关基因表达影响
2016-06-29洪盼盼赵美蓉
杜 洁,张 怡,洪盼盼,赵美蓉
(浙江工业大学 环境学院,浙江 杭州 310014)
拟除虫菊酯对斑马鱼氧化代谢相关基因表达影响
杜洁,张怡,洪盼盼,赵美蓉
(浙江工业大学 环境学院,浙江 杭州 310014)
摘要:研究选取两种典型的拟除虫菊酯类农药——氯菊酯(PM,Ⅰ型)和高效氯氟氰菊酯(LCT,Ⅱ型),测定了药物暴露后斑马鱼肾脏中氧化代谢相关的三大类核受体基因的mRNA表达水平:芳香烃受体(AhR)、过氧化物增殖物酶体激活酶受体(PPAR)和孕烷X受体(PXR).结果表明:LCT暴露可导致AhR2,PPARα和PXR上调, PM暴露则导致AhR1a和PXR表达的上调;两种农药暴露均导致AhR1b下调;LCT在高质量浓度下对基因的影响更强,PM在环境暴露质量浓度下可产生一定效应.研究表明了LCT和PM对水生生态系统均存在生态风险,进一步揭示了拟除虫菊酯类农药的毒性作用机制,为其生态安全及环境健康风险评估提供理论依据.
关键词:斑马鱼;拟除虫菊酯类农药;高效氯氟氰菊酯;氯菊酯
拟除虫菊酯类农药具有广谱、低残留、高效、中等毒性和能生物降解等特性,已经成为替代高毒有机磷杀虫剂农药的第二大杀虫剂[1-2].到目前为止,全球销售额上亿美元的菊酯类杀虫剂占全球市场比例20%,使用面积占整个杀虫剂的25%[3].这些拟除虫菊酯类农药虽然对哺乳动物是低毒的,但有对水生生物高毒性的缺点[1,4].最终进入自然水体环境中的菊酯农药绝大部分会吸附在悬浮固体及颗粒物上,这可能将延长其半衰期,增加天然水体中菊酯类农药对水生生物的生态风险[5].肾脏主要功能之一是清除体内代谢产物及外源性化学物质,在维持机体内环境稳定方面发挥着重要的功能,芳香烃受体(Aryl hydrocarbon receptor, AhR)、过氧化物酶体增殖物激活酶受体α(Peroxisome proliferators-activated receptor alpha, PPARα)、孕烷X受体(Pregnane X receptor, PXR)作为氧化代谢相关的重要受体基因均在肾脏中大量表达.Ghisari等指出,Hepa1.12cR细胞暴露在氯氰菊酯下将会影响其芳香烃受体(AhR)的功能[6].而Takeuchi等研究却提出,十二种拟除虫菊酯类农药并未发现对AhR的效应,但除虫菊酯在体外实验和体内实验里对PPARα均有明显的激动效应[7].Abass等亦发现拟除虫菊酯类农药能有效的激活人类PXR表达[8].
目前,对拟除虫菊酯类农药已有大量的研究,大部分集中在其对生殖影响及毒性机制的研究上[9],而对于其导致的代谢应激相关的基因表达变化的研究还有待完善.尤其是对于两类拟除虫菊酯类农药对这三大类核受体基因表达影响的对比的相关研究较少.近年来,斑马鱼作为模式生物被越来越多的应用于脊椎动物的生长发育以及基因研究,并且广泛用于药品安全评估[10].实验选取两种具有典型代表的拟除虫菊酯类农药:氯菊酯(PM,Ⅰ型拟除虫菊酯)和高效氯氟氰菊酯(LCT,Ⅱ型拟除虫菊酯),以斑马鱼成鱼为实验对象进行毒性暴露实验,研究两种农药对斑马鱼肾脏中与氧化相关的三大核受体基因的表达变化情况,分析其作用机制,帮助完善拟除虫菊酯类农药的毒性作用机制研究,推进其生态安全及环境健康风险评估发展,为政府制定合理的拟除虫菊酯类农药环境风险管理措施提供科学依据和数据支持.
1实验材料和方法
1.1实验试剂和器材
试剂:高效氯氟氰菊酯(Lambda-cyhalothrin, LCT, CAS No. 91465-08-6)和氯菊酯(Permethrin,PM,CAS No. 52645-53-1)标准品购自德国Dr.Ehrensorfer公司;DMSO(二甲基亚砜,CAS No. 67-68-5)购自Sigma-Aldrich公司,作为标准品储备液的溶解剂使用;Trizol试剂购自ambion公司(USA),氯仿、异丙醇、乙醇均为分析纯或色谱纯试剂;无酶水(RNase-free water);反转录试剂盒(ReverTra Ace qPCR PT Kit,Code No. FSQ-101)和qRT-PCR试剂盒(SYBR® Realtime PCR Master Mix,Code No.QPK-201)均购自TOYOBO公司(Japan).
器材:实验暴露鱼缸(5 L);水质过滤器、曝氧器、水温加热棒;解剖镊、解剖针、解剖剪;倒置立体显微镜(Nikon ECLIPSE Ti-S, Nikon DIGITAL SIGHT DS-U3, Japan);超细匀浆器(FLUKO® Superfine Homogenizers F6/10,上海);超微量紫外可见分光光度计ND5000 (BioTeke, Beijing, China);ABI-7300 RT-PCR仪 (Applied Biosystems 7300 Real-Time PCR System, USA);1.5 mL RNase-free离心管;MicroAmp® Optical 8-Tube Strip 和MicroAmp® Optical 8-Cap Strip.
1.2实验动物
实验使用模式生物——斑马鱼AB品系,实验用成鱼购买后经驯化备用(驯化期超过一周).实验用养殖水为除氯曝氧饮用水(含氧量大于80%),养殖水经循环过滤曝氧并每周更换.控制14 h光照/10 h黑暗条件,水温27~30 ℃,每日投喂2~3次.养殖方法参照OECD (1992)及FISH EMBRYO TOXICITY ASSAYS (Lammer 2006).
1.3暴露实验及样品前处理
选取驯化后状态良好的斑马鱼成鱼,随机挑取10条成鱼放置在每个实验暴露鱼缸中.暴露时间为一周.设定两种药物实验组质量浓度均为空白,0.1,0.25,0.5,1.0 μg /L,每个实验组设置三个平行.暴露结束后,每缸随机选取4条暴露一周之后的斑马鱼进行活体解剖,取出每条斑马鱼肾脏,并分别编号保存于-80 ℃以备后续实验使用.
1.4qRT-PCR 分析
取出冻存的组织样品,置于冰上,分别用Trizol试剂按照产品说明书提取总RNA.提取RNA前,组织先用超细匀浆器低温匀浆.提取的总RNA检测质量后使用反转录试剂盒获得cDNA,低温保存用于qRT-PCR基因分析.相关基因的表达按照qRT-PCR试剂盒说明书指导在ABI-7300 qRT-PCR仪上检测完成.PCR反应引物序列经NCBI(http://www.ncbi.nlm.nih.gov/)查询验证获得,如表1所示.使用β-actin在实验中作为确定目标基因相对表达量的管家基因.

表1 基因引物序列
1.5数据分析
数据分析使用统计学软件SPSS 19.0和Origin 8.0进行统计分析并作图,所有数据均以平均值± SE(标准误)表示,利用T值检验和单因素方差分析用于对照组和实验组的显著性分析,当P<0.05时认为具有显著性差异,以*标注显示.
2结果与分析
2.1对芳香烃受体(AhR) 基因表达的影响
作为一种配体诱导的转录因子,AhR不仅可以在免疫系统发挥重要功能,还可以作为各种环境毒素(多环芳烃类化合物)的受体介导毒性反应,参与辐射、感染、炎症和氧化应激等应激刺激,介导多种细胞毒性反应和重要的生物学过程,如信号转导、细胞分化、细胞凋亡、肿瘤演进、生长发育和再生等.为更深入的研究对比Ⅰ型和Ⅱ型拟除虫菊酯类农药对AhR的影响,对AhR家族的三个亚型AhR1a,AhR1b,AhR2分别进行了研究.将两种类型的拟除虫菊酯类农药暴露后对斑马鱼成鱼体内AhR表达情况进行对比,结果如图1所示.
从图1可以看到:图1(a)中,两种拟除虫菊酯类农药在高质量浓度均导致了AhR1a表达的变化,而且其作用是相反的.LCT暴露导致AhR1a表达变化了1.18倍,0.73倍,0.49倍,分别在0.25,0.5,1.0 μg/L;PM暴露则导致AhR1a表达上调1.25倍和1.44倍,分别在0.5 μg/L和1.0 μg/L;图1(b)中,LCT高质量浓度暴露组AhR1b表达下调0.72倍和0.50倍,分别在0.5 μg/L和1.0 μg/L;而PM暴露并没有明显的影响AhR1b mRNA水平的变化;图1(c)中,LCT暴露后AhR2表达上调1.27倍和0.37倍,分别在0.5 μg/L和1.0 μg/L;PM暴露组则在0.25 μg/L暴露后AhR2表达上调了1.33倍,其他质量浓度暴露并无明显变化.
综合以上结果,Ⅰ型和Ⅱ型拟除虫菊酯类农药对斑马鱼体内AhR mRNA水平的影响的作用机制和效应水平都是不同的.LCT暴露可能会抑制AhR1a和AhR1b基因的表达,却能使AhR2基因的表达轻微上调;PM暴露则可能主要是通过对AhR1a基因表达的上调进而影响斑马鱼体内生物进程.AhR1a曾被认为是非功能性的受体[11],但Goodale等[12]研究指出在体内AhR1a具有不同于AhR2途径的对CYP1A表达的独立调控,尽管作用机制仍有待阐明.这也解释了拟除虫菊酯类农药对AhR的影响可能因为其类型不同而产生不同的作用机制及结果.

图1 LCT和PM暴露后斑马鱼体内AhR mRNA水平变化情况Fig.1 The AhR mRNA level change in zebrafish after exposure to LCT and PM
2.2对过氧化物酶体增殖物激活酶受体(PPAR)基因表达的影响
PPARα是细胞核受体超家族PPARs家族的三大亚型之一.激活PPARα可以对很多缺血再灌注损伤的器官提供保护作用,其参与细胞凋亡的调节,可能与抑制氧化应激和炎症反应及增强肝脏抗氧化能力有关.将两种类型的拟除虫菊酯类农药暴露后对斑马鱼成鱼体内PPARα表达情况进行对比,结果如图2所示.

图2 LCT和PM暴露后斑马鱼体内PPARα mRNA水平变化情况Fig.2 The PPARα mRNA level change in zebrafish after exposure to LCT and PM
图2中,LCT高质量浓度暴露组PPARα表达上调1.61倍和1.81倍,分别在0.5 μg/L和1.0 μg/L.PM暴露后PPARα表达上调1.20倍和1.14倍,分别在在0.1 μg/L和0.25 μg/L;其中,在1.0 μg/L PM暴露后斑马鱼体内PPARα表达下调0.80 倍.
结果显示:LCT可能是作为斑马鱼体内PPARα的激动剂导致PPARα基因表达的上调.Gohlke等认为,拟除虫菊酯类农药通过包括PPAR在内的信号通道而表现出其潜在内分泌干扰物的代谢综合[13].Takeuchi等亦指出拟除虫菊酯类农药可能在体外实验中成为PPARα的体外激活剂[14],因此,LCT暴露可能能引起斑马鱼体内的应激反应.有研究指出,PPARα能够影响卵巢中芳香化酶mRNA的表达水平,进一步影响雌激素的合成[15-16],因此,研究结果中LCT暴露导致PPARα表达的变化可能会进而影响性激素水平,而Ratnasooriya 等[17]研究亦发现LCT可能通过多重机制而导致雄鼠的性功能紊乱.相较之下,PM暴露对斑马鱼体内PPARα mRNA水平在低质量浓度时有轻微的上调作用,而高质量浓度暴露下则出现轻微的抑制表达,这表明PM对PPARα表达的影响较小,而且PM对PPARα表达影响可能有低质量浓度促进高质量浓度抑制的作用.这可能也间接解释了Oberoi等[18]研究表示PM没有氧化应激效应,而Turkez等[19]研究却显示PM能够诱导产生氧化应激效应.
2.3对孕烷X受体(PXR)基因表达的影响
作为“最主要的异物感受器”,在大多数情况下,PXR 通过促进药物代谢酶和药物转运蛋白的表达来应对药物与其他外来化学物质,进而影响它们的生物转化率并将其清除出体外.PXR调节CYP3A4酶的表达和活性的最关键的核受体之一,在被大量不同化学结构的配体激活后,对于CYP3A4具有显著的抑制或诱导作用,从而使机体免受毒害.将两种类型的拟除虫菊酯类农药暴露后对斑马鱼成鱼体内PXR表达情况进行对比,结果如图2所示.
由图3可知:LCT暴露和PM暴露均在不同程度上导致了PXR mRNA水平的上升,其中LCT暴露组中PXR表达上调1.40倍,1.47倍,2.33倍,分别在0.25,0.5,1.0 μg/L;PM暴露后PXR表达上调1.18倍,1.21倍,1.38倍,分别在0.1,0.25,1.0 μg/L.
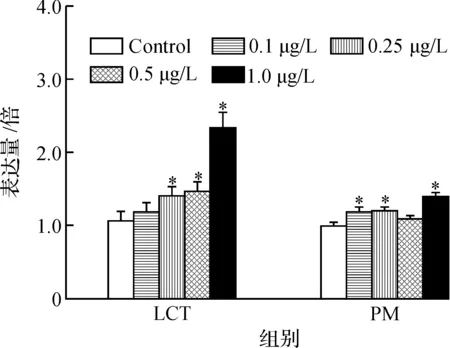
图3 LCT和PM暴露后斑马鱼体内PXR mRNA水平变化情况Fig.3 The PXR mRNA level change in zebrafish after exposure to LCT and PM
众所周知,PXR通过CYP3A和CYP2B感应外源性物质的氧化代谢[20].Kojima等研究发现,十二种拟除虫菊酯类农药均引导产生人和鼠的孕烷X受体(PXR)的激动效应[21].Shi 等[22]研究亦指出高效氰戊菊酯作为PXR配体与地塞米松对诱导CYP3A23的表达具有协同作用.Lemaire等[23]研究发现拟除虫菊酯类农药(氯氰菊酯和氰戊菊酯)可能通过诱导CYP3A4和 CYP2B6引起hPXR的激动活性.Yang[24]等进一步研究指出,在人的肝细胞中,除胺菊酯外,所有拟除虫菊酯类农药均能显著诱导CYP3A4表达;但不同物种的PXR目标基因对不同的拟除虫菊酯类农药的诱导感应程度也是不同的,例如, rPXR和hPXR(变异型)对功夫菊酯的响应和hPXR(野生型)不同.而该研究中功夫菊酯的诱导效应明显强于氯菊酯也与研究结果相一致.
2.4两种拟除虫菊酯类农药对斑马鱼体内代谢影响
将Ⅰ型和Ⅱ型拟除虫菊酯类农药对斑马鱼体内氧化代谢基因水平的影响进行整合,如图4所示.从两种农药对斑马鱼体内氧化代谢主要相关基因中的5个基因可以看出:LCT主要通过AhR1a,AhR1b,PPARα,PXR对斑马鱼体内的代谢产生影响,而其中PXR对LCT最为敏感,即使是低质量浓度其基因表达水平也产生了变化;PM则主要通过AhR1a和PXR对斑马鱼体内代谢产生影响,并且这两个核受体基因表达在低质量浓度时也均产生变化.不同配体、受体与不同化学物质的亲和度存在差异,这些研究结果可能与两种拟除虫菊酯类农药与相关的配体、受体的亲和度有所差异关,最终可能导致出现不同的内分泌干扰效应.对比两个农药的作用情况可以看到,LCT的效应明显大于PM,与Soderlund等的研究结果一致[25].这可能与其结构中的α-氰基增加了其毒性有关,也可能与LCT比PM在生物体内滞留期更长有关[26].
已有研究发现,自然水体中LCT的质量浓度可达到0.3 μg /L,PM可达到0.4 μg /L[27-28];河流底泥内LCT的质量浓度可达到58.7 ng /g,PM可达到91.4 ng /g[29].研究发现PM的效应虽然较LCT较小,但其在接近环境质量浓度时就有一定的作用,而LCT在高质量浓度的效应才更加明显.而PM在水中的半衰期较LCT要长的多,这表明相较于LCT,PM虽然对水生生物毒性较低但其潜在危害依旧很大,而LCT的危害与其质量浓度及接触时间有关.

图4 基因表达对比分析Fig.4 The contrast analysis of genes expression
3结论
LCT和PM暴露均对斑马鱼体内AhR,PPAR,PXR三大氧化代谢相关核受体基因表达产生影响.两种拟除虫菊酯类菊酯类农药的基因毒性大小为LCT大于PM,这可能与其结构及生物体内代谢及残留时间有关.此外,在高质量浓度暴露斑马鱼时,LCT效应大于PM,而PM即使是在低质量浓度也能产生一定的影响,尽管效应较低可能未必对斑马鱼机体功能产生影响.研究中使用的质量浓度接近自然环境水体中的农药质量浓度,这表明PM虽然毒性较低,但对水生生物依旧存在较大的生态风险,而且拟除虫菊酯类农药易于吸附于底泥延长了其半衰期并能够持续不断的向水体释放,这将进一步增加LCT和PM对水生生物体内造成持久性的残留毒性,增加其水生生态环境风险.
参考文献:
[1]TU W Q, XU C, LU B, et al. Acute exposure to synthetic pyrethroids causes bioconcentration and disruption of the hypothalamus-pituitary-thyroid axis in zebrafish embryos[J]. Science of the total environment,2016,542:876-885.
[2]SCOTT J G, YOSHIMIZU M H, KASAI S. Pyrethroid resistance in Culex pipiens mosquitoes[J]. Pesticide biochemistry and physiology,2015,120:68-76.
[3]华乃震.拟除虫菊酯农药的进展和趋向[J].农药市场信息,2015,30:26-28.
[4]XIAO T T, SHI X Z, JIAO H F, et al. Selective and sensitive determination of cypermethrin in fish via enzyme-linked immunosorbent assay-like method based on molecularly imprinted artificial antibody-quantum dot optosensing materials[J]. Biosensors & bioelectronics,2016,75:34-40.
[5]LIU W P, GAN J Y, SCHLENK D, et al. Enantioselectivity in environmental safety of current chiral insecticides[J]. Proceedings of the national academy of sciences of the united states of america,2005,102(3):701-706.
[6]GHISARI M, LONG M, TABBO A, et al. Effects of currently used pesticides and their mixtures on the function of thyroid hormone and aryl hydrocarbon receptor in cell culture[J]. Toxicology and applied pharmacology,2015,284(3):292-303.
[7]TAKEUCHI S, IIDA M, YABUSHITA H, et al. In vitro screening for aryl hydrocarbon receptor agonistic activity in 200 pesticides using a highly sensitive reporter cell line, DR-EcoScreen cells, and in vivo mouse liver cytochrome P450-1A induction by propanil, diuron and linuron[J]. Chemosphere,2008,74(1):155-165.
[8]ABASS K, LAMSA V, REPONEN P, et al. Characterization of human cytochrome P450 induction by pesticides[J]. Toxicology,2012,294(1):17-26.
[9]杨燕,高叶玲,章晓凤.联苯菊酯对大鼠围排卵期基因表达影响的对映体选择性[J].浙江工业大学学报,2012,40(4):408-413.
[10]章晓凤,张微,周聪.氟虫腈和铜对斑马鱼早期发育的联合毒性效应[J].浙江工业大学学报,2012,40(6):612-615.
[11]ANDREASEN E A, HAHN M E, HEIDEMAN W, et al. The zebrafish (Danio rerio) aryl hydrocarbon receptor type 1 is a novel vertebrate receptor[J]. Molecular pharmacology,2002,62(2):234-249.
[12]GOODALE B C, DU J K L, BISSON W H, et al. AHR2 mutant reveals functional diversity of aryl hydrocarbon receptors in zebrafish[J]. Plos one,2012,7(1):e29346.
[13]GOHLKE J M, THOMAS R, ZHANG Y, et al. Genetic and environmental pathways to complex diseases[J]. Biomed central systems biology,2009,3:46.
[14]TAKEUCHI S, MATSUDA T, KOBAYASHI S, et al. In vitro screening of 200 pesticides for agonistic activity via mouse peroxisome proliferator-activated receptor (PPAR)alpha and PPARgamma and quantitative analysis of in vivo induction pathway[J]. Toxicology and applied pharmacology,2006,217(3):235-244.
[15]LOVEKAMPSWAN T, JETTEN A M, DAVIS B J. Dual activation of PPAR alpha and PPAR gamma by mono-(2-ethylhexyl) phthalate in rat ovarian granulosa cells[J]. Molecular and cellular endocrinology,2003,201(1/2):133-141.
[16]TODA K, OKADA T, MIYAURA C, et al. Fenofibrate, a ligand for PPAR alpha 3, inhibits aromatase cytochrome P450 expression in the ovary of mouse[J]. Journal of lipid research,2003,44(2):265-270.
[17]RATNASOORIYA W D, RATNAYAKE S S K, JAYATUNGA Y N A. Effects of pyrethroid insecticide ICON (lambda cyhalothrin) on reproductive competence of male rats[J]. Asian journal of andrology,2002,4(1):35-41.
[18]OBEROI S, AHMED R S, SUKE S G, et al. Comparative effect of topical application of lindane and permethrin on oxidative stress parameters in adult scabies patients[J]. Clinical biochemistry,2007,40(16/17):1321-1324.
[19]TURKEZ H, TOGAR B, POLAT E. Olive leaf extract modulates permethrin induced genetic and oxidative damage in rats[J]. Cytotechnology,2012,64(4):459-464.
[20]MAGLICH J M, STOLTZ C M, GOODWIN B, et al. Nuclear pregnane X receptor and constitutive androstane receptor regulate overlapping but distinct sets of genes involved in xenobiotic detoxification[J]. Molecular pharmacology,2002,62(3):638-646.
[21]KOJIMA H, SATA F, TAKEUCHI S, et al. Comparative study of human and mouse pregnane X receptor agonistic activity in 200 pesticides using in vitro reporter gene assays[J]. Toxicology,2011,280(3):77-87.
[22]SHI D, YANG D, YAN B. Dexamethasone transcriptionally increases the expression of the pregnane X receptor and synergistically enhances pyrethroid esfenvalerate in the induction of cytochrome P450 3A23[J]. Biochemical pharmacology,2010,80(8):1274-1283.
[23]LEMAIRE G, MNIF W, PASCUSSI J M, et al. Identification of new human pregnane X receptor ligands among pesticides using a stable reporter cell system[J]. Toxicological sciences,2006,91(2):501-509.
[24]YANG D F, WANG X L, CHEN Y, et al. Pyrethroid insecticides: isoform-dependent hydrolysis, induction of cytochrome P450 3A4 and evidence on the involvement of the pregnane X receptor[J]. Toxicology and applied pharmacology,2009,237(1):49-58.
[25]SODERLUND D M. Molecular mechanisms of pyrethroid insecticide neurotoxicity: recent advances[J]. Archives of toxicology,2012,86(2):165-181.
[26]KANEKO H. Pyrethroids: mammalian metabolism and toxicity[J]. Journal of agricultural and food chemistry,2011,59(7):2786-2791.
[27]BORTOLOZO F R, AGUIAR T R, HANSEL F A, et al. Peatland as a natural sink for pesticides from no-till systems in subtropical climate[J]. Agricultural water management,2016,163:19-27.
[28]YAN H Y, HAN Y H, DU J J. Combination of solid-phase extraction and dispersive liquid-liquid microextraction for detection of cypermethrin and permethrin in environmental water[J]. Analytical methods,2012,4(9):3002-3006.
[29]龚得春.梁滩河流域拟除虫菊酯农药多介质残留和环境行为研究[D].四川:重庆大学城市建设与环境工程学院,2013.
(责任编辑:刘岩)
Effects of pyrethroids on the expression of oxidative metabolism related nuclear receptor genes in zebrafish
DU Jie, ZHANG Yi, HONG Panpan, ZHAO Meirong
(College of Environment,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract:In this work, zebrafish were exposed to permethrin (PM, Type I) or lambda-cyhalothrin (LCT, Type II), and then we measured the nephritic mRNA levels of three oxidative metabolism related to nuclear receptor gene, aryl hydrocarbon receptor(AhR), peroxisome proliferators-activated receptor(PPAR) and pregnane X receptor (PXR). The results showed that the expression of AhR2,PPARα and PXR were up-regulated after exposure to LCT, the expression of AhR1a and PXR were up-regulated after exposure to PM, and the expression of AhR1b was down-regulated after exposure to both pyrethroids. In addition, LCT exhibited greater effect on the gene than PM at higher concentrations and PM exhibited effect at its environmental exposure concentration. These results revealed that both LCT and PM have potential risks for the aquatic ecosystem health and further elucidated the underlying toxicology mechanism of pyrethroids pesticides in aquatic organisms, which hopefully can provide a foundation/further evidence for the ecological risk assessment.
Keywords:zebrafish; pyrethroids pesticides; lambda-cyhalothrin; permethrin
收稿日期:2015-11-23
基金项目:国家自然科学基金重点项目(21337005);国家自然科学基金资助项目(21377119)
作者简介:杜洁(1992—),女,江西九江人,硕士研究生,研究方向为环境化学与毒理学,E-mail:dujie920324@163.com.通信作者:赵美蓉教授,E-mail:zhaomr@zjut.edu.cn.
中图分类号:X171.1
文献标志码:A
文章编号:1006-4303(2016)03-0334-06
