低氧环境下厄贝沙坦通过调控HIF-1α对心肌细胞的保护作用
2016-06-27袁芳武艳强袁静朱琳侯爱军张维
袁芳 武艳强 袁静 朱琳 侯爱军 张维
(1.邯郸市中心医院心内4科, 河北 邯郸 056001;2.武安市第一人民医院, 河北 武安 056300;3.成都医学院第一附属医院, 成都 四川 610500)
·论著·
低氧环境下厄贝沙坦通过调控HIF-1α对心肌细胞的保护作用
袁芳1武艳强1袁静2朱琳1侯爱军1张维3
(1.邯郸市中心医院心内4科, 河北 邯郸 056001;2.武安市第一人民医院, 河北 武安 056300;3.成都医学院第一附属医院, 成都 四川 610500)
【摘要】目的探讨厄贝沙坦(irbesartan)对于低氧诱导的大鼠H9C2心肌细胞损伤的保护作用及相关的分子机制。方法将大鼠H9C2心肌细胞分为3组,分别为常氧组(Normoxia组)、低氧+厄贝沙坦组(Hypoxia+Irbesartan组)和低氧组(Hypoxia组)。在低氧环境下对H9C2心肌细胞使用10μmol/L厄贝沙坦进行干预。在干预24h后,使用qPCR法和western blotting法对H9C2心肌细胞iNOS、HIF-1α和Bax的mRNA和蛋白水平进行检测。结果在低氧环境干预24h后H9C2心肌细胞iNOS、HIF-1α和Bax mRNA和蛋白表达较常氧环境下显著增加,差异有统计学意义(P均<0.01);但低氧+厄贝沙坦组H9C2心肌细胞iNOS、HIF-1α和Bax mRNA和蛋白的表达水平较低氧组细胞明显降低,差异有统计学意义(P均<0.05)。结论该基础研究提示厄贝沙坦(irbesartan)可能可以通过下调iNOS的合成和抑制Bax的表达对低氧诱导的大鼠H9C2心肌细胞损伤和凋亡产生保护作用,同时该机制可能与调控HIF-1α的表达密切相关。
【关键词】厄贝沙坦;缺氧诱导因子-1α;诱导型一氧化氮合酶;Bax;H9C2心肌细胞
减轻和抑制缺血缺氧导致的心肌细胞损伤(injury)和凋亡(apoptosis),是心脏大手术(如瓣膜置换和冠脉搭桥手术以及心肌梗塞等)患者预后质量的关键性问题[1-4]。血管紧张素Ⅱ受体阻滞剂(angiotensin-Ⅱ receptor blocker, ARB)目前已广泛应用于心脏疾病(如原发性高血压和冠状动脉硬化性心脏病等)的临床治疗。近年有多个研究证实ARB类药物存在独立于抑制血管紧张素系统作用以外的包括抑制肿瘤细胞增殖、抑制炎症反应、抑制器官纤维化以及抑制氧化应激和抑制凋亡等多种药理学活性[5-10]。同时进一步的研究发现ARB的部分生物活性来源于对于缺氧诱导因子-1α (hypoxia-inducible factor-1α, HIF-1α)的调控作用[11]。在组织器官缺血缺氧状态下HIF-1α的过度表达是诱导大量炎症介质和氧化应激产物大量释放的重要原因之一[12, 13]。研究表明下调HIF-1α的合成和表达对于缺氧状态下的心肌细胞具有保护作用[14]。该基础研究的目的是探索在低氧状态下血管紧张素Ⅱ受体阻滞剂厄贝沙坦对于大鼠H9C2心肌细胞的保护作用及相关的分子机制。
1材料和方法
1.1主要试剂和材料RNA提取试剂盒购买于美国Invitrogen公司;PCR试剂盒购自日本TaKaRa株式会社;兔抗鼠iNOS抗体、兔抗鼠Bax抗体、兔抗鼠HIF-1α抗体和兔抗鼠β-actin抗体均购于美国Santa Cruz公司;厄贝沙坦购买于美国Sigma公司;DMEM培养基购买于美国Gibco公司;小牛血清购买于澳大利亚Gibco公司。
1.2细胞培养大鼠H9C2心肌细胞常规接种在含15%胎牛血清,100g/L青霉素、100g/L链霉素的DMEM/F12培养液中,置于37℃,5% CO2,孵箱内培养。每72h换液、传代1次,取对数生长期细胞用于实验。H9C2心肌细胞分为分别为常氧组(Normoxia组)、低氧+厄贝沙坦组(Hypoxia+Irbesartan组)和低氧组(Hypoxia组),共3组。其中常氧组和低氧组细胞加入PBS,低氧+厄贝沙坦组加入溶于0.5% DMSO终浓度为10μmol/L的厄贝沙坦溶液,而后将低氧组和低氧+厄贝沙坦组细胞移置于低氧环境(1%O2、5%CO2和94% N2)进行培养。
1.3细胞iNOS、Bax和HIF-1α mRNA表达检测干预24h后,按照RT-PCR试剂盒说明书提取细胞总RNA。引物:iNOS正义5′-ACAC CGA TTCC ACTCAACTA-3′,反义5′-ACCAC CTGTTAG TTCAA GCC-3′;HIF-1α正义 5′-CCTACTATG TCGCTTTC TTGG-3′,反义5′-GTTTCTG CTGCC TTGTA TGGG-3′;Bax正义 5′- AGGGTGGCTGGGAAGGC-3′,反义5′- TGAGCGAGGCGGTGAGG-3′;β-actin正义:5′-CGGTCA GGTCATC ACTATCG-3′,反义:5′-TTCCAT ACCCAG GAAGGAAG-3′。按照试剂盒说明书介绍进行反转录和扩增实验。使用2-ΔΔCt法对iNOS和HIF-1α mRNA表达水平进行测定,ΔΔCt=(Ct,目标-Ct,β-actin)干预组-(Ct,目标-Ct,β-actin)对照组[15]。
1.4Western blot法检测细胞中iNOS、Bax和HIF-1α蛋白表达干预24h后,按照试剂盒操作要求,首先提取细胞总蛋白,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1h,分别加入兔抗鼠抗体iNOS (1∶800)、兔抗鼠抗体Bax (1∶1000)兔抗鼠抗体HIF-1α (1∶900)和兔抗鼠抗体β-actin (1∶1200),4°C孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1∶2000),用ECL进行显色,用凝胶成像分析系统进行扫描。
1.5统计学方法计量资料以均数±标准差表示。采用SPSS 20.0进行单因素方差分析,两样本均数多重比较采用LSD法,P<0.05为差异有统计学意义。
2结果
2.1iNOS mRNA和蛋白的表达在干预24h后,低氧环境下大鼠H9C2心肌细胞iNOS mRNA和蛋白表达较常氧环境下显著上升,差异有统计学意义(P均<0.05);同时与低氧组比较,低氧+厄贝沙坦组细胞iNOS mRNA和蛋白表达相对较低,差异有统计学意义(P均<0.05),见表1、图1。
2.2HIF-1α mRNA和蛋白的表达在干预24h后,低氧环境下大鼠H9C2心肌细胞HIF-1α mRNA和蛋白表达较常氧环境下明显上升,差异有统计学意义(P均<0.05);同时与低氧组比较,低氧+厄贝沙坦组细胞HIF-1α mRNA和蛋白表达相对较低,差异有显著统计学意义(P均<0.05)。见表1和图1。
2.3Bax mRNA和蛋白的表达在干预24h后,低氧环境下大鼠H9C2心肌细胞Bax mRNA和蛋白表达较常氧环境下显著上升,差异有统计学意义(P均<0.05);同时与低氧组比较,低氧+厄贝沙坦组细胞Bax mRNA和蛋白表达相对较低,差异有统计学意义(P均<0.05),见表2、图2。

表1 大鼠H9C2心肌细胞iNOS和HIF-1α mRNA和蛋白的表达
注:与常氧组相比较①P<0.05,②与低氧组相比较P<0.05。

图1大鼠H9C2心肌细胞iNOS和HIF-1α表达的western blot结果
Figure 1Western blot results of iNOS and HIF-1α in rat H9C2 cardiomyocytes

表2 大鼠H9C2心肌细胞Bax mRNA和蛋白的表达
注:与常氧组相比较①P<0.05,与低氧组相比较②P<0.05
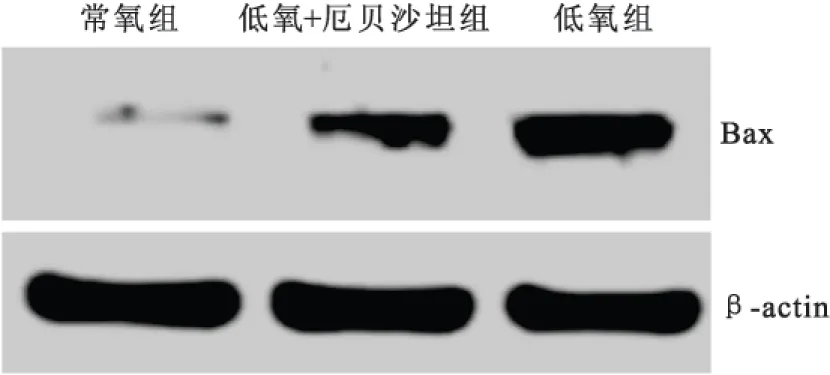
图2大鼠H9C2心肌细胞Bax表达的western blot结果
Figure 2Western blot results of Bax in rat H9C2 cardiomyocytes
3讨论
血管紧张素Ⅱ受体阻滞剂(angiotensin-Ⅱ receptor blocker, ARB)作为一种有效而安全的降压药物已广泛应用于原发性高血压和冠状动脉性心脏病等疾病的临床治疗。ARB类药物如厄贝沙坦、替米沙坦和颉沙坦等还具有抑制肿瘤、抑制炎症反应和缓解器官纤维化的药理作用[5-7]。
研究显示ARB的药理作用与调控缺氧诱导因子-1 (hypoxia-inducible factor-1α, HIF-1)密切相关[11]。HIF-1在细胞对低氧状态反应过程中扮演着重要的角色[6-11]。HIF-1是一种由HIF-1α和HIF-1β亚基构成的异二聚体,在常氧状态下细胞内的HIF-1α通过E3泛素蛋白连接酶(E3 ubiquitin-protein ligases)作用导致持续的泛素化降解而使细胞内HIF-1α含量很低,但低氧环境可以直接抑制E3泛素蛋白连接酶的活性而导致细胞内HIF-1α的含量明显增加,最终形成HIF-1α/HIF-1β异二聚体发挥生物学效应[6-11]。目前发现大量的炎症介质和氧化应激分子(如iNOS等)基因启动子部位存在HIF-1的结合部位,表明HIF-1对于这些基因的表达存在转录水平和心肌细胞凋亡具有重要的调控作用[16-18]。
大量研究显示缺血缺氧状态下的心肌细胞保护对于心脏大手术和冠心病患者的预后极其重要重要[6-10]。缺氧状态可直接导致心肌细胞线粒体功能障碍,诱导发生氧化应激反应,最终导致心肌细胞损伤、凋亡甚至死亡[17, 18]。Shyu KG等的研究显示在主动脉-腔静脉分流术(aorta-caval shunt)模型诱导的大鼠心力衰竭动物模型中肾上腺素β受体阻断剂卡维地洛可以有效改善大鼠的心脏功能,并认为该过程与抑制HIF-1α的合成下调VEGF和BNP的表达密切相关[17]。部分研究表明不适宜的或过度的低氧刺激可致使心肌细胞凋亡[18]。由于iNOS的过度表达可直接诱导心肌细胞的损伤,在低氧状态时iNOS的表达主要受到HIF-1的调控[19, 20]。在本研究中我们使用qPCR和western blotting法对大鼠H9C2心肌细胞iNOS和Bax mRNA和蛋白的表达进行分析后发现在干预24小时后,低氧环境下大鼠H9C2心肌细胞iNOS 和Bax mRNA和蛋白表达较常氧环境下显著上升(P均<0.05);同时与低氧组比较,低氧+厄贝沙坦组细胞iNOS和Bax mRNA和蛋白表达相对较低(P均<0.05)。该结果表明在低氧状态下厄贝沙坦可以有效抑制H9C2心肌细胞iNOS和Bax的表达,缓解异常的应激反应和凋亡过程。
同时我们进一步对HIF-1α mRNA和蛋白的表达进行分析后发现在干预24小时后,低氧环境下大鼠H9C2心肌细胞HIF-1α mRNA和蛋白表达较常氧环境下明显上升 (P均<0.05);同时与低氧组比较,低氧+厄贝沙坦组细胞HIF-1α mRNA和蛋白表达相对较低(P均<0.05)。该结果表明在厄贝沙坦可以有效下调低氧诱导的HIF-1α的合成。
4结论
以上结果提示血管紧张素Ⅱ受体阻滞剂厄贝沙坦(irbesartan)可能可以通过调控HIF-1α抑制低氧诱导状态下大鼠H9C2心肌细胞iNOS的合成以及Bax的表达,对心肌细胞产生保护作用。但仍需进一步的实验揭示相关的信号通路和分子机制。
【参考文献】
[1]尚艳文, 唐红, 韦馨, 等. 抗ICAM-1液态氟碳微球靶向结合损伤心肌细胞的体内外实验及其抗炎作用研究[J]. 西部医学, 2013, 25(4): 487-492.
[2]罗素新, 但素平, 夏勇. 诱导型一氧化氮合酶在心肌梗死进程中的研究进展[J]. 西部医学, 2014, 26(3): 265-268.
[3]Görbe A, Eder A, Varga ZV,etal. Protection by the NO-Donor SNAP and BNP against Hypoxia/Reoxygenation in Rat Engineered Heart Tissue [J]. PLoS One, 2015, 10(7):e0132186.
[4]周红力, 张小兰. 黄芪多糖抗心肌缺血作用与机制[J]. 西部医学, 2012, 24(8): 1449-1451.
[5]Li J, Chen L, Yu P,etal. Telmisartan exerts anti-tumor effects by activating peroxisome proliferator-activated receptor-γ in human lung adenocarcinoma A549 cells [J]. Molecules, 2014, 19(3):2862-2876.
[6]Uemura H, Ishiguro H, Kubota Y. Pharmacology and new perspectives of angiotensin II receptor blocker in prostate cancer treatment [J]. Int J Urol, 2008, 15(1):19-26.
[7]黄茂芝, 徐尚华, 宋欢欢, 等. 替米沙坦对同型半胱氨酸诱导的人脐静脉内皮细胞血管细胞黏附分子1、核因子κB表达及细胞黏附的影响[J]. 中国动脉硬化杂志, 2012, 20(8): 678-683.
[8]李乾, 张桂英, 孟燕妮. 氯沙坦抗鼠肝纤维化的实验研究[J]. 中国现代医学杂志, 2007, 17(4): 385-388.
[9]李淑梅, 钟世顺, 吴平生, 等. 氯沙坦对自发性高血压大鼠心脏局部醛固酮的合成及其心肌纤维化的影响[J]. 中国现代医学杂志, 2006, 16(4): 539-542.
[10] 曾龙驿, 舒同, 林可意, 等. 伊贝沙坦对糖尿病大鼠肾氧化应激、NF-kB活性和ICAM-1 mRNA表达的影响[J]. 中山大学学报:医学科学版, 2008,(4): 402-406.
[11] Liu C, Zhang JW, Hu L,etal. Activation of the AT1R/HIF-1 α /ACE axis mediates angiotensin II-induced VEGF synthesis in mesenchymal stem cells [J]. Biomed Res Int, 2014, 2014: 39(5):627-631.
[12] Gölz L, Memmert S, Rath-Deschner B,etal. Hypoxia and P. gingivalis synergistically induce HIF-1 and NF-κB activation in PDL cells and periodontal diseases [J]. Mediators Inflamm, 2015, 2015:438085.
[13] Kim M, Neinast MD, Frank AP,etal. ERα upregulates Phd3 to ameliorate HIF-1 induced fibrosis and inflammation in adipose tissue [J]. Mol Metab, 2014, 3(6):642-651.
[14] Cho S, Cho M, Kim J,etal. Syringaresinol protects against hypoxia/reoxygenation-induced cardiomyocytes injury and death by destabilization of HIF-1α in a FOXO3-dependent mechanism [J]. Oncotarget, 2015, 6(1):43-55.
[15] 尹鹏, 胡君, 储著凌, 等. 替米沙坦通过上调PPAR-γ促进结肠癌SW480细胞TIMP-1表达的实验研究[J]. 西部医学, 2014, 26(2): 160-162.
[16] Wu J, Chen P, Li Y,etal. HIF-1α in heart: protective mechanisms [J]. Am J Physiol Heart Circ Physiol, 2013, 305(6):H821-828.
[17] Shyu KG, Lu MJ, Chang H,etal. Carvedilol modulates the expression of hypoxia-inducible factor-1alpha and vascular endothelial growth factor in a rat model of volume-overload heart failure [J]. J Card Fail, 2005, 11(2):152-159.
[18] Malhotra R, Tyson DW, Rosevear HM, Brosius FC 3rd. Hypoxia-inducible factor-1alpha is a critical mediator of hypoxia induced apoptosis in cardiac H9c2 and kidney epithelial HK-2 cells [J]. BMC Cardiovasc Disord, 2008, 8:9.
[19] 罗素新, 但素平, 夏勇. 诱导型一氧化氮合酶在心肌梗死进程中的研究进展[J]. 西部医学, 2014, 26(3): 265-268.
[20] Wang S, Qian Y, Gong D,etal. Resveratrol attenuates acute hypoxic injury in cardiomyocytes: correlation with inhibition of iNOS-NO signaling pathway [J]. Eur J Pharm Sci, 2011, 44(3): 416-421.
Irbesartan protects hypoxia-induced cardiomyocytes injury through mediation of HIF-1α in vitro
YUAN Fang1, WU Yanqiang1, YUAN Jing2,et al
(1.TheFourthDepartmentofCardiology,HandanCentralHospital,Handan056001,Hebei,China; 2.TheFirstHospitalofWu’an,Handan056300,Hebei,China; 3.TheFirstAffiliatedHospitalofChengduMedicalCollage,Chengdu610500,China)
【Abstract】ObjectiveTo explore the protective role of angiotensin-II receptor blocker (ARB) irbesartan on hypoxia-induced cardiomyocytes injury in rat H9C2 cardiomyocytes, and its underlying mechanism. MethodsRat H9C2 cardiomyocytes were divided into 3 groups, including Control group, Hypoxia+Irbesartan and Hypoxia group. After 24h interventions, qPCR was performed to analyze the mRNA expression of iNOS, Bax and HIF-1α. Meanwhile, Western blotting was used to observe the protein expression of iNOS, Bax and HIF-1α. ResultsAfter 24h hypoxia stimulation, the mRNA and protein expressions of iNOS, Bax and HIF-1α were significantly increased. Moreover, hypoxia-induced the up-regulation of iNOS, Bax and HIF-1α was largely inhibited by irbesartan in rat H9C2 cardiomyocytes. Conclusion In current study, our data indicated that hypoxia-induced rat H9C2 cardiomyocytes injury can be attenuated by angiotensin-II receptor blocker (ARB) irbesartan, involving inhibition of HIF-1α signaling pathway.
【Key words】Irbesartan; Hypoxia-inducible factor-1α; Inducible nitric oxide synthase; Bax; H9C2 cardiomyocytes
基金项目:四川省教育厅课题(11ZB172)
【中图分类号】R 542.2
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.05.009
(收稿日期:2015-09-17; 编辑: 张文秀)
