毛萼乙素通过调节STAT3抑制宫颈癌C-33A细胞survivin的表达*
2016-06-27齐玉明王春丽冯社军
齐玉明 王春丽 冯社军
(邯郸市中心医院 1.妇二科,2.神经内二科, 河北 邯郸 056001)
·论著·
毛萼乙素通过调节STAT3抑制宫颈癌C-33A细胞survivin的表达*
齐玉明1王春丽1冯社军2
(邯郸市中心医院1.妇二科,2.神经内二科, 河北 邯郸 056001)
【摘要】目的观察毛萼乙素(Eriocalyxin B, ERB)对于宫颈癌C-33A细胞增殖的调节作用和对survivin表达的调控作用,及其相关的分子机制。方法使用不同浓度的毛萼乙素(0μM、1μM和20μM)对宫颈癌C-33A细胞进行干预。在不同时间点(0h、24h和48h)使用MTT法对C-33A细胞活性进行测定。在干预48h后,采用qPCR对C-33A细胞survivin mRNA的表达水平进行检测。采用western blot对C-33A细胞survivin蛋白表达水平和STAT3磷酸化水平进行检测。结果与0μM干预组相比,给予毛萼乙素干预的宫颈癌C-33A细胞活性呈时间依赖性和浓度依赖性下降,差异均有显著统计学意义(P均<0.05)。在毛萼乙素干预48h后,宫颈癌C-33A细胞survivin mRNA和蛋白的表达水平及STAT3的活化水平呈浓度依赖性降低,差异均有显著统计学意义(P均<0.05)。结论毛萼乙素可能可以通过下调宫颈癌C-33A细胞survivin的表达对肿瘤细胞的增殖产生抑制作用,该机制与降低STAT3的活化密切相关,且为毛萼乙素应用于宫颈癌及其他恶性肿瘤的临床治疗奠定了一定的实验基础。
【关键词】宫颈癌;C-33A细胞;毛萼乙素;STAT3;survivin
宫颈癌(cervical cancer)是女性最常见的恶性肿瘤之一,其流行病学研究证实发病率居第四位,同时部分数据显示宫颈癌有年轻化的趋势[1-4]。毛萼乙素(Eriocalyxin B, ERB)作为一种二萜类化合物(diterpenoid),主要来源于唇形科植物毛萼香茶菜(Isodon eriocalyx)[5-11]。近年研究发现毛萼乙素具有调节免疫细胞分化、抑制肿瘤细胞增殖和抑制炎症反应等多种的药理作用和生物活性[12-14]。毛萼乙素的多种生物活性与阻断STAT3的活化密切相关[15]。本研究旨探讨毛萼乙素对于宫颈癌C-33A细胞的抑制作用及其潜在的分子机制。
1材料和方法
1.1主要试剂和材料第一链qPCR试剂盒购于日本Takara公司;iQTM5 Multicolor Real-Time PCR Detection System购买于美国百乐公司;鼠抗人survivin抗体、鼠抗人phospho-STAT3抗体、鼠抗人STAT3抗体和鼠抗人β-actin抗体购于Santa Cruz公司;毛萼乙素购买于美国Sigma公司;DMEM培养基购买于美国Gibco公司; MTT试剂盒购买于美国Promega公司;其余试剂均为分析纯。
1.2细胞培养宫颈癌C-33A细胞常规接种在含10% FBS、100g/L 青霉素、100g/L链霉素的DMEM培养液中,置于37°C、95%空气、5 % CO2孵箱内培养。每48 h换液、传代1次,取对数生长期细胞用于实验。
1.3细胞活性检测取对数生长期细胞消化制成单细胞悬液,接种于96 孔培养板中,每孔接种100 μL约含5×103个细胞。贴壁后无血清培养细胞16h至24h,使细胞同步化。加入不同终浓度(0μM、1μM和20μM)的毛萼乙素,在37℃,5 % CO2条件下培养细胞,0μM干预组细胞作为对照组。使用MTT比色试验对不同时间点(0h、24h和48 h)的细胞生长状态进行测定,实验重复4次。对应时间点的细胞活性(%)=(OD干预组/OD对照组) × 100 (%)[16]。
1.4细胞survivin mRNA表达检测按照试剂盒说明书提取细胞总RNA,反转录为cDNA,以cDNA为模板进行qPCR反应。5′-CATGGG TGCCC CGACGTTG-3′,反义5′-GCTC CGGCCAGAGGC CTCAA-3′;β-actin正义:5′-TGGC ATTGCC GACAGGAT-3′,反义:5′-GCTCA GGAGGAGCAA TGATCT-3′。使用β-actin作为内参基因,使用2-ΔΔCT公式计算目的基因相对表达量。ΔΔCt = (Ct,目标-Ct,β-actin)干预组-(Ct,目标-Ct,β-actin)对照组[17]。
1.4Western blot法检测细胞中survivin蛋白表达水平和STAT3磷酸化水平按照试剂盒操作要求,首先提取细胞总蛋白,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1小时,分别加入鼠抗人单克隆抗体鼠抗人survivin抗体、鼠抗人phospho-STAT3抗体、鼠抗人STAT3抗体和鼠抗人β-actin抗体,4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1∶2000),用ECL进行显色,用凝胶成像分析系统进行扫描。
1.5统计学方法计量资料以均数±标准差表示。采用SPSS 21.0进行单因素方差分析,两样本均数多重比较采用LSD法,P<0.05为差异有统计学意义。
2结果
2.1MTT法结果分析在不同浓度(0μM、1μM和20μM)毛萼乙素干预后,使用MTT法对不同时间点(0、24和48小时) 宫颈癌C-33A细胞活性进行测定。发现给予毛萼乙素干预的宫颈癌C-33A细胞活性呈浓度依赖性和时间依赖性下降,差异均具显著统计学意义(P均<0.05),见表1。

表1 MTT比色法测定C-33A细胞活性
注:对应时间点与0μM相比较①P<0.05,对应时间点与1μM相比较②P<0.05。
2.2Survivin mRNA和蛋白的表达在给予宫颈癌C-33A细胞不同浓度(0μM、1μM和20μM)毛萼乙素干预48小时后,使用qPCR和western blot法对细胞survivin mRNA和蛋白的表达进行检测。与对照组细胞相比较,给予毛萼乙素干预的C-33A细胞survivin mRNA和蛋白表达水平呈浓度依赖性降低,差异均存在显著统计学意义(P均<0.05),见图1和表2。
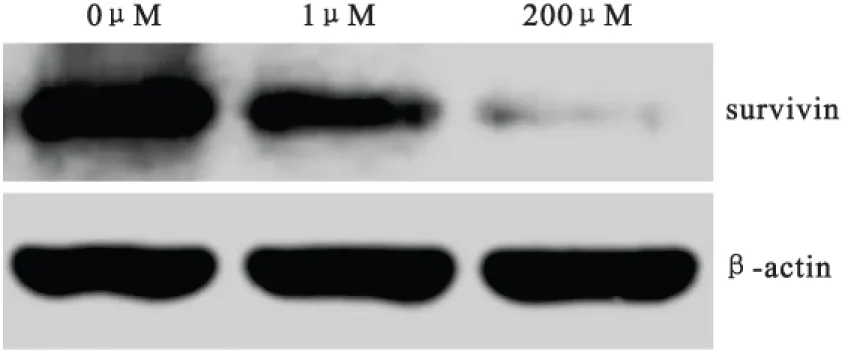
图1宫颈癌C-33A细胞survivin蛋白表达的western blot结果
Figure 1The western blot result of the protein expression of survivin in C-33A cells

Table 2The mRNA and protein expression levels of survivin and the phosphorylation of STAT3 in C-33A cells

药物浓度survivinmRNAsurvivin蛋白STAT3磷酸化水平0μM10.96±0.040.97±0.031μM0.63±0.21①0.69±0.18①0.73±0.17①20μM0.31±0.05①②0.23±0.07①②0.27±0.08①②
注:与0μM相比较①P<0.05,与1μM相比较②P<0.05。
2.3STAT3磷酸化水平在给予宫颈癌C-33A细胞不同浓度(0μM、1μM和20μM)毛萼乙素干预48h后,使用western blot法对细胞STAT3活化水平(phospho-STAT3/STAT3)进行检测。与对照组细胞相比较,给予毛萼乙素干预后的宫颈癌C-33A细胞STAT3活化水平呈剂量依赖性降低,差异均有显著统计学意义(P均<0.05),见图2和表2。
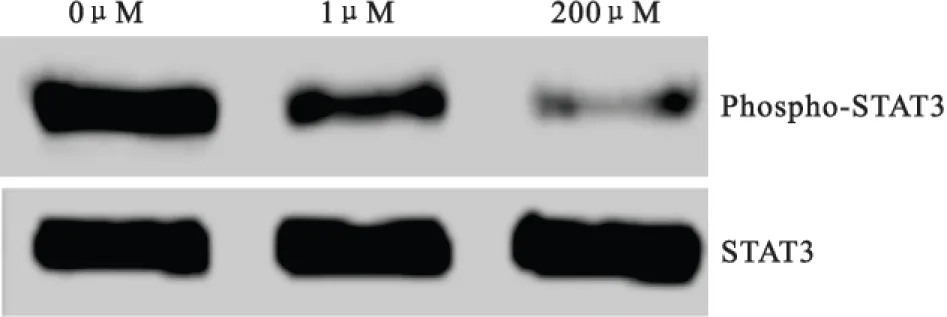
图2C-33A3细胞STAT3磷酸化的western blot结果
Figure 2The western blot result of the phosphorylation of STAT3 in C-33A cells
3讨论
宫颈癌(cervical cancer)作为女性生殖系统的最常见的恶性肿瘤之一在我国有较高的发病率。据流行病学调查研究显示我国宫颈癌的发病率高达7.5/10万人,死亡率约为3.4/10万人[1-3, 18]。研究显示人类乳头瘤样病毒(human papilloma virus, HPV)感染作为宫颈癌发生最重要的危险因素使HPV感染者发生宫颈癌的机率比未感染者增加250倍以上[18, 19]。同时研究表明由于我国HPV感染率的上升导致宫颈癌的发病率亦有逐年增加的趋势[18, 19]。故寻求新的抗宫颈癌的治疗药物和途径具有重的价值与意义。
毛萼乙素(Eriocalyxin B, ERB)是唇形科药用植物毛萼香茶菜(Isodon eriocalyx)的主要药理成分之一[5-10],为一种二萜类化合物(diterpenoid),具有抑制炎症反应、调节免疫细胞分化、抑制肿瘤细胞增殖和促进肿瘤细胞凋亡等在内的广泛的药理活性[5-15, 20]。Lu Y等研究发现毛萼乙素可以通过调节Th1细胞和Th17细胞的分化对自身免疫性脑脊髓炎(autoimmune encephalomyelitis)小鼠神经组织的炎症反应有显著的改善作用[12]。Li L等人通过动物实验证实毛萼乙素对胰腺腺癌有显著的抑制作用,且该抗肿瘤作用与毛萼乙素促进肿瘤细胞凋亡密切相关[13]。Zhang YW等也发现毛萼乙素可以通过促进肿瘤细胞的凋亡抑制淋巴瘤细胞增殖[20]。此外Leizer AL等的研究还证实毛萼乙素对TNF-α等炎症介质的释放有显著的抑制作用[14]。我们使用毛萼乙素对宫颈癌C-33A细胞进行干预后,发现C-33A细胞活性呈浓度依赖性和时间依赖性下降,该结果表明毛萼乙素对于宫颈癌C-33A细胞增殖有显著的抑制作用。
STAT3属于STATs家族成员,在生理状态下STATs广泛参与了细胞周期、组织生长发育以及组织器官修复等过程[21-24]。近年研究发现STAT3信号通路对于非小细胞肺癌、前列腺癌、卵巢癌、肝癌和宫颈癌等多种肿瘤细胞的增殖分化及凋亡有重要的调控作用[21-23]。肉盘菌内酯(galiellalactone)可以通过下调STAT3的活化抑制前列腺癌DU145细胞移植瘤小鼠体内肿瘤细胞的增殖和转移,并促进肿瘤细胞的凋亡[22]。Mukherjee A等的研究证实槲皮素(quercetin)主要通过IL-6/STAT-3信号通路诱导非小细胞肺癌A549细胞凋亡[23]。同时Yu X等的研究发现毛萼乙素可以通过阻断STAT3信号通路抑制肝癌HepG2细胞、非小细胞肺癌A549细胞以及乳腺癌MDA-MB-231和MDA-MB-468 细胞的增殖和转移[15]。本研究发现与对照组细胞相比较,给予毛萼乙素干预后的宫颈癌C-33A细胞STAT3活化水平呈剂量依赖性降低。同时,我们还对STAT3下游调控肿瘤增殖分化的重要分子survivin的表达进行了分析[24]。实验结果表明:在宫颈癌C-33A细胞中,毛萼乙素可以通过阻断STAT3信号通路有效的抑制survivin的表达。
4结论
在宫颈癌C-33A细胞中毛萼乙素可能可以通过阻断STAT3信号通路下调survivin的表达,并对肿瘤细胞的增殖产生显著的抑制作用。该基础实验为毛萼乙素应用于宫颈癌及其他恶性肿瘤的临床治疗奠定了一定的实验基础。
【参考文献】
[1]韩肖燕, 郄明蓉. 宫颈癌中AIB1蛋白表达水平的初步研究[J]. 西部医学, 2006, 18(05): 542-544.
[2]张丽, 国宏莉, 肖婧, 等. 液基细胞学检测在宫颈癌筛查中的作用研究[J]. 西部医学, 2010, 22(11): 2003-2005, 2008.
[3]杨晋蓉, 张英, 谢珊莉, 等. 新辅助化疗在中晚期宫颈癌治疗中的临床价值[J]. 西部医学, 2012, 24(03): 582-583.
[4]薛翔, 段钊, 公丕军. SiRNA-CD147降低HeLa中survivin表达的研究[J]. 西部医学, 2012, 24(05): 841-844.
[5]王健, 侯惠民, 夏怡然, 等. 毛萼乙素纳米混悬剂.Ⅱ.对小鼠肝癌H22移植瘤的生长抑制作用[J]. 中国医药工业杂志, 2012, 43(03): 194-197.
[6]白海燕, 谢丹, 廖奕佶, 等. 毛萼乙素诱导肝细胞癌细胞凋亡的实验研究[J]. 热带医学杂志, 2013, 13(05): 535-537, 封2.
[7]Kong LM, Deng X, Zuo ZL,etal. Identification and validation of p50 as the cellular target of eriocalyxin B [J]. Oncotarget, 2014, 5(22): 11354-11364.
[8]Wang Z, Yuan Q, Sun JH,etal. A validated HPLC method for the determination of eriocalyxin B in plasma and its application to pharmacokinetic studies [J]. Arzneimittelforschung, 2012, 62(12): 666-669.
[9]Zhao Y, Niu XM, Qian LP,etal. Synthesis and cytotoxicity of some new eriocalyxin B derivatives [J]. Eur J Med Chem, 2007, 42(4): 494-502.
[10] 班立丽, 张慧, 罗敏, 等. 毛萼乙素抑制人正常及肝癌血管生成的作用研究[J]. 中国药房.2010(15): 1351-1353.
[11] 夏怡然, 王健, 朱金屏, 等. 大鼠血浆中毛萼乙素的HPLC测定[J]. 中国医药工业杂志, 2010, 41(1): 41-43.
[12] Lu Y, Chen B, Song JH,etal. Eriocalyxin B ameliorates experimental autoimmune encephalomyelitis by suppressing Th1 and Th17 cells [J]. Proc Natl Acad Sci USA, 2013, 110(6): 2258-2263.
[13] Li L, Yue GG, Pu JX,etal. Eriocalyxin B-induced apoptosis in pancreatic adenocarcinoma cells through thiol-containing antioxidant systems and downstream signalling pathways. Curr Mol Med, 2014, 14(5): 673-89.
[14] Leizer AL, Alvero AB, Fu HH,etal. Regulation of inflammation by the NF-κB pathway in ovarian cancer stem cells [J]. Am J Reprod Immunol, 2011, 65(4):438-447.
[15] Yu X, He L, Cao P, Yu Q. Eriocalyxin B Inhibits STAT3 Signaling by Covalently Targeting STAT3 and Blocking Phosphorylation and Activation of STAT3 [J]. PLoS One, 2015, 10(5): e0128406.
[16] Zhu T, Wang DX, Zhang W,etal. Andrographolide protects against LPS-induced acute lung injury by inactivation of NF-κB [J]. PLoS One,. 2013, 8(2):e56407.
[17] 尹鹏, 胡君, 储著凌, 等. 替米沙坦通过上调PPAR-γ促进结肠癌SW480细胞TIMP-1表达的实验研究[J]. 西部医学, 2014, 26(2): 160-162.
[18] Wang SM, Qiao YL. Implementation of cervical cancer screening and prevention in China--challenges and reality [J]. Jpn J Clin Oncol, 2015, 45(1):7-11.
[19] 何礼霞, 何俊勇, 蒲建璐, 等. 人群对于HPV感染的认知现状[J]. 西部医学, 2012, 24(8): 1643-1644.
[20] Zhang YW, Jiang XX, Chen QS,etal. Eriocalyxin B induces apoptosis in lymphoma cells through multiple cellular signaling pathways [J]. Exp Hematol, 2010, 38(3):191-201.
[21] 刘胜中, 甘崇志, 杨双强. JAK2/STAT3通过上调HSP70蛋白介导TTX心肌保护作用[J]. 西部医学, 2011,23(3): 415-418.
[22] Canesin G, Evans-Axelsson S, Hellsten R,etal. The STAT3 Inhibitor Galiellalactone Effectively Reduces Tumor Growth and Metastatic Spread in an Orthotopic Xenograft Mouse Model of Prostate Cancer [J]. Eur Urol, 2015, pii: S0302-2838(15)00519-9.
[23] Mukherjee A, Khuda-Bukhsh AR. Quercetin Down-regulates IL-6/STAT-3 Signals to Induce Mitochondrial-mediated Apoptosis in a Nonsmall cell Lung-cancer Cell Line, A549 [J]. J Pharmacopuncture, 2015,18(1): 19-26.
[24] Habibie, Yokoyama S, Abdelhamed S,etal. Survivin suppression through STAT3/β-catenin is essential for resveratrol-induced melanoma apoptosis [J]. Int J Oncol,2014, 45(2):895-901.
Eriocalyxin B reduces the cell proliferation via blocking the activation of STAT3 in cervical cancer C-33A cells
QI Yuming1, WANG Chunli1, FENG Shejun2
(1.TheSecondDepartmentofGynaecologyandObstetrics,HandanCentralHospital,HandanHebei, 056001; 2.TheSecondDepartmentofNeurology,HandanCentralHospital,HandanHebei, 056001)
【Abstract】ObjectiveTo study the anti-tumor property of Eriocalyxin B (ERB) in cervical cancer C-33A cells and its potential mechanism. MethodsThree different concentrations (0μM, 1μM and 20μM) of ERB were used in current study. At different time points (0h, 24h and 48h), MTT assay was performed to analyze the cell viabilities. The mRNA and protein expression of survivin were measured by qPCR and Western blot. Meanwhile, the phosphorylation of STAT3 was also observed by western blot. ResultsThe cell viabilities of cervical cancer C-33A cells were concentration-dependently and time-dependently reduced by ERB. Then, the mRNA and protein expression of survivin and the phosphorylation of STAT3 were all concentration-dependently suppressed by ERB in cervical cancer C-33A cells, after 48 hours of interventions. ConclusionERB inhibited the proliferation of cervical cancer C-33A cells and survivin expression likely via blocking of the activation of STAT3.
【Key words】Cervical cancer; C-33A cells; Eriocalyxin B; STAT3; Survivin
基金项目:河北省卫生厅重点科技研究计划(20130359)
【中图分类号】R 961
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.05.008
(收稿日期:2015-07-01; 编辑: 张文秀)
