XpertMTB/RIF在结核病诊断及利福平耐药中的应用
2016-06-23温贵华郭夏娜邓君丽
刘 婷,温贵华,陈 伊,郭夏娜,邓君丽
(深圳市宝安区慢性病防治院检验科,广东深圳 518102)
·论著·
XpertMTB/RIF在结核病诊断及利福平耐药中的应用
刘婷,温贵华,陈伊,郭夏娜,邓君丽
(深圳市宝安区慢性病防治院检验科,广东深圳 518102)
摘要:目的评价XpertMTB/RIF技术在诊断结核病及利福平耐药中的临床应用价值。方法选取196例初诊患者痰标本,分别进行抗酸染色涂片镜检、罗氏固体培养、比例法药敏试验和XpertMTB/RIF检测,对XpertMTB/RIF检测痰标本中结核分枝杆菌(MTB)和利福平耐药性的敏感度和特异度,以及与金标准的一致性进行分析。结果以罗氏培养结果为金标准,XpertMTB/RIF方法检测MTB的敏感度为94.62%(123/130)、特异度为87.88%(58/66),kappa=0.828;以比例法药敏试验结果相比,XpertMTB/RIF方法检测利福平耐药的敏感度73.33%(11/15),特异度为96.30%(104/108),kappa=0.696。结论XpertMTB/RIF在结核病诊断和利福平耐药检测中敏感度和特异度较高,与传统方法有很好的一致性,且更高效,快捷,安全,更符合成本-效益,值得推广。
关键词:XpertMTB/RIF;结核分枝杆菌;利福平
近年来,虽然对结核分枝杆菌的生物学研究已经有了很大的进展,但是就成功控制结核病来说还是差强人意。在2013年,全球仍有新增近900 000的结核病患者和480 000的多重耐药结核病(MDR-TB)患者。结核分枝杆菌感染已经成为全球第二位引起死亡的独立感染因素,仅次于HIV感染[1-2]。目前,在全球范围内有大约18%的MDR-TB和广泛耐药结核病(XDR-TB)未被检测出[3],具备应用现代技术的高效实验室诊断系统是早期、快速、准确检测TB的首要条件。一种新的结核分枝杆菌(MTB)分子检测方法——XpertMTB/RIF试验,已经受到广泛关注,该试验为全自动半巢式实时荧光核酸扩增(PCR)技术,可在2 h之内同时检测MTB和利福平耐药[4]。本研究通过用该方法对来本院就诊196例结核病疑似患者的痰标本进行检测,研究该技术诊断MTB及利福平耐药的敏感度和特异度,并与传统方法做比较,以评价其在结核病诊治中的临床应用价值。
1资料与方法
1.1一般资料2014年12月至2015年2月来本院初诊肺结核疑似患者200例,收集患者痰标本分别进行涂片染色镜检、痰TB培养、比例法药敏试验及XpertMTB/RIF检测。其中有4例XpertMTB/RIF检测结果报告为错误或无法判读,最终有效例数为196例,其中涂阳134例,涂阴62例。
1.2研究方法抗酸染色涂片检测,改良罗氏培养基培养,中性罗氏培养基比例法药敏操作及结果判定。其操作均按《结核病诊断细菌学检验规程》进行。XpertMTB/RIF核酸扩增检测:按试剂说明书完成标本的前处理后加入检测反应盒,上机进行自动化检测,1.5 h后反应结束,可直接观察测试结果。XpertMTB/RIF 检测试剂盒购自美国Cepheid公司,抗酸染色液和罗氏固体培养基均购自珠海贝索生物技术有限公司。
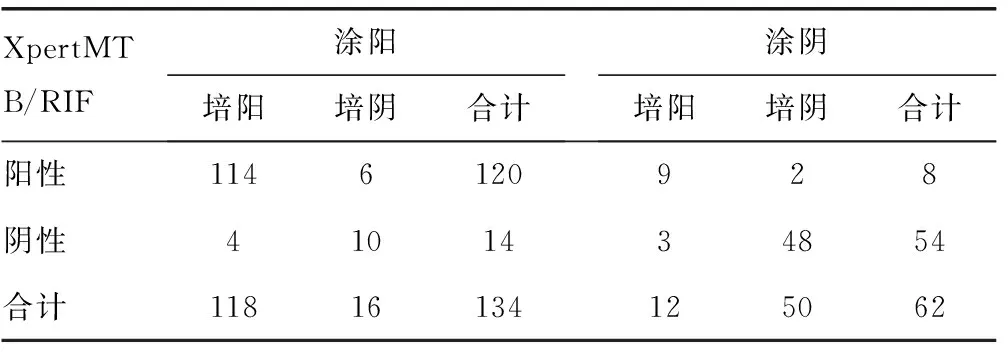
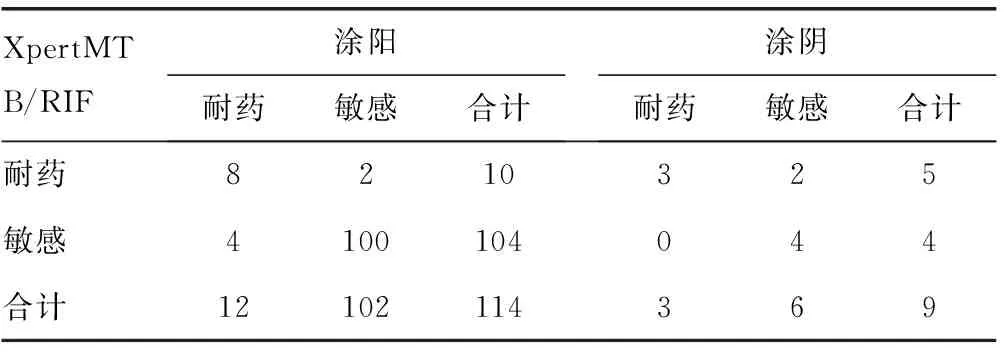
1.3统计学处理采用SPSS19.0对XpertMTB/RIF检测和检测金标准进行一致性检验,kappa统计量的可接受范围:kappa<0,一致性程度极差;0≤kappa≤0.2,一致性程度微弱;0.2 2结果 2.1XpertMTB/RIF对痰标本MTB的检测使用XpertMTB/RIF对200例痰标本进行检测,其中有4例XpertMTB/RIF检测结果报告为错误或无法判读。最终有效例数为196例.其中涂阳134例,涂阴62例。结果显示,以罗氏固体培养结果为金标准,XpertMTB/RIF检测涂阳患者MTB的敏感度为96.61%(114/118)、特异度为62.50%(10/16);检测涂阴患者MTB的敏感度为75.00%(9/12)、特异度为96.00%(48/50);全部患者检测的敏感度为94.62%(123/130)、特异度为87.88%(58/66)。对XpertMTB/RIF和固体培养进行kappa检验,kappa=0.828,两者具有很好的一致性。对两者McNemar检验,两者差异无统计学意义(P>0.05)。见表1。 表1 XpertMTB/RIF检测MTB效能分析(n) 2.2XpertMTB/RIF检测痰标本中MTB对利福平的耐药性分析XpertMTB/RIF结果显示中同步给出了123例阳性标本的利福平的耐药情况,其中涂阳114例,涂阴9例。与金标准结果相比较,XpertMTB/RIF方法检测涂阳患者利福平耐药的 敏 感 度 为 66.67%(8/12)、特 异 度 为98.04%(100/102);检测涂阴患者利福平耐药的敏感度和特异度分别为100%(3/3)、66.67%(4/6);全部患者检测的敏感度为73.33%(11/15)、特异度为96.30%(104/108)。对两者进行kappa一致性比较,kappa=0.696,两者具有良好一致性。McNemar检验,两者差异无统计学意义(P>0.05)。见表2。 表2 XpertMTB/RIF检测MTB培养阳性标本对 表3 XpertMTB/RIF对痰标本MTB分级与固体 2.3XpertMTB/RIF对痰标本的分级与固体培养分级的一致性分析XpertMTB/RIF对MTB的检测结果由检测系统直接给出,MTB 检出高:CT值小于16;MTB 检出中等:CT值在16~<22;MTB 检出低:CT 值在22~28;MTB 检出极低:CT值大于28;MTB未检出:CT值大于38。分枝杆菌培养结果由人工肉眼判读:++++,菌落布满全斜面;+++,菌落布满斜面达3/4;++,菌落布满斜面达2/4;+,菌落布满斜面达1/4;阴性,无菌落生长。具体分级情况见表3。对XpertMTB/RIF痰标本的分级与固体培养分级进行一致性检验,kappa=0.607,两者具有良好的一致性。 3讨论 由于MTB 耐多药菌株的出现,且合并感染HIV,结核病的交叉感染及人口流动的增加等因素,使得结核病的防控难度越来越大。2009年全球结核病患者患病率只有63%[5],2011年痰涂片阳性患者只占登记患者的56%。全球2013年新增有近900 000例的结核病患者和480 000例的MTD-TB患者。诊断延迟或漏诊的情况在结核病合并感染HIV患者中极其常见并进一步加剧[6],使大部分患者在治疗前就已经成为传染源[7],进一步导致了再次耐药的发生和新发病例数的逐年递增[8]。如果能对结核病及其耐药性做到早诊断,便有助于临床早治疗且尽早控制耐药MTB的传播。XpertMTB/RIF系统是一项将DNA提取、定量PCR扩增、MTB 特异核酸和利福平耐药基因荧光检测集于一身的全自动分子诊断方法。 本研究以罗氏固体培养法和比例法药敏试验为金标准,将XpertMTB/RIF与这两种传统方法的检测结果进行比对,来评价其在检测痰标本中的MTB及利福平耐药中的应用价值。与罗氏培养结果相比,XpertMTB/RIF检测涂阳与涂阴患者MTB的敏感度分别为96.61%和75.00%,这与Boehme等[9]的研究结果相似。总体检测MTB的敏感度为94.62%、特异度为87.88%,且XpertMTB/RIF与罗氏固体培养具有很好的一致性(kappa=0.828),这与国内学者张治国等[10]的试验结果相似,他们的研究发现 XpertMTB/RIF检测MTB的敏感度和特异度分别为95.00%、89.60%,与Bowles等[11]相 关 报 道 相 比 较,特异度略低,可能是由于国外多以液体培养作为金标准,而本研究中金标准为罗氏固体培养。同时,本研究还对XpertMTB/RIF检测MTB的分级情况与金标准固体培养的分级情况做了一致性分析,发现两者一致性相对较差(kappa=0.607)。 本研究结果显示,在检测利福平耐药方面,XpertMTB/RIF和金标准比例法药敏试验具有较好的一致性,虽然kappa系数小于0.750,这可能是由于样本量不够大的原因造成的,经进一步对两者行McNemar检验,差异无统计学意义(P>0.05)。Boehme等[9]的试验中XpertMTB/RIF对利福平耐药的检测敏感度为97.60%、敏感菌株检测敏感度为98.10%。Blakemore 等[12]检测利福平耐药的敏感度和特异度均为100.0%。而在本研究中,XperMTB/RIF检测MTB对利福平耐药特异性为96.30%,敏感度仅为73.33%。这可能是因为纳入本研究的研究对象均为结核病初治患者,因此样本中最终对利福平耐药的例数过少,在130例固体培养阳性的患者中,仅15例表现为利福平耐药。 在临床上,由于痰结核病涂片阴性的MTB患者确诊需依靠MTB培养,而MTB培养时间长,且要求标本中含有活菌。而临床上合格的标本又不易获取,尤其是在复治患者。故MTB涂阴菌培养阳性的标本中,应用XpertMTB/RIF 试验,结核病的检测敏感度仍能达到75.00%,其中检测涂阴患者利福平耐药的敏感度为100.00%。虽然检测涂阴培阳的效能与金标准还是有一定距离,但仍提示XpertMTB/RIF试验的临床应用价值高于结核病涂片;并且其同时检测出了利福平耐药,比传统方法先做培养再进行药敏试验节省了最少30 d的时间,有利于临床的早诊断、早治疗。 XpertMTB/RIF 为单墨盒反应装置,将样品准备所需的所有试剂都提前装入可以密封的一次性反应盒中,整个过程在封闭的腔室内自动化完成,从加样到出结果,2 h便可完成。与传统固体培养及药敏试验相比,具备以下诸多优点:(1)对实验操作人员和周围环境安全,减少气溶胶的产生;如此便减少了操作过程中污染[13];(2)其为全封闭全自动分子诊断方法,对操作人员的技术水平和实验室硬件设备的要求不高,生物安全要求低,具备生物安全柜就可操作,且操作简单,可在普通实验室条件下进行,易在基层医院推广[14];(3)从本研究及之前国内外学者的研究中都可以看到,XpertMTB/RIF在检测MTB效能及利福平耐药方面都有很好的敏感度和特异度,且整个实验在2 h之内即可完成,远远低于培养 (2个月)、培养药敏(3个月) 的报告时间。为临床及时诊治争取了大量的宝贵时间。特别是对于涂阴培阳同时又存在利福平耐药的患者,之前,“涂阴”患者从接受检测到开始治疗一般需要58 d,应用XpertMTB/RIF可缩短到4 d[15]。 因此,在2010年12月,世界卫生组织(WHO)将XpertMTB/RIF誉为突破性结核病诊断方法面向全球推荐[16],2013年5月,WHO推荐对结核病疑似患者率先使用XpertMTB/RIF方法检验,并建议XpertMTB/RIF可用于涂片阴性病例的进一步检测[17]。之前有学者报道该技术检测费用较昂贵,每例标本的检测成本约10美元[18]。但我国学者研究表明传统方法检测每例结核病患者所需成本为172.57元,检测每例耐药结核病患者的平均成本为208.84元。而XpertMTB/RIF检测每例结核病及利福平耐药的成本仅为118.62元,比传统方法更经济[19]。当然,该技术也存在弊端,即不能同时检测异烟肼耐药,而根据临床资料发现,如果患者是异烟肼耐药却利福平敏感,用传统的治疗方案会降低治愈率,这将增加MDR-TB发生的概率[20]。 综上所述,XpertMTB/RIF试验在检测MTB和利福平耐药方面均与金标准表现出良好的一致性。且与传统方法相比,具有检测耗时短,生物安全级别高,成本低廉等优点。适合在我国基层实验室推广。目前XpertMTB/RIF试验在国内尚处于试验阶段,还没有普遍在临床实验室中得到推广,且已发表的中文相关文献较少。因此有待在国内开展更多的此类研究,为其在国内的临床应用提供更多的可靠数据。 参考文献 [1]WHO.Global tuberculosis report 2015[EB/OL].[2015-07-30].http://www.who.int/tb/publications/global_report/en/.html. [2]WHO.Supplement:Global tuberculosis report 2014.Drug-resistant TB Surveillance&response[EB/OL].[2015-07-09].http://apps.who.int/iris/bitstream/10665/137095/1/WHO_HQ_TB_2014.12_eng.pdf?ua=1.html. [3]WHO.TB diagnostics and laboratory strengthening[EB/OL].[2015-07-09].http://www.who.int/tb/laboratory/en/.html. [4]Lawn SD.Nicol MP.Xpert(R)MTB/RIF assay:development,evaluation and implementation of a new rapid molecular diagnostic for tuberculosis and rifampicin resistance[J].Future Microbiol,2011,6(9):1067-1082. [5]WHO.Global tuberculosis control 2010[R].Geneva:WHO Press,2010. [6]Havlir DV,Getahun H,Sanne I,et al.Opportunities and challenges for HIV care in overlapping HIV and TB epidemics [J].JAMA,2008,300(4):423-430. [7]Dye C,Williams BG.The population dynamics and control of tuberculosis[J].Science,2010,328(5980):856-861. [8]Lonnroth K,Castro KG,Chakaya JM,et al.Tuberculosis control and elimination 2010-50:cure,care,and social development [J].Lancet,2010,375(9728):1814-1829. [9]Boehme CC,Nabeta P,Hillemann D,et al.Rapid molecular detection of tuberculosis and rifampin resistance[J].N Engl Med,2010,363(11):1005-1015. [10]张治国,欧喜超,孙倩,等.利福平耐药实时荧光定量核酸扩增技术检测痰标本中结核分枝杆菌及其耐药性的研究[J].中国防痨杂志,2013,35(1):13-16. [11]Bowles EC,Freyee B,Van Ingen,et al.Xpert MTB/RIF,anovel automated polymerase chain reaction-based tool forthe diagnosis of tuberculosis [J].Int Tuber Lung Dis,2011,15(7):988-989. [12]Blakemore R,Story E,Helb D,et al.Evaluation of the analytical performance of the XpertMTB/RIF assay[J].Clin Microbiol,2010,48(7):2495-2501. [13]Helb D,Jones M,Story E,et al.Rapid detection of Mycobacterium tuberculosis and rifampin resistance by use of on-demand,near-patient technology[J].J Clin Microbiol,2010,48(1):229-237. [14]Lawn SD,Mwaba P,Bates M,et al.Advances in tuberculosis diagnostics:the Xpert MTB/RIF assay and future prospects for a point-of-care test[J].Lancet Infect Dis,2013,13(4):349-361. [15]WHO.Policy statement:automated real-time nucleic acid amplification technology for rapid and simultaneous detection of tuberculosis and rifampicin resistance:XpertMTB/RIF System[R].Geneva:WHO Press,2011. [16]WHO.Policy statement:Xpert MTB/RIF system[EB/OL].[2014-03-20].http://who.int/publications/2011/97892415-01545_eng.pdf.html. [17]WHO.Policy update:Xpert MTB/RIF assay for the diagnosis of pulmonary and extrapulmonary TB in adults and children[EB/OL].[2015-05-27].http://apps.who.int/iris/bitstream/10665/112472/1/9789241506335_eng.pdf?ua=1.html. [18]Pai M,Palamountain KM.New tuberculosis technologies:challenges for retooling and scale-up[J].Int J Tuberc Lung Dis,2012,16(10):1281-1290. [19]欧喜超,夏辉,李强,等.结核分枝杆菌及利福平耐药核酸扩增检测成本分析[J].中国防痨杂志,2013,35(9):723-728. [20]Gegia M,Cohen T,Kalandadze I,et al.Outcomes among tuberculosis patients with isoniazid resistance in Georgia,2007-2009[J].Int J Tuberc Lung Dis,2012,16(6):812-816. The application of XpertMTB/RIF in TB diagnosis and rifampicin resistance testing LiuTing,WengGuihua,Chenyi,GuoXiana,DengJunli (DepartmentofClinicalLaboratory,Bao′anHospitalofChronicDiseasesControlandPrevention,Shenzhen,Guangdong518102,China) Abstract:ObjectiveTo evaluate the accuracy of XpertMTB/RIF assay in the diagnosis of tuberculosis and detection of rifampin resistance.MethodsAtotal of 196 initial diagnosis patients were recruited,sputum samples of these patients were tected by smear,solid culture,traditional proportion method drug susceptibility test and XpertMTB/RIF test.The sensitivity and specificity of XpertMTB/RIF method in detecting mycobacterium tuberculosis(MTB) and refampin resistance,and the consistency of this method comparted with the gold standard were andyzed.ResultsAccording to the solid culture result,the sensivivity and specificity of XpertMTB/RIF test in detecting tuberculosis were 94.62%(123/130) and 87.88%(58/66),kappa was 0.828;according to conventional drug susceptibility test result,the sensitivity and specificity in detecting rifampin resistance were 73.33%(11/15)and 96.30%(104/108)respectively,kappa was 0.696.ConclusionThe XpertMTB/RIF test has very high sensitivity and specificity,which also has a good consistency with the traditional method.It is a more efficient,rapid,safer and more cost-effective diagnosis tool for MTB and Rifampicin resistant. Key words:XpertMTB/RIF;mycobacterium tuberculosis;rifampin DOI:10.3969/j.issn.1673-4130.2016.10.027 文献标识码:A 文章编号:1673-4130(2016)10-1368-03 (收稿日期:2015-11-04) 作者简介:刘存芬,女,副主任技师,主要从事临床生化检验方向的研究。