力经PSGL-1介导ERM蛋白ITAM-like序列上磷酸化位点的暴露*
2016-06-23吴建华邝晓敏刘文平方颖
吴建华 邝晓敏 刘文平 方颖
(华南理工大学 生物科学与工程学院, 广东 广州 510006)
力经PSGL-1介导ERM蛋白ITAM-like序列上磷酸化位点的暴露*
吴建华邝晓敏刘文平方颖
(华南理工大学 生物科学与工程学院, 广东 广州 510006)
摘要:炎症反应阶段,P-选择素糖蛋白配体1(PSGL-1)与埃兹蛋白/根蛋白/膜突蛋白(ERM)的结合在招募脾酪氨酸激酶(Syk)并促进白细胞激活中发挥了重要作用.文中通过晶体结构分析发现,位于ERM蛋白非传统的免疫受体酪氨酸活化基序(ITAM-like)上的两个磷酸化位点(Y191和Y205)周围存在较大的空间位阻,这将阻碍其被Src家族激酶酪氨酸磷酸化继而招募Syk的过程.文中用拉伸分子动力学模拟的方法模拟力学环境下PSGL-1与根蛋白FERM结构域的相互作用,构象分析和残基溶剂可及表面积的变化都表明,经由PSGL-1传导的力学信号可以介导根蛋白ITAM-like序列上磷酸化位点Y205的暴露.文中结果揭示了一条经由PSGL-1胞内域激活Syk的力学信号通路,并且在原子层面上对PSGL-1/ERM/Syk之间的相互作用给予了阐释.
关键词:PSGL-1;ERM蛋白;Syk;ITAM-like序列;拉伸分子动力学模拟
炎症反应过程中,选择素通过与P-选择素糖蛋白配体1 (PSGL-1)的结合介导了白细胞在内皮细胞上的初始拴缚和快速滚动[1-2].白细胞滚动过程中,选择素与PSGL-1的结合会引起胞内一系列信号的传导,包括脾酪氨酸激酶(Syk)的招募和磷酸化[3- 4],继而把信号传递到下游分子并诱导整合素构象伸长从而将其激活,促使白细胞在内皮细胞上的缓慢滚动,最终彻底激活白细胞使其发挥免疫学功能[5-7].
作为整合素激活和白细胞活化信号传导过程中的重要分子[8-9],Syk通常被免疫受体酪氨酸活化基序(ITAM,YxxI/Lx(6-12)YxxI/L)活化,即通过其双重Src同源区2 (SH2 )结构域与酪氨酸磷酸化的ITAM相结合而激活[6,8],所以ITAM序列磷酸化位点的暴露并磷酸化对于Syk的活化至关重要.而一些非传统的ITAM序列(ITAM-like序列)也陆续被证实与传统的ITAM序列有着相似的功能,并且在某些情况下单个酪氨酸残基就足以引起Syk的招募[10-11].
研究表明,在血流环境中白细胞的缓慢滚动需要PSGL-1的胞内域[7-8],PSGL-1胞内域能够通过埃兹蛋白/根蛋白/膜突蛋白(ERM)家族的ITAM-like序列与Syk结合并介导其激活[3,12].ERM蛋白作为桥梁分子,能够把细胞膜上整合膜蛋白与细胞骨架之肌动蛋白连接在一起,通过介导肌动蛋白细胞骨架与细胞质膜的连接调控信号分子的传导[13].
鉴于PSGL-1与ERM蛋白的结合在招募Syk并促进整合素和白细胞激活中发挥的重要作用,Takai等[14]在2007年结晶出了鼠源的PSGL-1胞内域近膜端与根蛋白FERM结构域的复合物晶体结构,并从原子水平上对于二者之间的相互作用进行了分析.根蛋白的ITAM-like序列位于FERM结构域中,并且包含了结合Syk分子的两个磷酸化位点Y191和Y205.
但是通过晶体结构的分析笔者发现,根蛋白上的ITAM-like序列周围存在较大的空间位阻,尤其两个重要的磷酸化位点Y191和Y205更是被包埋在蛋白里面,这将严重阻碍Y191和Y205的磷酸化过程,从而阻碍ITAM-like序列对Syk的招募,所以外界扰动导致的构象改变是必须的.
目前愈来愈多的证据表明,白细胞所处血流环境中的流体剪切力是一种非常重要的物理信号,与化学信号一起在白细胞激活过程中发挥着重要作用[15-17];但力学信号与化学信号耦合并调控下游信号通路的机理至今尚未清晰.这里,笔者猜测由PSGL-1胞内域传导的力学信号可能激发其近膜端所连接的ERM蛋白上ITAM-like序列的打开,为后续的磷酸化和招募Syk提供结构构象上的便利.为验证上述猜想,笔者采用分子动力学模拟的方法模拟力学环境下PSGL-1与FERM蛋白的相互作用及PSGL-1/FERM复合物的构象演变,发现正如实验所测量的[14],PSGL-1与FERM存在较强的相互作用,且在该复合物解离之前,力学信号可以有效地打开ITAM-like序列进而介导其上一个重要的磷酸化位点(Y205)的暴露.这对于后续的磷酸化和Syk的结合有着重要的意义.
1材料与方法
1.1系统的建立
模拟体系由分子可视化操作软件(VMD)[18]搭建,所用晶体结构从PDB晶体库下载,为PSGL-1胞内近膜端与根蛋白FERM结构域相结合的PSGL-1/FERM复合物[14](见图1(a),PDB ID为2EMT,分辨率为0.28 nm).
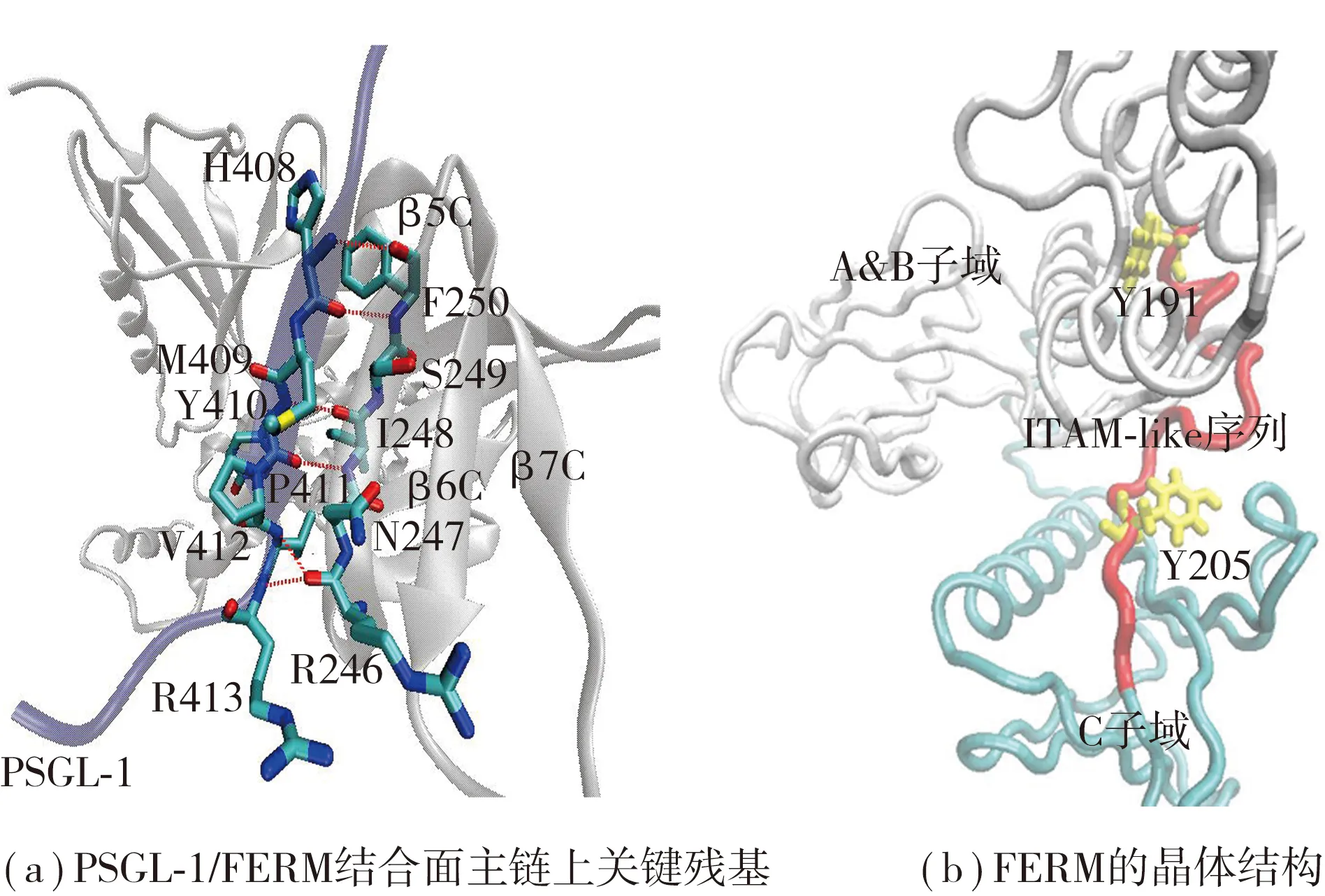
图1 PSGL-1/FERM复合物和FERM结构域的晶体结构Fig.1 Crystal structures of PSGL-1/FERM complex and FERM domain
首先对PSGL-1/FERM进行坐标调整:把FERM碳端Cα原子(S313)作为固定原子,固定在原点,用于模拟ERM蛋白与细胞骨架蛋白之间稳定的相互作用;把PSGL-1的氮端Cα原子(R402)作为拉伸原子,调整到x轴上,用于模拟PSGL-1与外界的相互作用.调整坐标后的复合物溶解于尺寸为16.56 nm×9.68 nm×9.56 nm 的TIP3水框中,按照0.152 mol/L的生理浓度加入NaCl,最终得到原子数为145 099的体系.
1.2分子动力学模拟
采用纳米尺度分子动力学软件(NAMD)[19]在CHARMM27[20]力场中进行模拟,运用埃瓦尔德粒子网格算法(PME)计算静电相互作用,范德华力作用截止值设定为1.2 nm.经过了能量最小化后,PSGL-1/FERM复合物体系接着进行了50 ns的能量平衡,并控制温度为310 K,压力为1.01×105Pa.在平衡过程中,PSGL-1/FERM复合物Cα原子均方根偏差(RMSD)渐趋稳定,说明复合物在模拟的生理环境中已基本平衡(见图2(a)).
为研究PSGL-1/FERM复合物在外力作用下的构象变化和原子间相互作用的改变,笔者对平衡后的复合物进行3次恒速度拉伸,拉伸步长为2 fs/步,拉伸速度为0.5 nm/ns,拉伸方向为x轴正方向,虚拟原子与拉伸原子间的弹簧系数为69.48 pN/nm.每次拉伸时间不特别设定,直到PSGL-1与FERM解离为止.
1.3数据分析方法
数据分析过程中,以溶剂可及表面积(SASA)来表征拉伸过程中FERM上ITAM-like序列和活性位点的暴露程度,SASA是生物分子暴露于溶剂中的表面积,SASA越大表明分子越暴露于溶剂中,与其他分子接触的可能性越大.氢键定义为:若供体原子与受体原子之间的距离小于0.35 nm且它们之间的夹角小于30°,则认为供体原子与受体原子之间存在氢键.氢键生存率(H)则定义为氢键在模拟过程中的累计形成时间(t1)与模拟时间(t2)之比,即:
(1)
2结果与分析
2.1静态构象分析
本研究的复合物中,PSGL-1胞内域近膜端由16个氨基酸组成(编号402—417),其与根蛋白的FERM结构域(编号1—313)形成了稳定的构象.FERM包含与PSGL-1以及诸多粘附分子的结合位点,由A、B、C 3个子域构成.PSGL-1与C子域上的β5C折叠片形成了一个反向平行的β-β相互作用面,并且该接触面主要是由氢键相互作用介导的[14],如图1(a)所示. 图1中,灰色部分为FERM结构,红色虚线为关键残基.
细胞内游离的Syk一旦遇到传统的ITAM序列或者非传统的ITAM-like序列,便会与之结合,实现Syk的招募过程[9-11],但实现这种过程的前提是ITAM序列先被磷酸化.那么,静态条件下,ITAM序列特别是其磷酸化位点能否暴露?周围是否存在与Syk结合的构象空间?为此,笔者对FERM的静态晶体结构进行了分析,发现ITAM-like序列(编号191—208,红色,Tube模型)作为铰链区把子域B和C连接起来,其上的两个磷酸化位点Y191和Y205(黄色,licorice模型)却分别被B子域和C子域包埋起来(见图1(b)).可以想象,由于空间位阻效应,即使ERM蛋白与Syk在细胞内相遇,若其磷酸化位点不暴露的话,ITAM-like序列是很难被磷酸化的.静态条件下的这种包埋结果提示:力或许在ITAM-like序列磷酸化并招募Syk过程中发挥着重要作用. 因此笔者拟采用分子动力学模拟的方法观察复合物在没有外力作用和有外力作用情况下的动态变化.
2.2PSGL-1/FERM复合物的结构稳定性
笔者首先对系统进行了50 ns的平衡,此时无任何外力作用.通过对PSGL-1/FERM复合物重原子的RMSD分析可以看出,在10 ns之后该复合物已经基本稳定,如图2(a)所示.
晶体结构分析表明PSGL-1/FERM接触面上的氢键相互作用主导了复合物的形成[14],那么复合物在平衡过程中的高度稳定是否也与这些氢键稳定性有关?为此,笔者对接触面处的氢键数目及其生存率进行了分析,发现在平衡过程中不仅接触面间的氢键数目保持了较高的稳定性,基本维持在8个左右(见图2(b)),且静态分析中观察到的重要氢键[14]均得到了保留. 表1列举了氢键生存率排名前10位的氢键,其中TYR410、VAL412 和HSD408 所贡献的氢键均被证明对复合物的稳定性有着重要的意义,而ARG405则是突变实验所验证的重要残基[14].上述结果表明,在动态平衡中,复合物不仅保留了晶体结构静态观察到的氢键相互作用,且结合较牢固,因此可对复合物进一步展开拉伸分子动力学模拟.
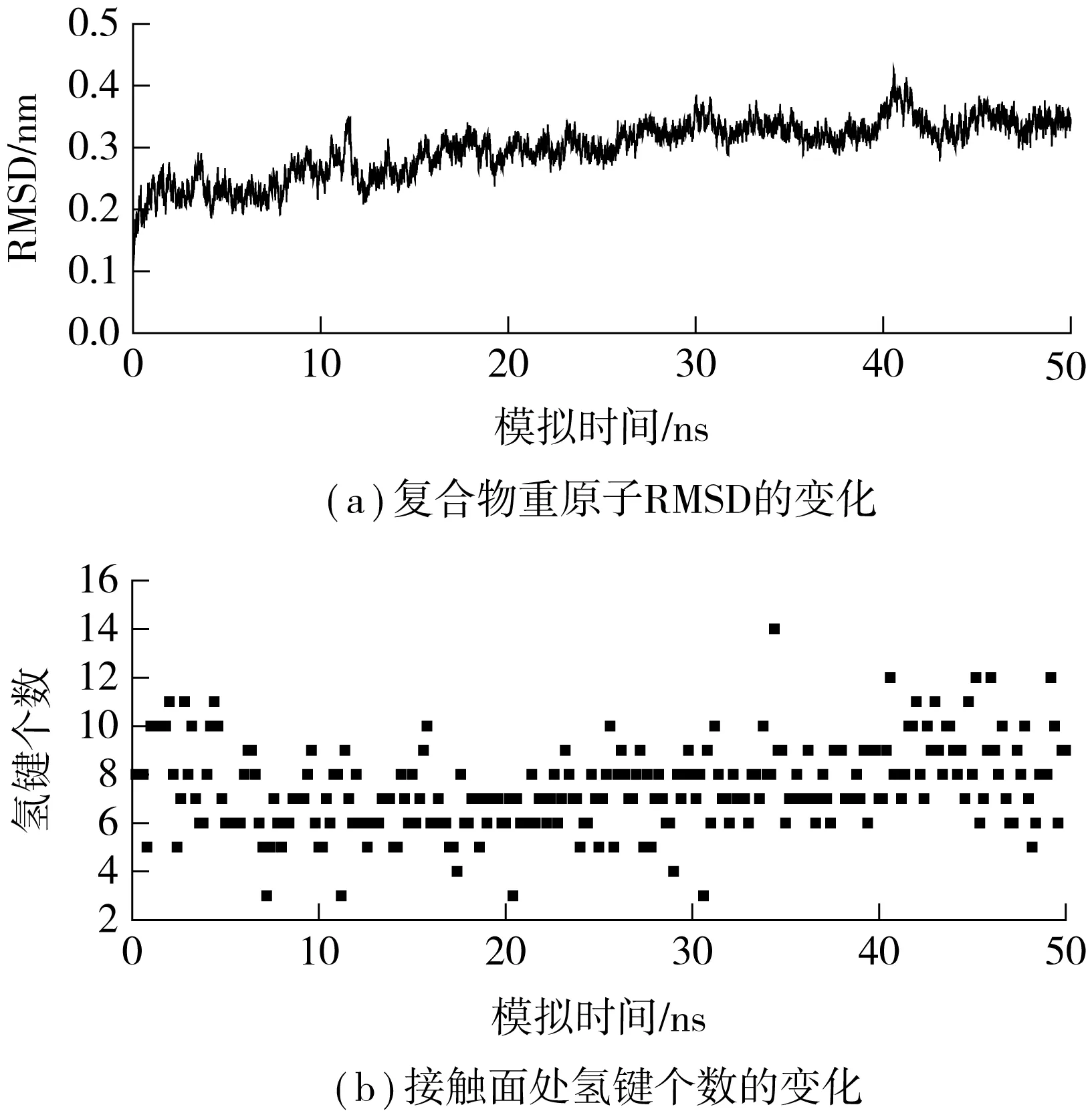
图2 平衡过程中PSGL-1/FERM复合物的RMSD和氢键的时间历程Fig.2 Time-courses of RMSD and H bond number during PSGL-1/FERM equilibrium
表1平衡过程中氢键生存率排名前10位的氢键
Table 1The top ten H bonds with their survival ratio detected in equilibrium

排名PSGL-1残基供体原子FERM残基受体原子氢键生存率/%1TYR410NILE248O88.702TYR410OILE248N88.403VAL412NARG246O66.154TYR410OHHSD288ND163.015HSD408OPHE250N45.606ARG413NH1SER243O43.527HSD408NPHE250O40.788ARG405NH1ASP252OD235.999ARG405NH2ASP252OD134.8610ARG405NH1ASP252OD132.73
2.3恒速度拉伸过程中的PSGL-1/FERM复合物
为了解外力对蛋白分子相互作用的影响及观察复合物在外力作用下的构象变化,笔者对平衡后的复合物进行了3次恒速度拉伸,计算分析拉伸过程中拉力和接触面氢键数目的变化,结果大致相同,其时间历程如图3所示.图3(a)-(c)分别示出了3次SMD中拉力的变化,其中每一个力谱分别代表彼此独立的模拟事件;图3(d)-(f)分别示出了3次SMD中接触面氢键个数的变化.拉伸过程的前20 ns左右,拉力随时间不断上升,但接触面的氢键个数却类似前面的平衡态保持相对稳定;但拉伸进行到20 ns以后,伴随着拉力的突然下降,氢键个数急剧下降,最终下降为0,表明复合物已基本解离,解离时间集中在20~29 ns之间,解离力集中在250~300 pN之间.
拉力促使复合物的突然解离,其中伴随着怎样的构象变化?为了回答这个问题,笔者对拉伸过程中PSGL-1/FERM复合物的结构变化进行了细致分析,发现在3次恒速度拉伸过程中,复合物都是先解折叠后解离.这里展示其中一次拉伸过程中的构象演化(见图4). 图4(a)-(d)分别代表SMD进行到0、12、17和27 ns时FERM结构域的构象变化. ITAM-like序列(红色,Tube模型)在拉伸过程中发生暴露.在拉伸的初始阶段,FERM的α1C螺旋(紫色,NewRibbons模型)和α螺旋(蓝色,New-Ribbons模型)都保持着螺旋状态(见图4(a));但拉伸进行到12 ns左右时α螺旋开始发生解折叠(见图4(b));当α螺旋完全解折叠后,拉力继续上升,一旦克服了能量障碍,α1C螺旋也接着发生部分解折叠(见图4(c)、(d)),拉力能使α螺旋发生完全解折叠,却不足以使α1C螺旋也发生完全解折叠.随着局部结构的解折叠,拉力持续上升至250~300 pN,此时复合物不敌外力而发生解离.
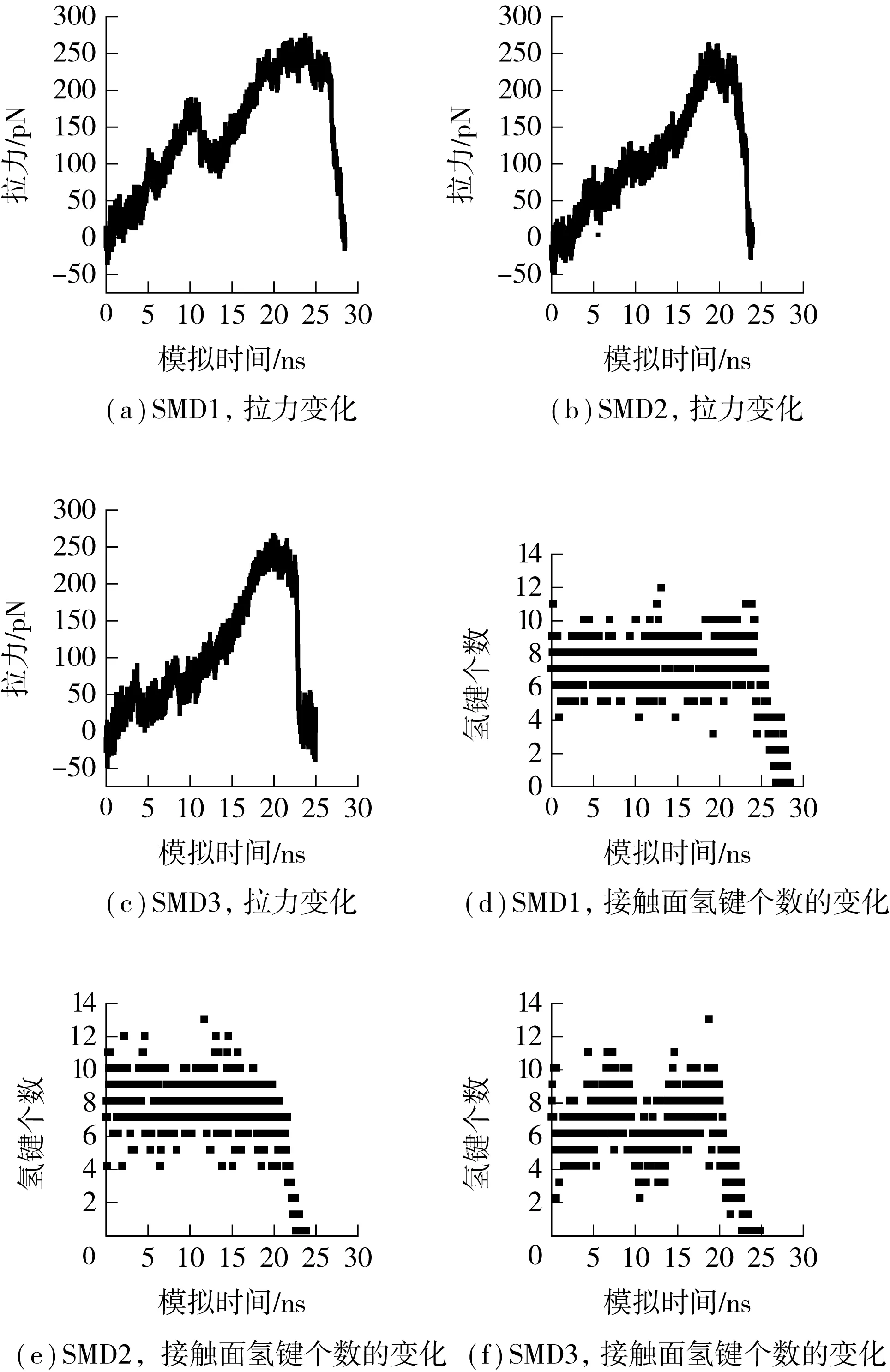
图3 3次SMD过程中拉力和氢键的时间历程Fig.3 Time-courses of force and H bond number in three SMD
2.4磷酸化位点Y205的暴露
2.4.1构象分析
PSGL-1与FERM解离前的解折叠过程一方面验证了PSGL-1与FERM复合物的牢固结合,另一方面也提示该解折叠过程可能有利于ITAM-like序列的打开以及其上磷酸化位点的暴露.通过对3次拉伸过程中ITAM-like序列及其磷酸化位点的模拟轨迹进行分析发现:在PSGL-1/FERM复合物的构象演变过程,FERM上的ITAM-like序列随着解折叠的进行逐步被打开(见图4).拉伸前,ITAM-like序列像一条蜷曲的绳子一样,包埋在B子域和C子域之间并把B子域和C子域连接起来(见图4(a));随着拉伸的进行,C子域逐渐远离B子域,此时ITAM-like序列像绳子一样被“拉直”并被“抽离”出来,在复合物解离前,拉伸时间越长,拉力越大,ITAM-like序列被拉得越直,拉得越开,在溶剂中的暴露程度越大(见图4(b)-(d)).
同时,原本包埋在FERM中的磷酸化位点Y205随着解折叠的进行也不断被暴露,与ITAM-like序列类似,在复合物解离前,拉伸时间越长,拉力越大,Y205的暴露程度越大(见图5(a)-(d),分别代表SMD进行到0、10、20 和30 ns时FERM结构域的构象变化).3次SMD均能观察到ITAM-like序列(红色,Tube模型)和Y205(黄色,Licorice模型)的暴露,却不能观察到Y191(黄色,Licorice模型)的暴露,由始至终,Y191一直被包埋在蛋白质里面,并且朝向都向内(见图5).
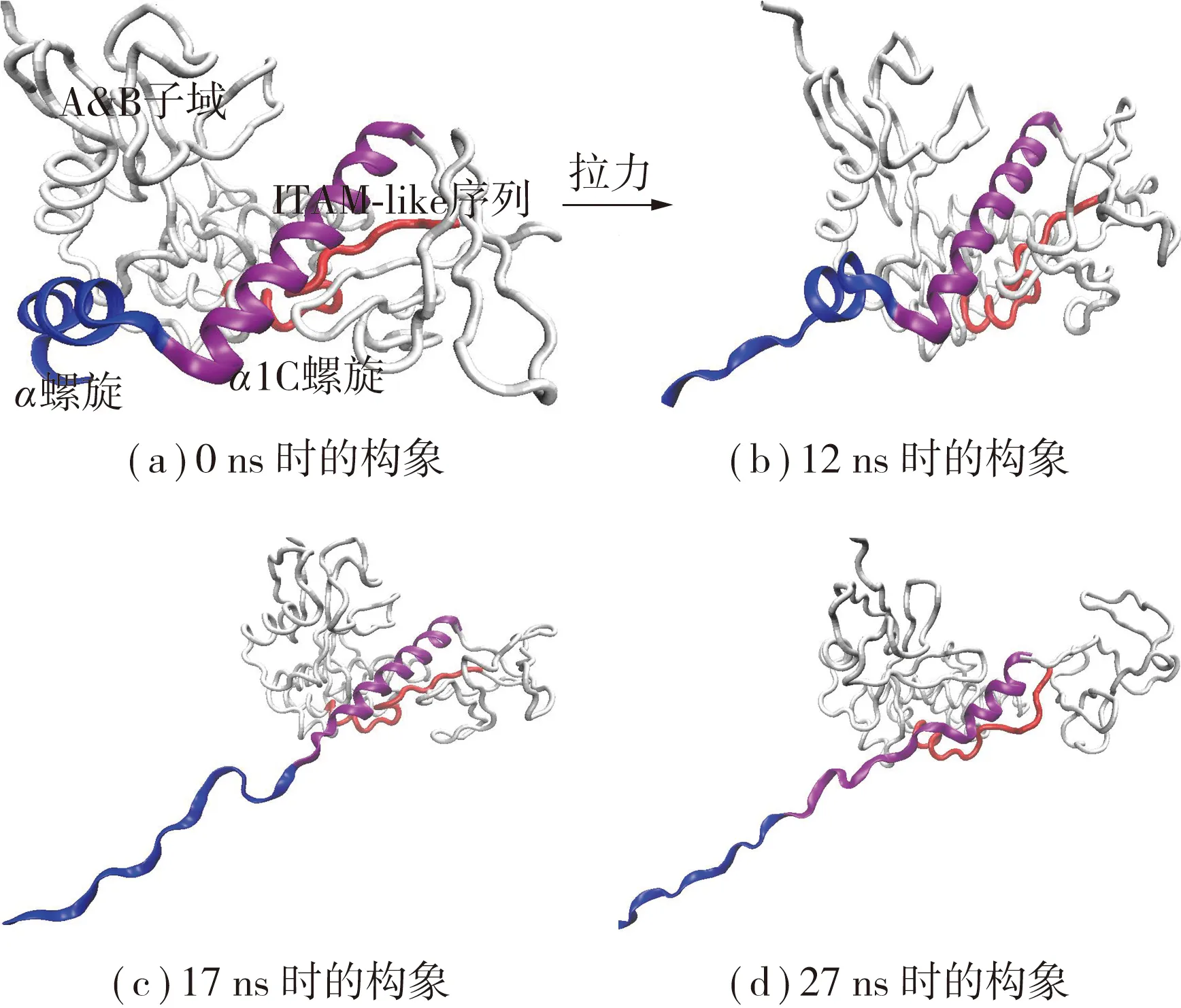
图4 SMD过程中FERM结构域的构象变化Fig.4 Conformational changes of FERM domain during SMD
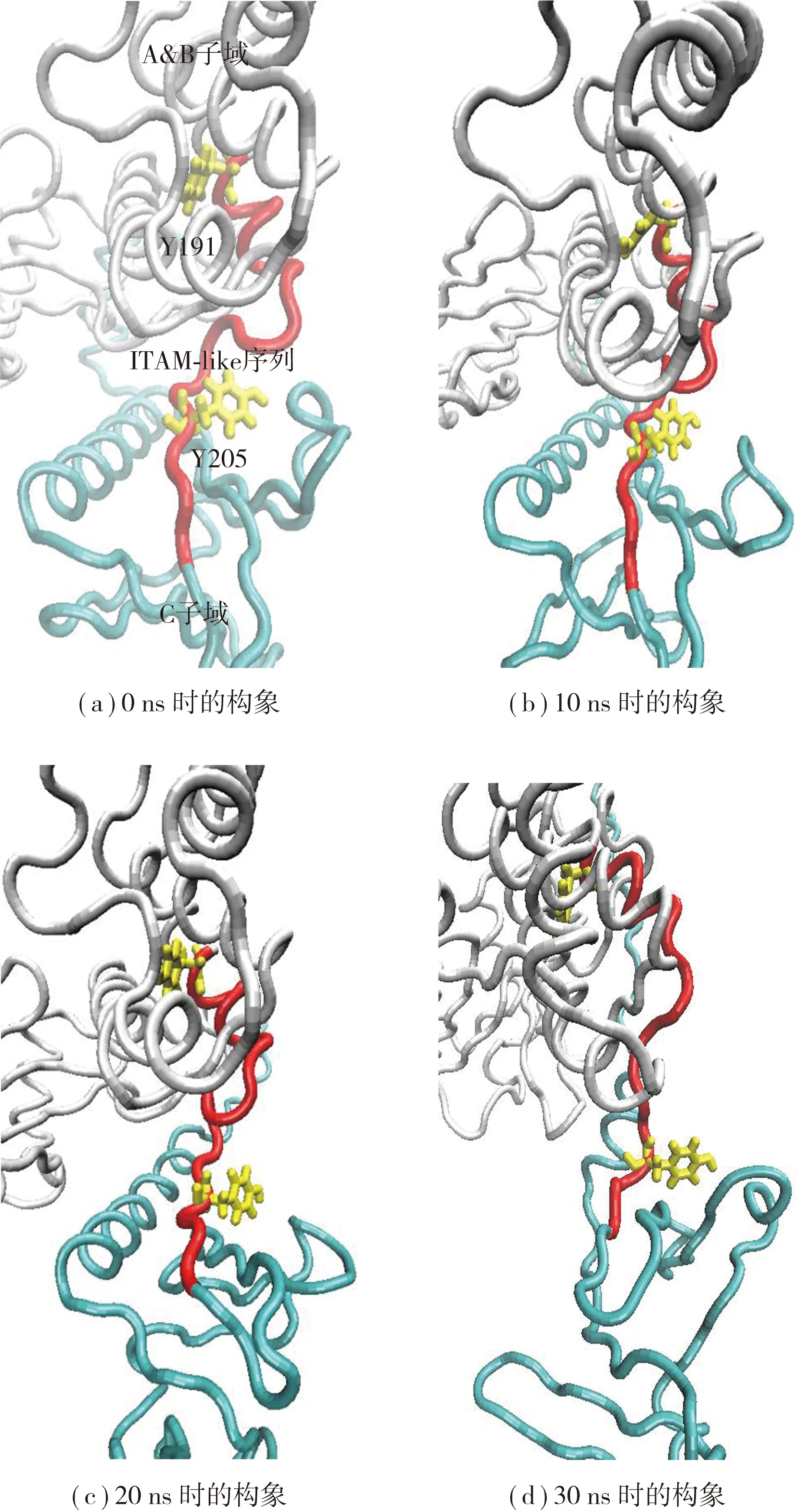
图5 SMD过程中磷酸化位点Y205的暴露Fig.5 Exposition of phosphorylation site Y205 during SMD
2.4.2SASA值分析
为了探明外力对ITAM-like序列、Y191和Y205暴露程度的影响,以半径为0.14 nm的水分子作为探针分子,对三者在静态、无外力动态平衡过程及有外力拉伸过程的SASA值进行计算和跟踪分析.在静态的晶体结构中,ITAM-like序列、Y191和Y205的SASA值分别为6.308、0.032和0.395 nm2,表明静态条件下ITAM-like序列及其磷酸化位点周围确实存在较大空间位阻.
图6展示的是50 ns平衡和3次恒速度拉伸中ITAM-like序列、Y191和Y205的SASA时间历程.可以看出,无外力作用的平衡过程中三者的SASA值都基本处于平均值上下,波动幅度不大,说明平衡过程中三者并未发生暴露(见图6(a)、(e)、(i)).而它们在3次恒速度拉伸时SASA值的时间历程则表现了很大的区别:ITAM-like序列(见图6(b)-(d))和Y205(见图6(j)-(l))的SASA值都有明显的增大,前者从最初的8.00 nm2最大能增加到13.00 nm2左右,后者从最初的0.35 nm2最大能增加到1.80 nm2左右,且波动幅度加剧;但Y191的SASA值相对变化不大,一直保持在0.18 nm2以下(见图6(f)-(h)).
笔者进一步对三者平衡及恒速度拉伸过程的SASA值进行统计分析,用平均值和标准误差表示,发现:ITAM-like序列在平衡及拉伸过程的值分别为(7.703 2±0.034 2) nm2和(9.379 0±0.075 5) nm2,SASA增加约22%,u检验结果为P<0.01,两者具有极显著的统计学差异;Y205的SASA值分别为(0.391 2±0.007 0) nm2和(0.683 9±0.021 3) nm2,SASA增加近75%,两者之间统计学差异极其显著;Y191的SASA值分别为(0.047 9±0.001 6) nm2和(0.042 0±0.002 3) nm2,虽然两者之间差异有统计学意义(0.01 以上结果显示,力是促使ITAM-like序列磷酸化并招募Syk的重要条件:血流环境下,PSGL-1胞外区不断受到流体剪应力和选择素的作用,并通过胞内域把力学信号传递给ERM蛋白,使原本包埋在蛋白里的ITAM-like序列特别是Y205发生暴露,增大了其被磷酸化并与Syk结合的可能性,为ERM蛋白招募Syk提供了条件. 图6 平衡和SMD过程中SASA的时间历程Fig.6 Time-courses of SASAs in equilibrium and three SMD 3讨论 ITAM最初被定义为T细胞受体、B细胞受体和Fc受体胞质尾信号链的共同序列.如今,YxxL/Ix(6-12)YxxL/I序列在许多受体和跨膜蛋白的胞内区被发现,并在下游的信号传导中扮演着关键的角色[21].当受体受刺激以后,ITAM序列通常先被Src家族激酶酪氨酸磷酸化,然后含有SH2结构域的蛋白(主要是Syk酪氨酸激酶家族)会结合到磷酸化的ITAM上[22-23],所以ITAM序列磷酸化位点的暴露对于启动下游信号至关重要.PSGL-1的胞内域缺乏传统的ITAM序列,但可以通过其胞内近膜端与带有非传统的ITAM-like序列的ERM蛋白结合而招募Syk[3,12].同时PSGL-1又是一个力学传感器,能转导外部血流的力学信号,而目前对于力如何与化学信号耦合在PSGL-1/ERM招募Syk中的作用尚不清楚.因此,笔者采用分子动力学模拟的方法,通过比较PSGL-1/FERM复合物平衡过程与拉伸过程中接触面残基的相互作用和构象变化,希望在原子水平上再现血流环境所呈递的力学影响,探明力学信号在ERM蛋白招募Syk中的作用和寻找可能的分子结构机制. 晶体结构分析表明,PSGL-1与ERM蛋白结合是比较牢固的,且在整个动态平衡过程中始终保持了较高的结构稳定性(见图2(a))和氢键生存率(见表1),氢键数目也十分保守(见图2(b)),从一个侧面证明PSGL-1/ERM复合物在信号传导过程中的重要作用.无论在静态晶体结构还是动态平衡过程中,ERM蛋白ITAM-like序列上两个磷酸化位点Y191和Y205都是包埋在FERM里面的(见图1(b),图6(a)、(e)、(i)),由于空间位阻效应,即使Syk与之相遇也很难实现对其的磷酸化过程.然而在外力作用下,复合物构象不再稳定,ERM蛋白会发生一个先解折叠、后解离的过程(见图4).在解折叠过程中ITAM-like序列和Y205会随着拉伸的进行逐渐被暴露(见图4、5),相应地,ITAM-like序列和Y205的SASA也显著增大(见图6),说明拉力会有效促进ITAM-like序列和Y205的暴露,为磷酸化和招募Syk提供了可能. PSGL-1通过其ERM蛋白结合区与ERM蛋白FERM结构域的C子域相结合[14],所以在恒速度拉伸过程中力首先经由PSGL-1传递至C子域,使其逐渐远离B子域,而ITAM-like序列作为连接B子域和C子域的铰链,伴随着C子域的远离逐渐像绳子一样被“拉直”被“抽离”出来,最终很大程度地暴露于溶剂中(见图4).Y205位于ITAM-like序列上,被C子域包埋,并且比较靠近PSGL-1/FERM结合区,拉力使C子域在拉伸过程“打散”,导致了Y205的暴露(见图5).构象分析和SASA变化都表明,Y191始终被包埋在蛋白里面,这很可能是因为Y191的朝向一直向内并远离PSGL-1/FERM结合区,加上其周围存在比较复杂的构象环境,使力学信号很难传递到Y191使之暴露. 4结语 本研究提出了一个力-化学耦合过程:在炎症发生过程中,选择素/PSGL-1的结合介导白细胞在内皮细胞上的快速滚动,并通过PSGL-1胞内域把力学信号传导给ERM蛋白,使原本包埋在FERM的ITAM-like序列特别是磷酸化位点Y205逐步暴露,为其磷酸化并与Syk的结合提供了最大的空间可能.本研究揭示了一条经由PSGL-1胞内域激活Syk的力学信号通路,并且在原子层面上对于PSGL-1/ERM/Syk之间的相互作用给予了阐释,这为PSGL-1/ERM/Syk介导的下游信号的深入研究以及基于三者结构的药物设计和筛选提供了重要参考. 参考文献: [1]LEY K,LAUDANNA C,CYBULSKY M I,et al. Getting to the site of inflammation:the leukocyte adhesion cascade updated [J]. Nature Reviews Immunology,2007,7(9):678-689. [2]WALCHECK B,MOORE K L,MCEVER R P,et al. Neutrophil-neutrophil interactions under hydrodynamic shear stress involve L-selectin and PSGL-1. a mechanism that amplifies initial leukocyte accumulation of P-selectin in vitro [J]. Journal of Clinical Investigation,1996,98(5):1081. [3]URZAINQUI A,SERRADOR J M,VIEDMA F,et al. ITAM-based interaction of ERM proteins with Syk me-diates signaling by the leukocyte adhesion receptor PSGL-1 [J]. Immunity,2002,17(4):401-412. [4]ABBAL C,LAMBELET M,BERTAGGIA D,et al. Lipid raft adhesion receptors and Syk regulate selectin-depen-dent rolling under flow conditions [J]. Blood,2006,108(10):3352-3359. [5]WANG H-B,WANG J-T,ZHANG L,et al. P-selectin primes leukocyte integrin activation during inflammation[J]. Nature Immunology,2007,8(8):882-892. [6]ZARBOCK A,ABRAM C L,HUNDT M,et al. PSGL-1 engagement by E-selectin signals through Src kinase Fgr and ITAM adapters DAP12 and FcRγ to induce slow leukocyte rolling [J]. The Journal of Experimental Medicine,2008,205(10):2339-2347. [7]MINER J J,XIA L,YAGO T,et al. Separable requirements for cytoplasmic domain of PSGL-1 in leukocyte rolling and signaling under flow [J]. Blood,2008,112(5):2035-2045. [8]YAGO T,SHAO B,MINER J J,et al. E-selectin engages PSGL-1 and CD44 through a common signaling pathway to induce integrin alphaLbeta2-mediated slow leukocyte rol-ling [J]. Blood,2010,116(3):485-494. [9]ZARBOCK A,LOWELL C A,LEY K. Spleen tyrosine kinase Syk is necessary for E-selectin-induced alpha(L)beta(2) integrin-mediated rolling on intercellular adhesion molecule-1 [J]. Immunity,2007,26(6):773-783. [10]SUZUKI-INOUE K,FULLER G L,GARCíA,et al. A novel Syk-dependent mechanism of platelet activation by the C-type lectin receptor CLEC-2 [J]. Blood,2006,107(2):542-549. [11]UNDERHILL D M,ROSSNAGLE E,LOWELL C A,et al. Dectin-1 activates Syk tyrosine kinase in a dynamic subset of macrophages for reactive oxygen production [J]. Blood,2005,106(7):2543-2550. [12]SERRADOR J M,URZAINQUI A,ALONSO-LEBRERO J L,et al. A juxta-membrane amino acid sequence of P-selectin glycoprotein ligand-1 is involved in moesin binding and ezrin/radixin/moesin-directed targeting at the trailing edge of migrating lymphocytes [J]. European Journal of Immunology,2002,32(6):1560-1566. [13]POLESELLO C,PAYRE F. Small is beautiful:what flies tell us about ERM protein function in development [J]. Trends in Cell Biology,2004,14(6):294-302. [14]TAKAI Y,KITANO K,TERAWAKI S I,et al. Structural basis of PSGL-1 binding to ERM proteins [J]. Genes to Cells,2007,12(12):1329-1338. [15]ALON R,DUSTIN M L. Force as a facilitator of integrin conformational changes during leukocyte arrest on blood vessels and antigen-presenting cells [J]. Immunity,2007,26(1):17-27. [16]SCHAFF U Y,YAMAYOSHI I,TSE T,et al. Calcium flux in neutrophils synchronizes beta2 integrin adhesive and signaling events that guide inflammatory recruitment [J]. Annals of Biomedical Engineering,2008,36(4):632-646. [17]NEHA D,ITSUKYO Y,ARI N,et al. Migrational gui-dance of neutrophils is mechanotransduced via high-affinity LFA-1 and calcium flux [J]. Journal of Immuno-logy,2011,187(1):472-481. [18]HUMPHREY W,DALKE A,SCHULTEN K. VMD:vi-sual molecular dynamics [J]. Journal of Molecular Graphics,1996,14(1):33-38. [19]PHILLIPS J C,BRAUN R,WANG W,et al. Scalable molecular dynamics with NAMD [J]. Journal of Computational Chemistry,2005,26(16):1781-1802. [20]MACKERELL A D,BASHFORD D,BELLOTT M,et al. All-atom empirical potential for molecular modeling and dynamics studies of proteins [J]. The Journal of Physical Chemistry B,1998,102(18):3586-3616. [21]ABRAM C L,LOWELL C A. The expanding role for ITAM-based signaling pathways in immune cells [J]. Science's STKE :Signal Transduction Knowledge Environment,2007,2007(377):re2. [22]BERTON G,MOCSAI A,LOWELL C A. Src and Syk kinases:key regulators of phagocytic cell activation [J]. Trends in Immunology,2005,26(4):208-214. [23]FüÜTTERER K,WONG J,GRUCZA R A,et al. Structural basis for Syk tyrosine kinase ubiquity in signal transduction pathways revealed by the crystal structure of its regulatory SH2 domains bound to a dually phosphorylated ITAM peptide [J]. Journal of Molecular Biology,1998,281(3):523-537. Exposition of Phosphotyrosine Site on ITAM-like Motif of ERM Proteins Mediated by Force Through PSGL-1 WUJian-huaKUANGXiao-minLIUWen-pingFANGYing (School of Biological Science and Engineering, South China University of Technology, Guangzhou 510006, Guangdong, China) Abstract:P-selectin glycoprotein ligand 1 (PSGL-1) engaged by ezrin-radixin-moesin (ERM) proteins plays an important role in recruiting spleen tyrosine kinase (Syk) and activating leukocyte in the process of inflammatory response.Firstly, the crystal structure of radixin FERM domain indicates that the steric effect on ITAM-like motif and phosphorylation sites (Y191 and Y205) can hamper their phosphorylation by Src family tyrosine kinase and their combination with Syk.Then, steered molecular dynamics (SMD) simulation is carried out to explore the interaction between the complex of PSGL-1 juxtamembrane peptide and radixin FERM domain under force load.Both conformation analysis and solvent accessible surface variant show that the mechanical signal transmitting through PSGL-1 cytoplasmic region can mediate the exposition of phosphotyrosine site Y205 on ITAM-like motif of radixin.The results of this study present a mechanical signal pathway from PSGL-1 cytoplasmic region to Syk and expound the interaction mechanism of PSGL-1/ERM/Syk at atomic level. Key words:PSGL-1; ERM protein; Syk;ITAM-like motif; steered molecular dynamics 收稿日期:2015- 09- 07*基金项目: 国家自然科学基金资助项目(31170887,11272125,11432006) Foundation items: Supported by the National Natural Science Foundation of China (31170887,11272125,11432006) 作者简介:吴建华(1959-) ,男,博士,教授,博士生导师,主要从事细胞与分子生物力学研究.E-mail:wujianhua@scut.edu.cn † 通信作者: 方颖(1966-),女,副教授,主要从事细胞与分子生物力学研究.E-mail:yfang@scut.edu.cn 中图分类号:Q66 doi:10.3969/j.issn.1000-565X.2016.03.018
