界面单层膜和囊泡双层膜中胆固醇对饱和磷脂膜的影响
2016-06-20孙润广
王 娟, 孙润广
(陕西师范大学 物理学与信息技术学院, 陕西 西安 710119)
界面单层膜和囊泡双层膜中胆固醇对饱和磷脂膜的影响
王娟, 孙润广*
(陕西师范大学 物理学与信息技术学院, 陕西 西安 710119)
摘要:利用界面Langmuir单层膜和大单层囊泡的双层膜研究了不同含量胆固醇对饱和磷脂DPPC膜的影响,以及胆固醇与DPPC的相互作用。在双层膜模型中,使用DPH荧光探针标记膜,通过测量荧光稳态各向异性和荧光寿命,来探讨胆固醇对饱和DPPC双层膜流动性及微粘度的影响。在界面单层模型中,通过压力-面积曲线分析胆固醇对单层膜相变的影响,并计算吉布斯自由能实验值,与维里物态方程拟合得到理论参数相结合,讨论胆固醇与DPPC在膜上的相互作用。结果发现:加入少量胆固醇后,两种模型膜流动性降低,微粘度增大;胆固醇较高时,膜流动性转为增大,微粘度降低。当胆固醇摩尔比大于等于0.5时,流动性达到稳定。流动性的改变与胆固醇影响膜的相变过程有关,胆固醇分子和DPPC分子相互作用力的引力在胆固醇摩尔比为0.5时达到最大。
关键词:囊泡; Langmuir单层膜; 膜流动性; 相变; 胆固醇
PACS: 87.14.Cc
胆固醇可插入到膜中,其分子长轴平行于磷脂酰基链,故增大了酰基链的有序性,从而降低末端甲基原子团的包裹能力[1-4]。另外,胆固醇对磷脂膜也有调节作用[5]。但是大量胆固醇能够形成晶体状微区,这可能是造成动脉粥样硬化的原因[6]。饱和磷脂和甾醇类分子在体外可能自发地形成纳米级的晶体状微区[7]。在脂质体包裹药物方面,胆固醇发挥着稳定脂质体、提高包封率、降低释药率的有利作用[8-9]。所以,胆固醇对磷脂膜的影响研究不仅具有生物学意义,对药物脂质体制备也具有一定指导意义。
文献[10]报道了使用单层或者双层模型单独研究胆固醇对磷脂膜的动力学和相行为的影响,本文结合这两种模型膜,来研究不同摩尔比的胆固醇对饱和磷脂DPPC膜的影响。使用DPH荧光探针标记大单层囊泡膜,分析稳态荧光各向异性值和瞬态荧光寿命来研究胆固醇对双层膜流动性和微粘度的影响。而Langmuir单层膜作为双层膜的一半,用来研究胆固醇对DPPC膜相变的影响以及膜上分子间的相互作用。这两种方法的实验分析可为下一步研究胆固醇对蛋白质-脂相互作用提供基础。
1材料与方法
1.1试剂
高纯度1, 2-dipalmitoyl-sn-glycero-3-phosphorylcholine (DPPC), Cholesterol (Chol) 和1, 4-bis(5-phenyl-2-oxazolyl)benzene (POPOP) 购买于Sigma Chemical Co. (St. Louis, MO, USA)。荧光探针1,6-diphenyl-1,3,5-hexatriene (DPH) 来自Molecular Probes (Invitrogen Corporation, Carlsbad, California, USA)。所有试剂使用时均未作进一步提纯。实验所用水均为由Milli-Q 水提纯系统(18.2 MΩ/cm, Millipore, USA)获得的高纯水。
1.2大单层囊泡制备
大单层囊泡由超声薄膜分散法制得[11]。简单来说,不同比例的胆固醇和DPPC分子溶解在氯仿/甲醇(体积分数为5∶1)混合溶剂中。使用真空旋转蒸发仪蒸发溶剂,成膜后,放入真空干燥箱干燥。12 h后取出,用10 mmol/L pH 7.4 PBS缓冲液在40 ℃条件下旋转水化1 h。得到悬浮液,置于超声细胞粉碎仪中,冰浴0 ℃探头超声5 min(工作1 s, 间歇2 s, 功率200 W) 以减小粒径。超声后,使用200 nm的聚碳酸酯孔膜过滤并挤压大单层囊泡膜三次,得到200 nm囊泡。荧光标记脂质体制备方法同上,探针∶脂(摩尔比)为1∶320。制得的囊泡溶液在35 ℃温浴1 h,待测。
1.3稳态各向异性和瞬态荧光寿命
使用稳态瞬态荧光光谱仪(PTI,USA)测量。用360 nm波长激发样品,扫描发射波长460~500 nm。各向异性值由下式[12-13]给出
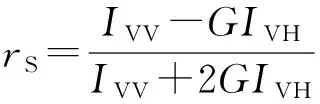
(1)
其中:IVV和IVH分别是激发光垂直测得的水平和垂直发射光偏振强度,IHV和IHH是激发光水平时测得的水平和垂直发射光偏振强度,G是校正因子,G=IHV/IHH。荧光寿命在375nm激发波长下测量。所有测量都使用POPOP作为拟合相关寿命(1.35ns)[14]。DPH荧光延迟曲线由双指数拟合法拟合得到荧光寿命。
1.4Langmuir单层膜技术
用Langmuir膜天平(KSV-Minitrough,Finland)研究空气-水界面膜单层的相行为。表面压力由滤纸(10mm×30mm×0.15mm) 制得的Wilhelmy型张力传感器测得,精度为0.1mN/m。亚相溶液使用10mmol/LTris-HCl缓冲液,pH值为7.4。用微量进样器将脂类溶液均匀地滴加在亚相液面上,使其自动迅速铺展,静置15min,待亚相上有机溶剂完全挥发后,以15mm/min的速度压膜。1.5维里物态方程分析
二维维里物态方程[15]如下

(2)
其中:b0、b1和b2是维里系数。b0与膜上分子聚集有关,b1与分子间相互作用相关,其他维里系数不重要。
对于混合单层膜,两种分子间的相互作用可通过以下公式[16]分析

(3)
其中:(b1)1和(b1)2分别是组分1和2的第二维里系数,(b1)12是表征两组分间相互作用的第二维里系数。
将(b1)12=[(b1)1+(b1)2]/2代入公式(3), 则获得理想值为

(4)

(b1)E=(b1)m-(b1)1X1-(b1)2X2。
(5)
(b1)E也被称为过量维里系数,为正值时,揭示混合分子间相互作用为引力。
2结果与讨论
2.1不同摩尔比胆固醇对DPPC囊泡膜流动性的影响
2.1.1稳态荧光各向异性脂质囊泡在35 ℃下恒温水浴1 h, 再测其探针各向异性值。如图1所示,加入少量Chol后,探针的荧光各向异性值明显降低,并且在Chol摩尔比为0.2时,达到最小值。但是,当Chol摩尔比超过0.2时,各向异性值随着Chol摩尔比的增大而增大,并且在摩尔比达到0.5时,达到最大值。各向异性值越大,囊泡膜的有序性越高,流动性越低。也就是说,在脂质囊泡中加入少量的Chol(摩尔比小于0.2)时,囊泡膜上的分子排列变得更加无序,使膜流动性增加。而加入Chol摩尔比超过0.2后,随着Chol量的增加,膜上分子排列的有序性增加,膜流动性降低。但是当Chol摩尔比达到0.5时,膜的有序性达到最高。有趣的是,探针DPH在纯DPPC囊泡膜上与其在含有0.3~0.4摩尔比Chol的DPPC囊泡膜上的各向异性值比较接近,而人体正常细胞膜上含有0.3摩尔比的Chol。可见,Chol不仅保证了生物膜上合适的流动性和有序性,也与其他分子相互作用参与到细胞活动中。而Chol含量过高,则会降低膜的流动性,可能导致动脉粥样硬化。这是因为在生物膜上,高含量的Chol可能会形成晶体状微区,导致膜流动性受到限制。
膜的流动性也可用微粘度评价。微粘度越大,表明膜的流动性越小。微粘度由下式计算得到
η=6r/(0.92-2.54r)。
(6)
其中,r是实验中测得的各向异性值。
图2显示膜流动性随Chol摩尔比的增大先增大后减小,且Chol摩尔比为0.2时,流动性最大,0.5时流动性最小。结果与各向异性值分析一致。
2.1.2DPH的荧光寿命与旋转相关时间DPH探针分布在双层膜疏水内部具有长寿命,在膜亲水表面具有短寿命。用双指数拟合方程拟合DPH的荧光延迟曲线,得到探针的荧光寿命(图3)。双指数拟合方程为
y=A+Be(-t/τ1)+Ce(-t/τ2)。
(7)
其中:t是时间变量,A、B和C是拟合参数,τ1和τ2是探针的荧光寿命,拟合卡方值为0.8~1.2。
与纯DPPC囊泡相比,加入Chol的摩尔比为0.1~0.2后,DPH的长寿命变化不大,短寿命先增大后减小。Chol摩尔比≥0.3时,长寿命逐渐增大,而短寿命几乎不变。
水分子对DPH荧光有猝灭作用。DPH荧光寿命的变化与水分子穿膜有关。加入Chol的摩尔比为0.1后,磷脂头部基团与Chol分子刚性环上的羟基形成氢键,Chol的环状结构和酰基链与磷脂酰基链平行,刚性环状结构阻碍了DPPC分子的运动,使流动性降低。大单层囊泡膜双层变得紧密,使水穿透能力减弱。当Chol摩尔比大于0.3,长寿命逐渐增大,膜流动性降低,而短寿命几乎不变,说明DPH寿命与膜环境有关。
DPH的旋转相关时间可由荧光寿命通过下式计算

(8)
其中:r是荧光探针的各向异性值,τ是荧光寿命, r0是固有各向异性(r0(DPH)=0.4),φ是旋转相关时间(φ1、φ2分别由τ1、τ2计算得到)。当Chol摩尔比超过0.3时,DPH在双层疏水区的旋转相关时间逐渐增大,但在膜界面变化不大(图4)。
荧光寿命和旋转相关时间的分析一致,间接提供了双层膜流动性的相关信息。
2.2不同胆固醇含量对DPPC单层膜的影响
2.2.1相转移图5显示相变压力与弹性模量的关系。加入Chol的摩尔比为0.1~0.2时,相变压力降低,而当摩尔比为0.3和0.4时,相变压力增大,与纯DPPC单层的相变压力接近。当Chol摩尔比超过0.4时,相变压力逐渐下降。相变压力变化范围为2.85~3.21 mN/m。
相变压力处的弹性模量可由公式[17-23]得出
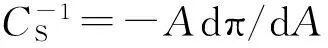
(9)
其中,A是表面压力π对应的平均分子面积。从图5可以看出,当Chol摩尔比为0.1~0.2时,与纯DPPC单分子层相比,相变处弹性模量略微降低,说明单层膜有序性稍微降低。当Chol摩尔比大于0.2时,相变处弹性模量随着Chol增加而逐渐增大,表明单层膜的有序性增加,流动性减弱。
2.2.2胆固醇与DPPC在空气-水界面上的相互作用在一定压力下,二元系统单层膜的过量吉布斯自由能可由下式[24-27]计算

(10)
ΔAexc=A12-Aid,
(11)
Aid=A1X1+A2X2。
(12)
其中:A12是一定压力下二元系统的平均分子面积,A1、A2是单一组分1和2在同样压力下的平均分子面积,X1、X2是混合系统中不同组分的摩尔比例,N是阿佛加德罗常数。
过量吉布斯自由能可以揭示膜上分子间的相互作用以及膜的稳定性。如图6所示,混合膜过量吉布斯自由能为负值,说明DPPC和Chol分子间相互作用表现为引力。并且,当Chol摩尔比为0.5时,过量吉布斯自由能的绝对值达到最大,表明分子间相互作用力最强。这与文献[28]报道相一致。
二维维里物态方程的第二维里系数也可以说明分子间的相互作用。用维里物态方程对表面压力-平均分子面积曲线拟合,得到参数见表1。(b1)m为负值,(b1)E为正值,均说明DPPC和Chol在空气水界面上的相互作用力为引力。这点与过量吉布斯自由能分析一致。
3结论
Chol对DPPC饱和脂膜的影响与Chol在膜成分中所占的摩尔比有关。随着Chol含量的增加,脂膜的流动性先轻微增大,后显著降低。低含量的Chol与DPPC分子相互作用,降低膜的有序性,使膜的流动性轻微增大。而高含量的Chol在DPPC脂膜上可能形成晶体微结构,使得Chol区域和DPPC区域变得更有序,使得膜的流动性减弱。Chol和饱和脂分子间的相互作用力为引力,并在Chol摩尔比为0.5时达到最大值。
Chol在人体正常细胞膜上摩尔比为0.3左右,Chol含量的过高或过低影响细胞膜的物理性质,使细胞不能维持正常的生命活动。动脉粥样硬化与高含量Chol在膜上形成晶体微区以及Chol与膜脂分子的相互作用有着很大的关系。界面单层膜和囊泡膜两种模型中得出的结论可以相互验证。
参考文献:
[1] FRANKS N P. Structural analysis of hydrated egg lecithin and cholesterol bilayers: I. X ray diffraction[J]. Journal of Molecular Biology, 1976, 100: 345-358.
[2] MCINTOSH T J.The effect of cholesterol on the structure of phosphatidylcholine bilayers[J].Biochimicaet Biophysica Acta,1987, 513: 43-58.
[3] CHEN M, MASON R P, TULENKO T N. Atherosclerosis alters the composition, structure and function of arterial smooth muscle cell plasma membranes[J].Biochimicaet Biophysica Acta, 1995, 1272: 101-112.
[4] YEAGLE P L. Cholesterol and the cell membrane[J].Biochimicaet Biophysica Acta, 1985, 822: 267-287.
[5] SHINITZKY M, INBAR M.Microviscosity parameters and protein mobility in biological membranes[J].Biochimicaet Biophysica Acta, 1976, 433: 133-149.
[6] MASON R P, TULENKO T N, JACOB R F. Direct evidence for cholesterol crystalline domains in biological membranes: role in human pathobiology[J]. Biochimicaet Biophysica Acta, 2003, 1610: 198-207.
[7] ZIBLAT R, LEISEROWITZ L, ADDADI L. Crystalline lipid domains: characterization by x-ray diffraction and their relation to biology[J]. Angewandte Chemie International Edition,2011, 50: 3620-3629.
[8] HOSSANN M, SYUNYAEVA Z, SCHMIDT R, et al. Proteins and cholesterol lipid vesicles are mediators of drug release from thermosensitive liposomes[J]. Journal of Controlled Release, 2012, 162 (2): 400-406.
[9] VENEGAS B, CHONG P L G. Drug release from liposomes can be modulated by the extent of cholesterol superlattice in the lipid membrane[J]. Biophysical Journal, 2010, 98 (3): 273a.
[10] TAMAI N, IZUMIKAWA T, FUKUI S, et al. How does acyl chaqin length affect thermotropic phase behavior of saturated diacylphosphatidy-lcholine-cholesterol binary bilayers[J]. Biochimicaet Biophysica Acta-Biomembranes, 2013, 1828 (11): 2513-2523.
[11] LI X T, HE M L, ZHOU Z Y, et al. The antitumor activity of PNA modified vinblastine cationic liposomes on Lewis lung tumor cells: Invitro and in vivo evaluation[J]. International Journal of Pharmaceutics,2015, 487: 223-233.
[12] WANG X, WANG J, WANG Y, et al. Effect of the nature of the spacer on the aggregation properties of geminisurfactants in an aqueous solution[J]. Langmuir,2004, 20: 53-56.
[13] ZHANG Z, WANG H, ZHENG P, et al. Effect of spacer rigidity on the aggregations of ester containing Gemini surfactants in aqueous solutions: a study of density and fluorescence[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2013, 421: 193-200.
[14] LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. New York:Kluweer Academic Publishers/Plenum Press, 1999.[15] DOMENECH O, TORRENT-BURGUES J, MERINO S,et al. Surface thermodynamics study of monolayers formed with heteroacid phospholipids of biological interest[J]. Colloids and Surfaces B: Biointerfaces, 2005, 41: 233-238.
[16] LEVINE I N. Physical Chemistry[M].5th ed. New York:McGraw-Hill Companies Inc., 2002.
[17] ZAKANDA F N, LAURENT P, PAQUOT M,et al. Alkylbetainate chlorides: synthesis and behavior of monolayers at the air-water interface[J]. Thin Solid Films, 2011, 520: 344-350.
[18] AMIYA-KUMAR P, VASILEV K, ORGEIG S, et al.Thermodynamic and structural studies of mixed monolayers: mutual mixing of DPPC and DPPG with DTAP at the air-water interface[J].Materials Science and Engineering C, 2010, 30: 542-548.
[19] WANG J, SUN R G, HAO C C. Mixed alkaline phosphatase / sphingomyelin monolayer at the air-buffer interface: phase behavior and morphology[J].Science China Chemistry, 2014, 57: 1538-1543.
[20] VALENCIA-RIVERA D E, BASACA-LOYA A, BURBOA M G, et al. Interaction of N-nitrosodiethylamine/bovine serum albumin complexes with 1, 2-dipolmitoyl-sn-glycero-3-phosphocholine monolayers at the air-water interface[J].Journal of Colloid and Interface Science, 2007, 316: 238-249.
[21] DYNAROWICZ-LATKA P, DHANABALAN A, OLIVEIRA J O N. A Study on two-dimensional phase transitions in langmuir monolayers of a carboxylic acid with a symmetrical triphenylbenzene ring system[J].Journal of Phyasical Chemistry B,1999, 103: 5992-6000.
[22] PARRA-BARRAZA H, BURBOA M G, SANCHEZ-VASQUEZ M. Chitosan cholesterol and chitosan-stearic acid interactions at the air-water interface[J]. Biomacromolecules,2005, 6: 2416-2426.
[23] NAKAHARA H, NAKAMURA S, OKAHASHI Y. Examination of fluorination effect on physical properties of saturated long-chain alcohols by DSC and Langmuir monolayer[J].Colloids and Surfaces B: Biointerfaces,2013, 102: 472-478.
[24] PANDA A K, NAG K, HARBOTTLE R R. Thermodynamic studies of bovine lung surfactant extract mixing with cholesterol and its polmitate derivative[J]. Journal of Colloid and Interface Science,2007, 311: 551-555.
[25] CHOU T H, CHANG C H. Thermodynamic behavior and relaxation processes of mixed DPPC/cholesterol monolayers at the air/water interface[J].Colloids and Surfaces B: Biointerfaces, 2000, 17: 71-79.
[26] PANDA A K, VASILEV K, ORGEIG S, et al. Thermodynamic and structural studies of mixed monolayers: Mutual mixing of DPPC and DPPG with DoTAP at the air-water interface[J]. Materials Science and Engineering C, 2010, 30: 542-548.
[27] JURAK M. Surface Gibbs energy interaction of phospholipid /cholesterol monolayers deposited on mica with probe liquids[J]. Chemistry and Physics of Lipids,2014, 183: 60-67.
[28] DYNAROWICZ-LATKA P, SEOANE R, JR J M, et al. Study of penetration of amphotericin B into cholesterol or ergosterol containing dipalmitoyl phosphatidylcholine Langmuir monolayers[J]. Colloids and Surfaces B: Biointerfaces,2002, 27: 249-263.
〔责任编辑 李博〕
Effect of cholesterol on saturated phospholipid membrane in bilayer or monolayer model
WANG Juan, SUN Runguang*
(School of Physics and Information Technology, Shaanxi Normal University,>Xi′an 710119, Shaanxi, China)
Abstract:The bilayer membranes of liposome and Langmuir monolayer were employed to study the interaction of cholesterol and DPPC.The effect of cholesterol on the membrane fluidity of saturated DPPC liposome has been studied by measuring the fluorescence anisotropy and lifetime of the DPH probe labelled in the liposomes. Phase transition and the intermolecular interaction have been investigated by the Langmuir technique and theoretical analysis.The results show that the fluidity of the membrane decreased first and then increased as the increase of cholesterol. WhilexChol≥0.5, the fluidity reached stable.The cholesterol has an influence on the phase transition of DPPC monolayer. The interaction between cholesterol and DPPC shows an attraction and reaches a maximum whenxChol=0.5.Keywords: liposomes; Langmuir monolayer; membrane fluidity; phase transition; cholesterol
文章编号:1672-4291(2016)03-0032-06
doi:10.15983/j.cnki.jsnu.2016.03.231
收稿日期:2015-12-15
基金项目:国家自然科学基金(21402114); 中央高校基本科研业务费专项资金(GK201504004)
*通信作者:孙润广,男,教授,博士生导师。E-mail:sunrunguang@snnu.edu.cn
中图分类号:Q63
文献标志码:A
