脯氨酸衍生的咪唑手性离子液的合成及其在不对称Micheal反应中的应用
2016-06-20张红英颜雪明
张红英,颜雪明
(1.南华大学化工学院, 湖南 衡阳 421001;2.衡阳财经工业职业技术学院材料系, 湖南 衡阳 4210011)
脯氨酸衍生的咪唑手性离子液的合成及其在不对称Micheal反应中的应用
张红英1 ,2,颜雪明1
(1.南华大学化工学院, 湖南 衡阳 421001;2.衡阳财经工业职业技术学院材料系, 湖南 衡阳 4210011)
摘要:离子液体(IL)具有较高的化学稳定性和溶解性、低毒、低挥发、不可燃、可循环等优点;天然氨基酸是一种重要的手性源分子,其中-脯氨酸是揭开有机小分子催化序幕的“明星分子”。鉴于此,本文以天然脯氨酸为手性源,设计并合成了一种结构新颖的咪唑类手性离子液,并将其应用于催化不对称Micheal加成,结果表明该新型脯氨酸衍生的咪唑类手性离子液具有良好的不对称催化性能和循环使用性能。
关键词:离子液;脯氨酸;不对称Micheal反应;催化
有机金属催化存在价格高、毒性大、产物受重金属污染等诸多缺点,而有机小分子催化采用手性有机化合物作为催化剂,兼备有机金属催化和酶催化的优点。有机小分子催化操作简洁、反应条件温和、可以在含水溶剂中进行,比有机金属配合物和酶催化剂更稳定,可以在较广泛的反应条件下进行,也可方便地固载到高分子或其他固相载体上以便于回收利用;因此,探寻反应条件温和、能有效进行手性诱导并能较好地预测产物构型的有机小分子催化剂己经成为有机合成化学中的一项挑战。
由于离子液体(IL)具有较高的化学稳定性和溶解性、低毒、低挥发、不可燃、可循环等优点,已广泛地应用于有机合成、分子催化以及化工分离等研究领域。IL是由阴离子和阳离子组成的一种有机盐,通过改变阴离子或阳离子的结构可以获得各种离子液;因此,化学家把IL称为“可设计”的绿色溶剂。IL的这一特性,也使化学家可以根据需要设计并合成具有各种特殊功能的IL成为可能。手性离子液体(CIL)就是在离子液分子结构中引入手性单元而制备的离子液。CIL 作为一种特殊的离子液体,可用于手性鉴别、外消旋化合物的选择性拆分,在不对称反应中,CIL 能提高手性选择性。同时它在电化学分离与分析、气相色谱、金属有机化合物和酶的合成等方面也得到了广泛应用[1-4]。
天然樟脑是一种重要的手性源分子,有许多的小分子催化剂和手性配体从樟脑衍生出来,并广泛应用在不对称合成和催化中[5-7]。天然氨基酸也是常见且便宜的手性源分子,近10年来,以天然氨基酸为主体的有机小分子催化剂迅猛发展[ 8-9 ],而其中L-脯氨酸是揭开有机小分子催化序幕的“明星分子”,L-脯氨酸在数十个常见反应中都有相当出色的催化效果。鉴于L-脯氨酸衍生的小分子催化剂具有良好的催化活性,本文将脯氨酸与离子液二
者结合起来合成出结构新颖的手性离子液催化剂,并考察其在不对称Micheal加成反应中的催化与循环使用性能。
1实验部分
1.1试剂与仪器
Bruker ARX-300 MHz型核磁共振仪( CDCl3为溶剂),硅胶(GF254)(200~300目); L-脯氨酸、对甲苯磺酰氯、N-甲基咪唑等原料均为分析纯。
1.2脯氨酸衍生的手性离子液催化剂的合成
脯氨酸衍生的手性离子液催化剂的合成路线如图1所示。
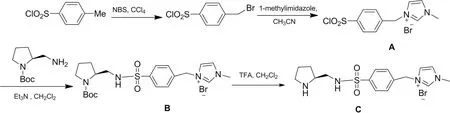
图1 手性离子液催化剂的合成
1.2.1中间体A的合成
对甲苯磺酰氯(38.1 g,0.2 mol)溶于300 mL四氯化碳中,分批缓慢加入NBS(35.6 g,0.2 mol),偶氮二异丁腈(0.2 g,1.2 mmol),回流4 h,反应液经过滤、浓缩、柱层析(石油醚/甲苯=4/1)、得到4-(溴甲基)-苯磺酰氯24 g,产率45%。
在25 mL单口瓶中加入4-(溴甲基)-苯磺酰氯(11.1 g,41.35 mmol)、80 mL干燥乙腈、N-甲基咪唑(3.39 g,41.35 mmol),氮气保护下回流36 h,将乙腈旋干,柱层析得到白色固体A,10.1 g,产率70%。
1.2.2中间体B的合成
(S)-1-N-叔丁氧羰基-2-(氨基乙基)吡咯烷(1.0 g,5 mmol),(按文献[10]合成)溶于20 mLCH2Cl2中,滴加Et3N(0.6g,5.5 mmol),冰盐浴将反应体系降温至0 ℃,中间体A(1.58 g,4.5 mmol)分批加入,加完后升温至室温,反应17 h,除去溶剂,剩余物柱层析得到中间体B,浅黄色液体1.70 g,产率73%。
1.2.3手性离子液催化剂C的合成
冰盐浴下将得到的中间体B溶于30 mL(VTFA/VCH2Cl2=1∶1)混合物,搅拌2 h,TLC检测跟踪反应,反应完后减压除去溶剂,柱层析得手性离子液催化剂C,1.48 g,产率95%。1H-NMR(300 MHz,D2O) δ( ppm):7.83~7.77(m, 2H),7.51~7.39(m, 4H),5.42~5.41(d, 2H,3.81(s, 3H),3.44(m, 1H),3.27(s, 2H),3.13~3.07(m, 2H),2.97~2.93(m, 2H),1.89~1.45(m, 4H);13C-NMR (CD3OD) δ(ppm):140.3,139.1,137.1,129.1,127.7,124.2,123.1,122.5,119.9,60.0,51.8,45.2,43.1,35.4,34.9,27.2,22.8。
2结果与讨论
2.1合成实验
中间体A的合成比较简单,关键是溴代反应这一步,对甲苯磺酰氯采用NBS溴代时有2个要注意的地方:1)反应需要加入催化量的偶氮二异丁腈或过氧化苯甲酰做引发剂;2)NBS的加入量和加入方式要控制否则会产生较多的二溴代副产物。中间体A与(S)-1-N-叔丁氧羰基-2-(氨基乙基)吡咯烷发生磺酰胺化很容易进行,采用有机弱碱三乙胺作缚酸剂即可。产物再在二氯乙烷中用三氟乙酸脱保护基团即得手性离子液催化剂C。
2.2催化实验
获得手性离子液催化剂C后,我们尝试将其应用于催化不对称Micheal反应,以环己酮和硝基苯乙烯为反应模型,20%的催化剂用量,考察溶剂和添加物条件下的反应效果,结果见表1。环己酮与硝基苯乙烯的不对称Micheal加成反应如图2所示。

图2 环己酮与硝基苯乙烯的不对称Micheal加成反应

序号溶剂添加剂温度/℃产率b/%顺/反c对映体过量/%d1MeOH—258788∶12812neat—257597∶3773eMeOH—08499∶1894neat—06395∶5865MeOHTFA04294∶6816MeOHAcOH06393∶7577MeOHPhCOOH07293∶7408MeOHHCOOH07994∶6549MeOHPTSA0———
注:a反应条件: 1 (0.0196g, 2eq) , 2a (0.0149g, 1eq) 催化剂C. 20mol%,溶剂1 mL, 反应24h;b分离产率;c顺/反异构体比值通过其核磁分析确定;d对映体过量采用手性柱AD-H/AS-H 的HPLC分析确定。
考虑到手性离子液体在普通的溶剂中的溶解性有限,我们选择极性较大的甲醇作溶剂,在没有任何添加物时,反应24 h后,能够获得87%的产率,顺反异构体的比例为88∶12,对映选择性为81%(序号1)。当将反应温度降至0 ℃时,反应时间延长到36 h,产率有所减低,但反应的立体选择性与对映选择性却明显提高,分别达到99∶1和89%(序号3)。而没有加溶剂的反应产率略低,映选择性也只有77%和86%(序号2、4)。之后我们又考查了不同酸性添加物对反应的影响,TFA、AcOH、PhCOOH、PTSA等被用作助催化剂,从表1的反应结果可以看出,弱酸苯甲酸加入时,对映选择性 ee值大大降低,只有40%(序号7)。强酸TFA作添加物时对反应较为有利,立体选择性和对选择性都不错(序号5)。综合考虑上述实验的结果,我们决定采用不加任何助催化剂的最优实验方案,对反应底物进行拓展,结果见表2。环己酮与硝基苯乙烯的不对称Micheal加成反应如图3所示。
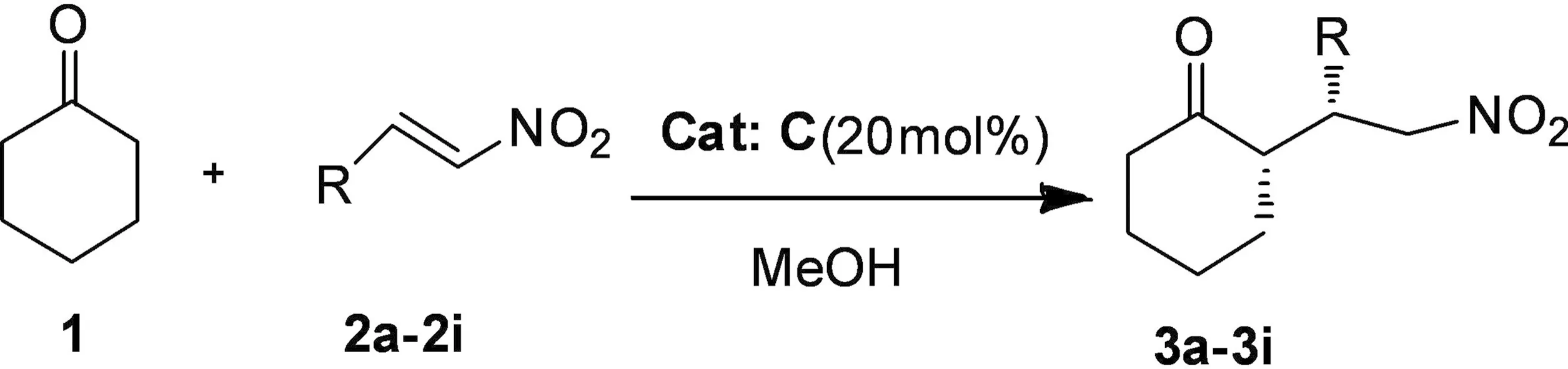
图3 环己酮与硝基苯乙烯的不对称Micheal加成反应
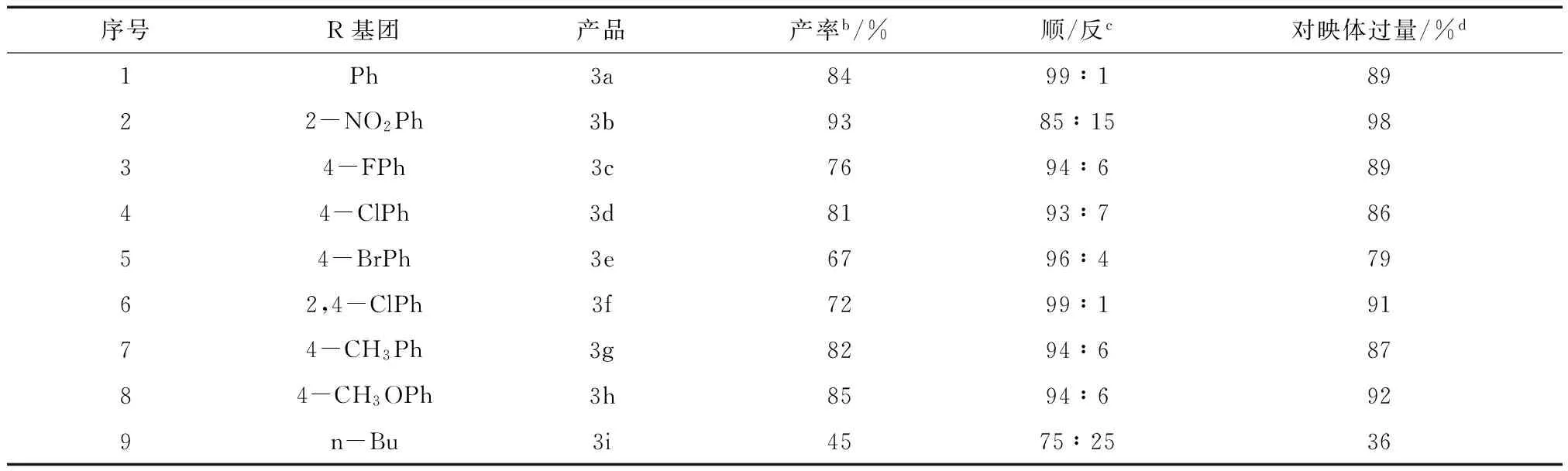
序号R基团产品产率b/%顺/反c对映体过量/%d1Ph3a8499∶18922-NO2Ph3b9385∶159834-FPh3c7694∶68944-ClPh3d8193∶78654-BrPh3e6796∶47962,4-ClPh3f7299∶19174-CH3Ph3g8294∶68784-CH3OPh3h8594∶6929n-Bu3i4575∶2536
注:a反应条件: 1 (0.0196g, 2eq) , 2a (1eq) 催化剂C. 20mol%,溶剂1 mL, 反应24h;b分离产率;c顺/反异构体比值通过其核磁分析确定;d对映体过量采用手性柱AD-H/AS-H 的HPLC分析确定。
产物的结构表征:
(S)-2-((R)-2-nitro-1-phenylethyl)cyclohexanone 3a:HPLC analysis (Chiralpak AS column),hexane/i-PrOH = 90/10,0.7mL/min,238nm,tr(min)=18.20min,tr(maj)=26.26min,[α]D25= -18.3(c 0.75, CHCl3);1H NMR(300MHz, CDCl3):δ(10-6) 7.37~7.17(5H, m),4.93(1H, dd,J=12.6, 4.5 Hz),4.62(1H, dd,J=12.3, 9.9 Hz),3.74(1H, m),2.76~2.66(1H, m),2.50~2.40(2H, m),2.09~2.07(1H, m),1.78~1.56(4H, m),1.27~1.23(1H, m)。
(S)-2-((R)-2-nitro-1-(2-nitrophenyl)ethyl)cyclohexanone 3b:HPLC analysis (Chiralpak AD column),hexane/i-PrOH=95/5,1.0mL/min,238nm,tr(min)=29.06min,tr(maj)=42.71min,[α]D25=-19.8(c 0.43, CHCl3);1H NMR(300MHz, CDCl3):δ(10-6) 7.90~7.84(m, 1H),7.65~7.54(m, 1H),7.47~7.38(m, 2H),4.95~4.93(m, 1H),4.35~4.30(m, 1H),4.13~4.09(m, 1H),2.66~1.24(m, 9H)。
(S)-2-((R)-1-(4-fluorophenyl)-2-nitroethyl)cyclohexanone 3c:HPLC analysis (Chiralpak AS column),hexane/i-PrOH=90/10,0.7mL/min,238 nm,tr(min)=21.28min,tr(maj)=29.49min,[α]D25=-25.4(c 1.13, CHCl3);1H NMR(300MHz, CDCl3):δ(10-6)7.18~7.14(m, 2H),7.06~7.00(m, 2H),4.98(dd,J=12.3Hz, 4.2Hz, 1H),4.65(dd,J=12.0Hz, 9.9Hz, 1H),3.76(m, 1H),2.72~2.64(m, 1H),2.48~2.35(m, 2H),2.13~2.09(m, 1H),1.78~1.57(m, 4H),1.27~1.22(m, 1H)。
(S)-2-((R)-1-(4-chlorophenyl)-2-nitroethyl)cyclohexanone 3d:HPLC analysis (Chiralpak AS column),hexane/i-PrOH=90/10,0.7mL/min,238nm,tr(maj)=18.75min,tr(min)=28.36min,[α]D25=-30.1(c 0.88, CHCl3);1H NMR(300MHz, CDCl3):δ(10-6) 7.33~7.28(m, 2H),7.16~7.12(m, 2H),4.98(dd,J=12.6Hz, 4.5Hz, 1H),4.66(dd,J=12.6Hz, 10.2Hz, 1H),3.79~3.77(m, 1H),2.72~2.62(m, 1H),2.48~2.35(m, 2H),2.16~2.08(m, 1H),1.72~1.57(m, 4H),1.27~1.22(m, 1H)。
(S)-2-((R)-1-(4-bromophenyl)-2-nitroethyl)cyclohexanone 3e:HPLC analysis (Chiralpak AS column),hexane/i-PrOH=90/10,0.7mL/min,238nm,tr(min)=19.99min,tr(maj) =31.37min),[α]D25=-22.3 (c 0.50, CHCl3);1H NMR(300MHz, CDCl3):δ(10-6) 7.48~7.44(m, 2H),7.09~7.06(m, 2H),4.97(dd,J=12.6Hz, 4.5Hz, 1H),4.65(dd,J=12.6Hz, 9.9Hz, 1H),3.77(m, 1H),2.69~2.58(m, 1H) ~2.46~2.37(m, 2H) ~2.09(m, 1H) ~1.78~1.56(m, 4H),1.26~1.21(m, 1H)。
(S)-2-((R)-1-(2,4-dichlorophenyl)-2-nitroethyl)cyclohexanone 3f:HPLC analysis (Chiralpak AS column),hexane/i-PrOH=90/10,0.7mL/min,238nm,tr(min)=14.64min,tr(maj)=24.31min),[α]D25= -33.9(c 0.55, CHCl3);1H NMR (300MHz, CDCl3):δ(10-6) 7.43(d,J=2.1Hz, 1H),7.24(m, 2H),4.91~4.89(m, 2H),4.27(m, 1H),2.93~2.84(m, 1H),2.48~2.38(m, 2H),2.16~2.11(m, 1H),1.87~1.60(m, 4H),1.41~1.22(m, 1H)。
(S)-2-((R)-2-nitro-1-p-tolylethyl)cyclohexanone 3g:HPLC analysis (Chiralpak AS column),hexane/i-PrOH=90/10,0.7mL/min,238nm;tr(min)=13.08min,tr(maj)=19.93min,[α]D25=-11.1 (c 1.21, CHCl3);1H NMR(300MHz, CDCl3):δ(10-6) 7.16~7.13(m, 2H),7.08~7.05(m, 2H),4.96(dd,J=2.0Hz, 4.5Hz, 1H),4.66(dd,J=12.3Hz, 9.9Hz, 1H),3.78(m, 1H),2.69(m,1H),2.49~2.39(m, 2H),2.33(s, 3H),2.08(m, 1H),1.79~1.57(m, 4H),1.27~1.23(m, 1H)。
(S)-2-((R)-1-(4-methoxyphenyl)-2-nitroethyl)cyclohexanone 3h:HPLC analysis (Chiralpak AD column),hexane/i-PrOH=75/25,0.7mL/min,238nm,tr(min)=9.95min,tr(maj)=11.32min,[α]D25=-15.4 (c 0.43, CHCl3);1H NMR (300MHz, CDCl3):δ(10-6) 7.28(m, 2H),6.88(m, 2H,4.95(dd,J=12.6Hz, 4.5Hz, 1H),4.64(dd,J=12.6Hz, 4.5Hz, 1H),,3.80(s, 3H),3.79~3.72(m, 1H),2.70~2.62(m, 1H),2.47~2.40(m, 2H),2.12~2.06(m, 1H),1.81~1.57(m, 4H),1.27~1.23(m, 1H)。
(S)-2-((S)-1-nitrohexan-2-yl)cyclohexanone 3i:HPLC analysis (Chiralpak AS column),hexane/i-PrOH=90/10,0.5mL/min,210nm,tr(min)=12.38min,tr(major)=13.82min,[α]D25=-20.7(c 0.25, CHCl3);1H NMR (300MHz, CDCl3):δ(10-6) 4.61~4.55(m, 1H),4.45~4.39(m, 1H),2.62~2.40(m, 4H),2.13~2.11(m, 2H),1.93(m, 1H),1.48~1.27 (m, 9H),0.96~0.92(m, 3H)。
3离子液的循环使用
离子液的最大特点是具有可回收性和循环使用性能,因此,我们对该新型手性离子液的回收和循环使用性能进行初步研究。以环己酮和硝基苯乙烯为反应模型(图 2),在催化反应结束后,用乙醚将反应产物及未反应的原料一起萃取出来,而手性离子液催化剂则在乙醚中几乎不溶解;所以只需通过萃取就能将催化剂和产物成功的分离,接着在萃余相中再加入反应物进行下一轮催化反应。由表3的反应结果可以看出,催化剂循环套用多达6次,仍然具有良好的催化活性,由此证明该新型离子液催化剂可以实现回收套用。
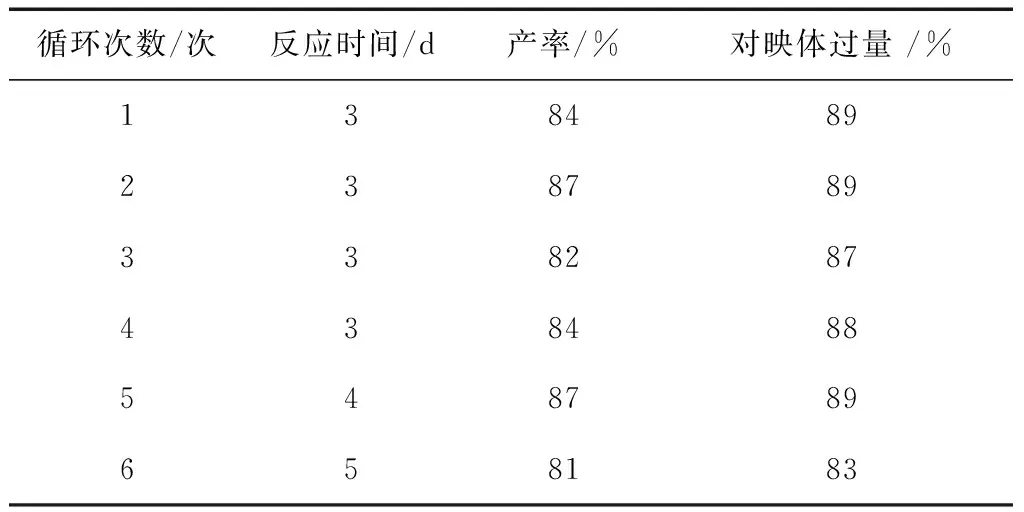
表3 催化剂循环使用实验研究
4结论
本文以来源丰富,价格便宜的天然L-脯氨酸为手性源,设计并合成一类结构新颖的咪唑类手性离子液,并对其分子结构进行确证。本文尝试将该手性离子液应用于催化不对称Micheal加成反应,结果表明该脯氨酸衍生的咪唑类手性离子液具有良好的催化性能,反应具有较好的收率,对映异构体过量,而且催化剂循环使用6次,其催化活性依然没有明显下降。我们也正尝试将该手性离子液应用于催化不对称Aldol、D-A、aze-Baylis-Hillman等反应。
参考文献
[1]曹霞,乐长高. 手性离子液体的合成[J].有机化学, 2010,30(6):816.
[2]Parvulescu V I, Hardacre C. Catalysis in Ionic Liquids[J]. Chem Rev, 2007, 107:2615.
[3]Greaves T L, Drummond C J. Protic Ionic Liquids: Properties and Applications[J].Chem Rev, 2008, 108:206.
[4]Miao W, Chan T H. Ionic-liquid-supported Synthesis: A Novel Liquid-phase Strategy for Organic Synthesis[J].Acc Chem Res, 2006, 39:897.
[5]颜雪明,张红英,龙威.一种新型含硫手性离子液的合成及其在不对称环氧化中的应用[J]. 应用化工, 2013,42(7):1199.
[6]Saito T, Akiba D, Sakairi M, et al. Preparation of a Novel, Camphor-derived Sulfide and Its Evaluation as a Chiral Auxiliary Mediator in Asymmetric Epoxidation Via the Corey-Chaykovsky Reaction[J].Tetrahedron Lett, 2001, 42:57.
[7]Gui Y, Li J, Guo C S, et al. New Chiral Organosulfur Catalyst for Highly Stereoselective Synthesis of Epoxides[J]. Adv Synth Catal, 2008, 16:2483.
[8]Notz W, Tanaka F, Barbas I. Enamine-based Organocatalysis with Proline and Diamines: The Development of Direct Catalytic Asymmetric Aldol, Mannich, Michael, and Diels-Alder Reactions[J]. Acc Chem Res, 2004,37:580.
[9]Melchiorre P, Marigo M, Carlone A, et al. Asymmetric Aminocatalysis-gold Rush in Organic Chemistry[J]. Angew Chem Int Ed,2008,4:6138.
[10]Dahlin N, Bogevig A, Adolfsson H.N-Arenesulfonyl-2-aminomethylpyrrolidines Novel Modular Ligands and Organocatalysts for Asymmetric Catalysis[J].Adv Synth Catal, 2004, 346:1101.
(编校:叶超)
Synthesis of Imidazole Chiral Ionic Liquids Derived from Proline and Its Application in Asymmetry Micheal Reaction
ZHANG Hongying1 ,2, YAN Xueming1
(1.CollegeofChemistryandChemicalEngineering,UniversityofSouthChina,Hengyang421001China;2.HengyangFinaceEconomicsandIndustryPolytechnic,Hengyang421001China)
Abstract:Ionic liquid (IL) has many advantages, such as high chemical stability and solubility, low toxicity, low volatile, non-combustible, recyclable etc. Natural amino acid is a kind of chiral source molecules, and L-proline is the star molecules because it reveals the organocatalysis prelude . In view of these, we synthesized a novel imidazole chiral ionic liquid with L-proline as chiral source. This new chiral ionic liquid was applied to catalyze the asymmetric Micheal addition. The results show that this imidazole chiral ionic liquid derived from proline has good asymmetric catalytic and recycling performance.
Keywords:ionic liquid; proline; asymmetric Micheal reaction; catalysis
收稿日期:2014-06-23
基金项目:湖南省教育厅科学研究资助项目(14C0157); 衡阳市科技发展计划项目(2013KJ06); 南华大学高层次人才启动基金项目(2012XQD008)。
中图分类号:TQ032.42
文献标志码:A
文章编号:1673-159X(2016)03-0075-5
doi:10.3969/j.issn.1673-159X.2016.03.016
第一作者:张红英(1982—), 女, 讲师, 硕士研究生, 主要研究方向为应用化学。
·基础学科·
