急性应激后大鼠胃肠道病理变化及其菌群ERIC-PCR图谱分析
2016-06-18朱晓慧张成岗刘海峰
朱晓慧, 张成岗, 刘海峰*
1.武警总医院消化内科, 北京 100039;2.军事医学科学院放射与辐射医学研究所, 北京 100850
急性应激后大鼠胃肠道病理变化及其菌群ERIC-PCR图谱分析
朱晓慧1,2,张成岗2,刘海峰1,2*
1.武警总医院消化内科, 北京 100039;2.军事医学科学院放射与辐射医学研究所, 北京 100850
摘要:研究基于水浸束缚应激法建立大鼠急性应激模型的可行性并观察大鼠胃、回肠、盲肠、结肠病理学变化及其菌群图谱变化规律。选取健康雄性SD大鼠为研究对象,随机分为对照组和模型组。对照组正常饲养,模型组采用异氟烷吸入麻醉后置于自制束缚笼,待其苏醒后于23±2℃水浴5 h,造模前后记录大鼠的体重并于造模后依次进行旷场实验和强迫游泳实验。最后脱臼处死并收集胃、回肠、盲肠、结肠组织及其内容物,分别进行HE染色和ERIC-PCR扩增鉴定,采集图像并对比分析急性应激前后大鼠胃肠道病理变化及其菌群图谱分布规律。与对照组相比,造模前后大鼠体重基本无变化、穿越次数显著降低、直立次数显著降低、理毛次数显著降低、强迫游泳不动时间显著延长。同时,造模前后大鼠胃粘膜及肠道微绒毛等结构保存完好,无细胞核深染等,胃肠道菌群均出现明显变化的特征条带。建立了大鼠急性应激模型,结合HE染色及ERIC-PCR技术为基于大鼠急性应激模型研究肠道菌群图谱特征及变化规律等提供了重要参考。
关键词:大鼠急性应激模型;HE染色;行为学;肠道菌群;ERIC-PCR
应激是机体感知各种内外界环境、社会、心理因素刺激所产生的一种全身性非特异性适应反应,按照应激源刺激时间的长短及强度可分为急性应激和慢性应激两种[1,2]。慢性应激指机体在长期缓慢的外界环境及工作压力的刺激下产生的一种生理及心理性障碍[3]。急性应激指机体在遭受到急剧而严重的精神创伤性事件后数分钟或数小时内所产生的一过性精神障碍,如战时应激等[4,5]。急性应激主要表现为强烈恐惧体验的精神运动性兴奋,行为具有一定的盲目性或者精神运动性抑制甚至木僵;应激源消除后,症状往往消失;一般历时短暂,预后良好且缓解完全[6]。虽然急性应激的愈后较好,但依然是临床常见精神性障碍病症之一,特别是由于急性应激性刺激导致的心理及生理性变化,给病人和社会都带来了严重的影响和经济负担[7]。
水浸束缚应激法模拟大鼠急性应激模型具有操作简单、应激因素明确、应激指标变化显著等特点,可有效地模拟临床相关疾病的发病过程,为应激性心理障碍的研究提供了重要参考。同时,通过监测急性应激后大鼠肠道菌群的变化,可为相关应激因素导致的抑郁状态从肠道菌群角度提供重要干预和治疗手段。由于人体胃肠消化系统是机体与外界直接接触的最敏感器官,急性应激刺激主要负累组织是胃肠道,特别是胃肠道主要优势菌群的表达变化将与急性应激性刺激的预防、干预及治疗提供重要的新手段[8]。故本研究期望采用水浸束缚应激法快速建立大鼠急性应激模型,结合病理学方法研究急性应激后大鼠胃肠组织病理学变化,并利用ERIC-PCR方法鉴定急性应激性刺激后大鼠胃肠道菌群表达谱系,特别是优势菌群,为急性应激障碍性疾病的临床预防与治疗提供新的干预手段。
1材料与方法
1.1实验动物及分组
选取成年雄性SD(sprague-dawley)大鼠(体重200~220 g,购自中国人民解放军军事医学科学院实验动物中心)12只,随机分为对照组(6只)和模型组(6只),实验前适应饲养一周:自然光照,室温22±2℃,自由摄取食物和水,每日定时更换饲料,通风良好,排除其他应激因素干扰。
1.2大鼠慢性应激模型的建立
参照已有文献报道的水浸束缚应激法,针对上述适应饲养的急性应激对照组及模型组实验动物进行如下处理:采用4 mol/L异氟烷吸入麻醉5 min(氧流量0.5 L/min),麻醉后放入自制的金属束缚笼(长25 cm,宽10 cm),待大鼠苏醒后竖直置于23±2℃水中,水面高以平大鼠剑突部位为宜,浸置5h后取出并置于鼠笼正常饲养。实验前后分别测定大鼠的体重,实验结束后进行行为学评估。
1.3行为学评估
1.3.1旷场实验旷场实验需要在安静、暗光环境下进行,行为测定于造模前和造模后各进行1次。将大鼠放置旷场箱中(自制旷场箱:由不透明木板制成,箱高为40 cm,底面为80 cm×80 cm的正方形,被等分成面积相等的25个等边方格,无盖,四周及底部封闭,箱的内壁和底面均为黑色),每次测定5 min,包括穿越格数(以穿越底面积块数为水平运动得分)、直立次数(为垂直运动得分)及理毛次数,记录各组数据后进行统计学分析。
1.3.2强迫游泳实验强迫游泳实验前,分别将大鼠置于强迫游泳缸(自制,直径30 cm、缸高30 cm、水温23±2℃、水深25 cm,为避免大鼠逃逸,采用透明聚乙烯材料将强迫游泳缸加高至70 cm)内进行预适应游泳15 min,然后用毛巾擦干,24 h后进行强迫游泳6 min,计算大鼠后4 min在水面漂浮的累计不动时间,记录各组数据后进行统计学分析。不动时间判断标准:大鼠停止挣扎或呈漂浮状态,四肢有轻微动作以保持在水面即为不动。
实验完成后将大鼠脱臼处死,分别收集胃、回肠、盲肠、结肠组织及其内容物,组织样本经生理盐水清洗后置于4%多聚甲醛固定备用。
1.4HE染色
将上述固定24 h后的组织样本脱水、透明、浸蜡、包埋和切片(厚度为3~4 μm)。切片经过脱蜡后进行HE染色,具体步骤如下:苏木精染色5 min,自来水冲洗多余染液;1%盐酸乙醇(70%乙醇配制)分化15 s左右,镜检待细胞核和核内染色质清晰为止,自来水冲洗30 min,蒸馏水冲洗2 min;0.5%伊红溶液染色5 min,使细胞核着色;梯度乙醇各脱水3 min:70%→85%→95%→100%;二甲苯Ⅰ和Ⅱ透明10 min后中性树胶封片,采集图片并进行分析。
1.5胃肠组织内容物基因组DNA提取
按照基因组DNA提取试剂盒所述步骤进行胃、回肠、盲肠、结肠组织基因组DNA提取,采用紫外分光光度仪进行浓度测定后备用。
1.6ERIC-PCR扩增及鉴定
按照文献报道的ERIC-PCR引物序列:ERIC-1: 5′-ATGTAAGCTCCTGGGGATTCAC-3′, ERIC-2: 5′-AAGTAAGTGACTGGGGTGAGCG-3′进行化学合成并稀释备用。以上述定量的基因组DNA为模板,按照如下体系加样:1 μL基因组DNA模板、0.125 μL Ex-Taq(5 U/μL)、2.5 μL 10×Ex-TaqBuffer、2 μL dNTP、0.5 μL ERIC-1、0.5 μL ERIC-2,ddH2O定容至25 μL。加样完成后进行ERIC-PCR扩增,具体步骤为:95℃预变性7 min; 90℃变性30 s,52℃退火1 min,65℃延伸8 min,30个循环;65℃延伸16 min,4℃保存。PCR产物采用1.5%琼脂糖凝胶进行分离并采用凝胶成像仪进行图像采集分析。
1.7统计学分析
所有实验数据均采用SPSS 21.0(http://spss.en.softonic.com/)统计学分析软件进行统计分析,计量资料以平均数±标准差表示。采用Student′st-检验进行两样本均数差异显著性分析,*(P<0.05)定义为显著性差异,**(P<0.01)定义为极显著性差异。
2结果与分析
2.1急性应激前后大鼠体重变化情况
通过比较水浸束缚应激法处理前后大鼠体重变化发现,造模前模型组(297.50±24.00)g大鼠的体重与对照组(312.00±14.00)g相比差异不显著(P=0.140 8>0.05,表1),造模后模型组(293.83±24.49)g大鼠的体重与对照组(314.00±13.68)g相比虽然有所下降,但二者不存在显著性差异(P=0.073 0>0.05,表1),分析可能与急性应激时间相对较短有关。
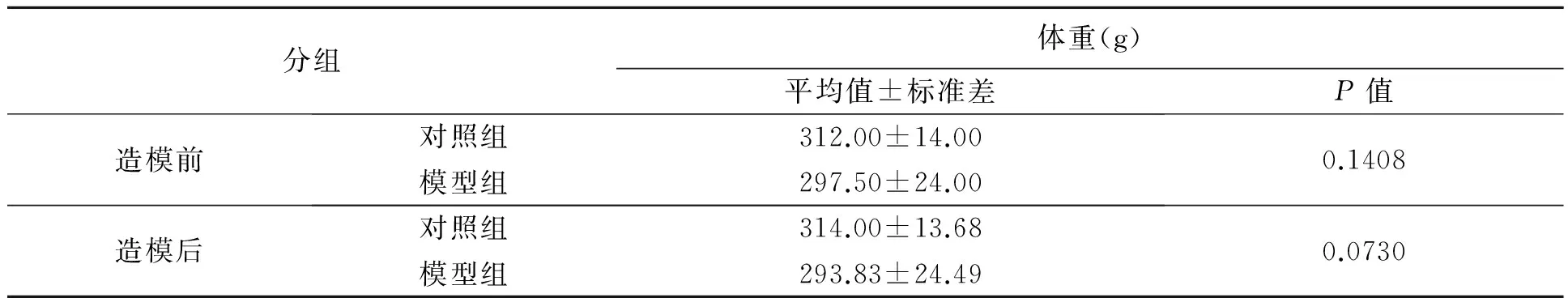
表1 造模前后大鼠体重变化统计分析
2.2急性应激后大鼠行为学评估结果
如表2所示,比较分析发现,模型组(58.50±10.56)g大鼠的旷场穿越次数与对照组(112.17±7.76)g相比极显著降低(P=0.0001<0.01);模型组(9.50±2.74)g大鼠的旷场直立次数与对照组(23.17±6.15)g相比极显著降低(P=0.000 2<0.01);模型组(1.33±0.52)g大鼠的旷场理毛次数与对照组(4.50±1.05)g相比极显著降低(P=0.000 3<0.01);模型组(43.33±6.02)g大鼠的强迫游泳不动时间与对照组(9.33±2.25)g相比极显著延长,具有统计学意义(P=0.000 027<0.01)。说明采用水浸束缚应激法可有效地模拟大鼠急性应激,大鼠发生了明显的行为学变化。
2.3急性应激后大鼠胃肠粘膜组织及微绒毛结构
HE染色的结果显示,与对照组相比,胃粘膜组织结构基本没有改变,未出现细胞核深染(图1A,彩图见图版二),回肠、盲肠、结肠组织形态保持完好,未出现细胞核深染(图1B~D),分析可能是急性应激模型反应时间相对较短,未引起大鼠胃肠道病理组织的明显改变。
2.4急性应激后大鼠肠道菌群图谱及特征性主条带改变明显
如下图2中ERIC-PCR鉴定结果所示,与对照组相比,大鼠胃部组织在1 000 bp左右的条带消失,250 bp出现了明显的条带;大鼠回肠组织250~500 bp处的条带在急性应激处理后消失;大鼠盲肠组织中特征性条带较多,急性应激处理后出现了多个明显特征条带,如100~250 bp之间的条带和500~750 bp之间的条带等;大鼠结肠组织也出现了多条特征性条带,如250~500 bp之间的条带和750 bp左右的条带等。说明急性应激后大鼠的肠道菌群发生了明显的改变,特征性条带对应菌群可作为后续急性应激干预的切入点。
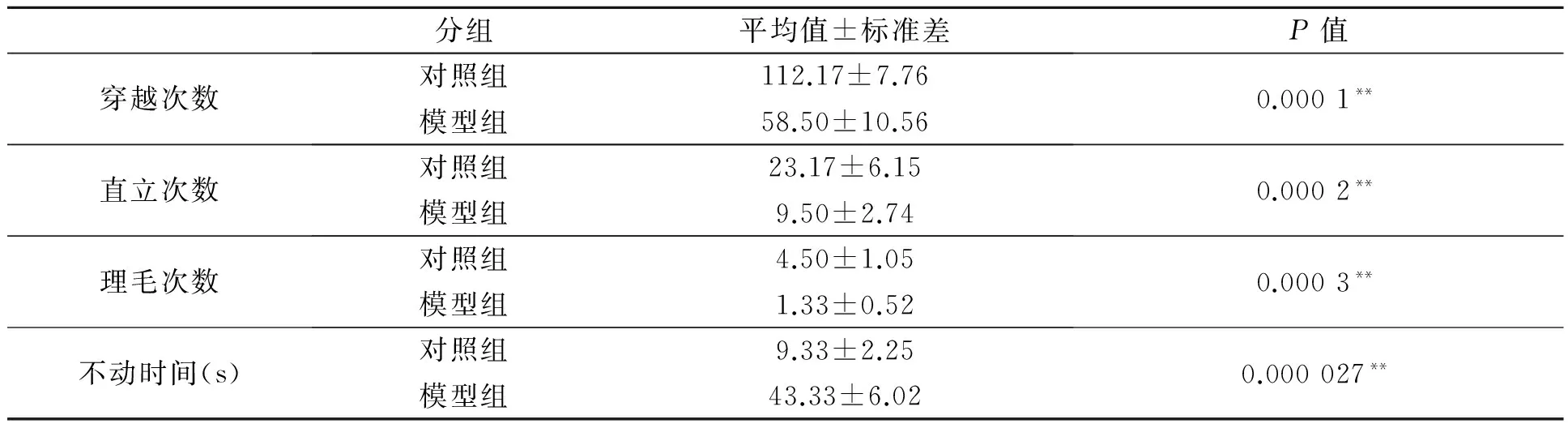
表2 造模后大鼠行为学评估结果及统计学分析
注:**:与对照组比较差异极显著。
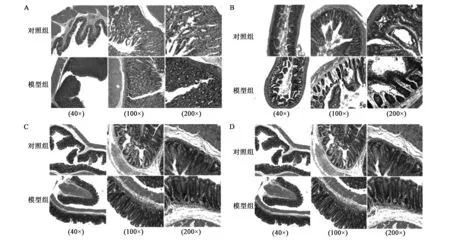
图1 HE染色检测急性应激后大鼠胃、回肠、盲肠、结肠组织病理变化(40×、100×、200×)Fig.1 The pathological change assay of the stomach, ileum, cecum and colon in acute stress rats using HE staining.A.HE染色检测急性应激后大鼠胃组织病理变化;B.HE染色检测急性应激后大鼠回肠病理变化;C.HE染色检测急性应激后大鼠盲肠病理变化;D.HE染色检测急性应激后大鼠结肠病理变化。(彩图见图版二)
3讨论
正常菌群是寄居在正常生物体开放性部位的微生物群,正常时对机体有益无害,并与宿主保持动态平衡的生态体系,主要分布于机体与外界接触和相通的腔道,如口腔、鼻咽、肠道和泌尿生殖道等,尤以肠道菌群及其谱系分布为目前微生物学等领域研究的热点[9]。
肠道菌群是一类分布于生物体肠道的正常微生物群体,可通过其合成机体所需的多种营养物质,如维生素、蛋白质、金属元素等[8,10]。人体肠道内寄生着10万亿个细菌,有500~1 000个种类,按照其功能不同可分为有益菌、中性菌、有害菌,这些细菌不仅影响人体的体重、消化能力、抵御感染和自体免疫疾病的患病风险,而且可控制人体对癌症治疗药物的反应,一旦肠道菌群紊乱,将导致严重的疾病。按照细菌数目的多少,肠道菌群又可分为主要(优势)菌群和次要菌群,前者指肠道菌群中数量大或种群密集度大的细菌,包括类杆菌属、优杆菌属、双歧杆菌属、瘤胃球菌属和梭菌属等专性厌氧菌[11]。该类菌群是宿主发挥生理功能的主要菌群,很大程度上影响宿主整个菌群的功能,决定着菌群对宿主的生理及病理调控。后者指肠道菌群数量较少或种群密集度小的细菌,主要为需氧菌或兼性厌氧菌,如大肠杆菌和链球菌等,流动性大,有潜在致病性。

图2 ERIC-PCR检测急性应激后大鼠胃、回肠、盲肠、结肠菌群变化图谱Fig.2 The change rule of intestinal flora profile of the stomach, ileum, cecum and colon in acute stress rats by ERIC-PCR.A. ERIC-PCR检测急性应激后大鼠胃菌群变化图谱;B.ERIC-PCR检测急性应激后大鼠回肠菌群变化图谱;C.ERIC-PCR检测急性应激后大鼠盲肠菌群变化图谱;D.ERIC-PCR检测急性应激后大鼠结肠菌群变化图谱。
优势菌群与微生境的特征密切相关,以厌氧菌为主的优势菌群,一般生存在清除速率较低、营养丰富的微生境,如结肠;而兼性或需氧菌群一般生活在清除速率高的微生境,如小肠近端[12]。因此,研究机体不同腔道分段区域的优势菌群,特别是应激刺激后优势菌群的变化有利于该应激因素所致疾病的提前预防和治疗。本文基于我们长期从事急慢性应激后机体组织及腔道菌群生物学功能及其预防的研究,设计利用水浸束缚应激法建立大鼠急性应激模型以模拟人体急性应激状态,进而结合ERIC-PCR方法检测肠道菌群的变化。
肠道细菌基因间重复序列(enterobacterial repetitive intergenic consensus,ERIC)是一类主要分布于肠道细菌中的基因间重复序列,最早由Sharples等[13]于1990年在大肠杆菌基因组序列中发现并命名。1991年Hulton等在大肠杆菌、沙门氏菌等肠道细菌基因组中也发现了ERIC序列。同年,Versalovic等利用ERIC序列设计了PCR引物,建立了ERIC-PCR扩增技术,即利用ERIC核心的高度保守序列设计引物进行PCR扩增,通过分析ERIC-PCR图谱判定肠道菌群中优势菌群的分布变化[14]。随着研究的不断深入,ERIC-PCR技术已经被广泛地应用于细菌分类和菌种鉴定。本文采用ERIC-PCR技术鉴定了急性应激处理后大鼠胃、回肠、盲肠、结肠菌群的变化图谱,分析发现急性应激后大鼠胃肠道菌群发生了特征性变化,如胃部菌群1 000~2 000 bp条带消失、250~500 bp出现新条带,回肠菌群250~500 bp条带消失,盲肠菌群100~250 bp和500~750 bp出现新条带,结肠菌群250~500 bp和750 bp左右出现新条带。后续我们将结合分子克隆技术收集优势菌群条带进行主条带分析,通过序列比对判定急性应激刺激下机体胃肠道菌群的变化规律,进而为基于肠道菌群调控急性应激反应的研究提供重要参考。
大鼠体重和胃肠道组织病理结果显示,急性应激处理前后二者基本没有变化,分析可能是急性应激的时间较短,未引起二者发生明显的特征性变化,但行为学结果显示急性应激导致了大鼠的行为学反应迟钝,说明急性应激模型造模成功。从ERIC-PCR的结果看,胃部和回肠特征性条带较少,而盲肠和结肠特征性条带较多,说明从肠道菌群的角度干预急性应激重点从盲肠和结肠入手。然而,通过仔细比对对照组和模型组发现,虽然有限特性条带在模型组比较明显,带同组6只大鼠的胃肠道菌群的变化差异还是比较大,也说明仅依赖有限样本研究肠道菌群变化的不稳定性,后续我们将进一步优化实验条件及加大样本量以准确判定胃肠道菌群与急性应激的关系。
参考文献
[1]程灵芝, 李川云, 刘晓红, 等. 急性应激干预的原则和方法[J]. 中国临床康复, 2003, 3: 474-475.
[2]贾博琦. 急性应激性溃疡[J]. 中级医刊, 1986, 9(5): 517.
[3]彭云丽. 慢性应激诱发抑郁行为的炎性机制研究[D].上海:第二军医大学, 博士学位论文, 2013.
[4]林 琨. 战时应激状态与心律失常、猝死的关系及预防[D]. 北京:中国人民解放军军医进修学院,博士学位论文, 2010.
[5]朱 霞 , 杨业兵, 张华军,等. 重大军事任务下军人急性应激反应特点[A]. 见:中国心理学会成立90周年纪念大会暨第十四届全国心理学学术会议论文集[C].西安, 2011.
[6]李川云. 急性应激研究进展[J]. 中国保健营养:临床医学学刊, 2009, (11):174-175.
[7]何玉玲, 王东耀, 李 莉. 对急性应激障碍的心理干预[J]. 中国疗养医学, 2009, (11):1001-1002.
[8]段丽萍. 心理应激在功能性胃肠病发病中的潜在机制[J]. 中华消化杂志, 2011, (6):361-363.
[9]梁仲惠, 梅永红. 肠道菌群失调与消化系疾病[J]. 华南国防医学杂志, 2005, (3):37-40.
[10]管远志. 肠道菌群及其生物学意义[J]. 临床儿科杂志, 2009, (11):1095-1097.
[11]李文建. 肠道需氧优势菌群分离方法的建立及初步应用[J]. 中国微生态学杂志, 1999, (5):315-316.
[12]李晓芳, 刘 洋, 文 姝, 等. 小鼠肠道优势菌群失衡肠黏液sIgA、黏液素的变化[J]. 中国微生态学杂志, 2010, (6):485-488.
[13]孙永艳, 申 泉, 李艳琴. 肠杆菌基因间重复共有序列及ERIC-PCR[J]. 生命的化学, 2004, (4):288-290.
[14]杨 柳, 张邑帆, 郑 华, 等. ERIC-PCR及其指纹图谱技术的研究[J]. 中国微生态学杂志, 2010,22 (9):845-847.
Rat Gastrointestinal Histopathological Changes and its Intestinal Flora Profile Analysis Using ERIC-PCR after Acute Stress
ZHU Xiao-hui1,2, ZHANG Cheng-gang2, LIU Hai-feng1,2*
1.DepartmentofGastroenterology,GeneralHospitalofArmedPolice,Beijing100039,China;2.BeijingInstituteofRadiationMedicine,AcademyofMilitaryMedicalSciences,Beijing100850,China
Abstract:In order to study the feasibility of establishing the acute stress model based on water-immersion and restraint stress, and observe the histopathological change of stomach, ileum, cecum and colon using HE staining, and further identify the change rule of intestinal flora profile by ERIC-PCR. The total healthy male rats were randomly devided into two groups: control group and model group. Rats were regularly raised in control group, and model group were placed in a homemade constraint cages after inhalation anesthesia with isoflurane, and then immersed in 23±2℃ water for 5h when it revived. Then, the rat body weight was recorded and had on open field test and forced swimming test. Finally, rats were dislocated to collect the tissues and its contents of stomach, ileum, cecum and colon to perform HE staining and ERIC-PCR identifying respectively. We gathered the images to study the gastrointestinal histopathological changes and its intestinal flora profile analysis using ERIC-PCR after acute stress. Comparing with control, the rat body weight had no significantly variation, the number of through significantly decreased, the number of upright significantly decreased, the number of grooming significantly decreased, and the no moving time of forced swimming significantly prolonged. Furthermore, the gastric mucosa and the microvilli of intestinal tract were not damaged, and no nuclei deeply staining, and several obviously changing characteristic bands in the intestinal flora were appeared. This study successfully established the acute stress model, and followed with HE staining and ERIC-PCR to provide a significant reference of studying on the intestinal flora profile based on rat acute stress model, and had a significant application value.
Key words:rat acute stress model; HE staining; behavior; intestinal flora; ERIC-PCR
收稿日期:2015-12-08; 接受日期:2016-03-03
作者简介:朱晓慧,主治医师,研究方向为胃肠道消化。E-mail: zxh13624954186@163.com。*通信作者:刘海峰,主任医师,研究方向为胃肠道消化。E-mail: haifengliu333@163.com
DOI:10.3969/j.issn.2095-2341.2016.03.09
