冷冻胚胎印记基因H19的DNA甲基化状态研究*
2016-06-17施晓鋆陈士岭郑海燕王乐乐吴雅琴
施晓鋆, 陈士岭, 郑海燕, 王乐乐, 吴雅琴
(1.贵阳市第二人民医院 妇产科, 贵州 贵阳 550081; 2.南方医科大学南方医院 妇产科生殖中心, 广东 广州 510515)
冷冻胚胎印记基因H19的DNA甲基化状态研究*
施晓鋆1, 陈士岭2, 郑海燕2, 王乐乐2, 吴雅琴2
(1.贵阳市第二人民医院 妇产科, 贵州 贵阳550081; 2.南方医科大学南方医院 妇产科生殖中心, 广东 广州510515)
[摘要]目的: 比较研究常规慢速冷冻和玻璃化冷冻后的人类早期胚胎印记基因H19的DNA甲基化状态,初步了解低温冷冻对胚胎基因印记的影响。方法: 收集胚胎移植术后正常受精的低质量的第3天胚胎152个,进行冷冻、复苏,其中常规慢速冷冻胚胎78个,玻璃化冷冻胚胎74个,另收集70个新鲜未冷冻胚胎作为对照;记录3种类型单个胚胎Bisulfite-PCR扩增个数,采用结合重亚硫酸盐限制性酶分析法检测胚胎印记基因H19的DNA甲基化状态。结果: 慢速冷冻胚胎、玻璃化冷冻胚胎及新鲜未冷冻胚胎的单个胚胎Bisulfite-PCR扩增分别成功40、53、58个;慢速冷冻胚胎、玻璃化冷冻胚胎及新鲜未冷冻胚胎H19基因的平均甲基化程度分别为(44.8±6.4)%、(47.5±5.6)%及(46.7±6.0)%,异常甲基化率分别为10.0%(4/40)、13.2%(7/53)及3.4%(2/58);3组胚胎的甲基化程度和异常甲基化率比较,差异无统计学意义(P>0.05)。结论: 低温冷冻不增加人类胚胎甲基化异常的发生率。
[关键词]胚胎研究; 胚胎移植; 甲基化; 生殖技术,辅助; 印记基因,H19; 慢速冷冻; 玻璃化冷冻
辅助生殖技术(ART)不同于自然妊娠的过程,较多的学者关注ART出生后代的甲基化等表观遗传学风险。有研究认为卵细胞、早期胚胎是DNA甲基化易于变化的敏感时期,药物促排卵、体外培养等技术环节可能影响甲基化的擦除、重建和维持,从而诱发配子、胚胎出现印记基因甲基化异常[1]。国外的一些流行病学研究也报道ART子代可能有较高的基因印记疾病发病率,例如Beckwith-Wiedemann综合征(BWS)和Angelman综合征(AS)[2]。BWS、AS的发病涉及染色体11p15区域的一系列印记基因,其中H19基因研究得较为成熟[3-4]。胚胎冷冻是辅助生殖临床常规开展的技术,主要包括慢速冷冻和玻璃化冷冻(vitrification)2种方法。低温、冷冻保护剂毒性等因素一直受到各种研究的关注,而有关冷冻技术对胚胎基因印记影响的研究较少,且局限在动物实验。研究冷冻技术对人类胚胎基因印记的影响有助于评价ART技术的安全性。本研究收集人类第3天(Day3)冷冻胚胎和新鲜未冷冻胚胎,检测并比较印记基因H19的DNA甲基化状态,初步探讨冷冻技术对胚胎基因印记的影响。
1材料与方法
1.1研究对象
本研究经医院伦理委员会批准。选择常规体外受精(IVF)或者卵胞浆内单精子显微注射(ICSI)治疗的患者,经知情同意后收集患者选择丢弃的低质量Day3胚胎。冷冻复苏胚胎为胚胎移植术后收集正常受精(2PN)的低质量的Day3胚胎进行常规慢速冷冻或玻璃化冷冻保存,其中慢速冷冻胚胎78个,玻璃化冷冻胚胎74个,分别解冻后用于印记基因甲基化分析。收集胚胎移植术后70个正常受精(2PN)的低质量Day3的新鲜未冷冻胚胎作为对照。
1.2方法
1.2.1胚胎的冷冻和复苏胚胎的慢速冷冻复苏采用试剂盒Quinns Advantage Embryo Freeze Kit 和Quinns Advantage Thaw Kit (Sage, Pasadena, CA, USA),按说明书进行操作。玻璃化冷冻复苏以冷冻环为胚胎载体,冷冻保护剂使用丙二醇和乙二醇,按照文献[5]方案步骤进行操作。
1.2.2H19甲基化状态检测采用结合重亚硫酸盐的限制性酶分析(combined bisulfite restriction analysis, COBRA)法对单个胚胎进行DNA甲基化分析[6]:(1)使用低熔点琼脂糖(LMP),配合CpGenome DNA Modification Kit (Chemicon International, Temecula, CA)对胚胎细胞DNA进行Bisulfite转化;(2)以转化的DNA为模板进行PCR扩增(H19基因 Genbank号为AF125183, 起止位置为7870~8100),上游引物F1为5′- AGGTGTTTTAGTTTTATGGATGATGG -3′,上游引物F2为5′-TGTATAGTATATATATGGGTATTTTTGGAGGTTT -3′,下游引物R为5′-TCCTATAAATATCCTATTCCCAAATAACC-3′;(3)PCR产物为230 bp片段(代表母系非甲基化等位基因)或130 bp和100 bp片段(代表父系甲基化等位基因),甲基化程度为130 bp和100 bp条带灰度的百分比。正常胚胎应同时具有母系和父系H19等位基因,甲基化程度约为50%。采用TaqI酶切后,以4%琼脂糖凝胶电泳分离(电压为110 V,时间30 min),电泳结束后采用GAS76WL-T20凝胶成像系统拍照。甲基化状态分析采用Labworks image acquisition and analysis software (Ultra-violet Products, Ltd., Cambridge, UK) 对凝胶图片进行灰度扫描计算。
1.3统计学分析
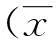
2结果
2.1单个胚胎Bisulfite-PCR扩增结果
3种类型的胚胎PCR成功率显著不同(χ2=17.58,P=0.000)。慢速冷冻胚胎的PCR成功率低于新鲜胚胎(χ2=16.44,P=0.000)和玻璃化冷冻胚胎(χ2=6.61,P=0.01); 玻璃化冷冻胚胎与新鲜胚胎的PCR成功率比较,差异无统计学意义(χ2=2.57,P=0.10)。见表1、图1。
2.2H19 基因DNA甲基化程度与甲基化率
慢速冷冻胚胎、玻璃化冷冻胚胎及新鲜未冷冻胚胎H19基因的平均甲基化程度比较,差异无统计学意义(P=0.127),见表2。慢速冷冻胚胎、玻璃化冷冻胚胎及新鲜未冷冻胚胎H19基因的异常甲基化发生率比较,差异无统计学意义(χ2=3.48,P=0.175),见表3。
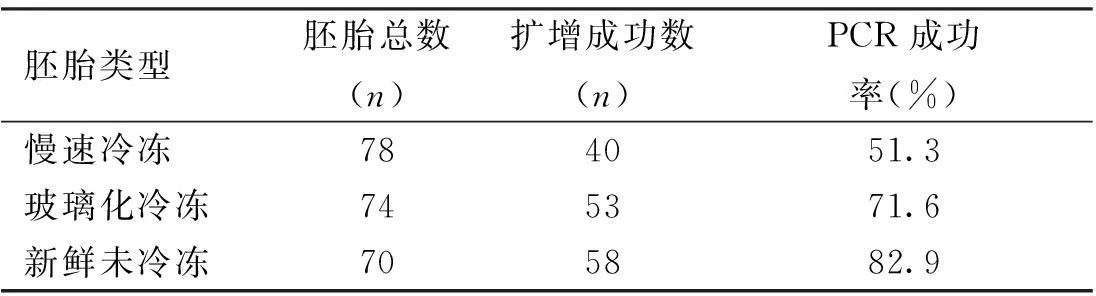
表1 3种类型的单胚胎bisulfite-PCR的扩增结果
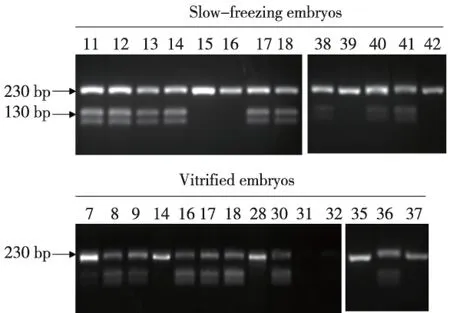
注: Slow-freezing embryos所示为慢速冷冻胚胎检测结果,15、16、39及42号胚胎仅出现230 bp,为母系非甲基化片段,属异常低甲基化状态(甲基化程度为0%),其余胚胎为正常甲基化状态;Vitrified embryos所示为玻璃化冷冻胚胎检测结果,7号胚胎的甲基化程度为8.7%(甲基化片段明显弱),为异常低甲基化;14、28、35及37号胚胎仅出现230bp的非甲基化片段,为异常低甲基化状态(甲基化程度为0%)。图1 慢速冷冻及玻璃化冷冻胚胎H19甲基化结果(COBRA)Fig.1 The COBRA results for frozen embryos in slow-freezing and vitrification freezing

胚胎类型nH19甲基化程度(%)慢速冷冻3644.8±6.4玻璃化冷冻4547.5±5.6新鲜未冷冻5646.7±6.0
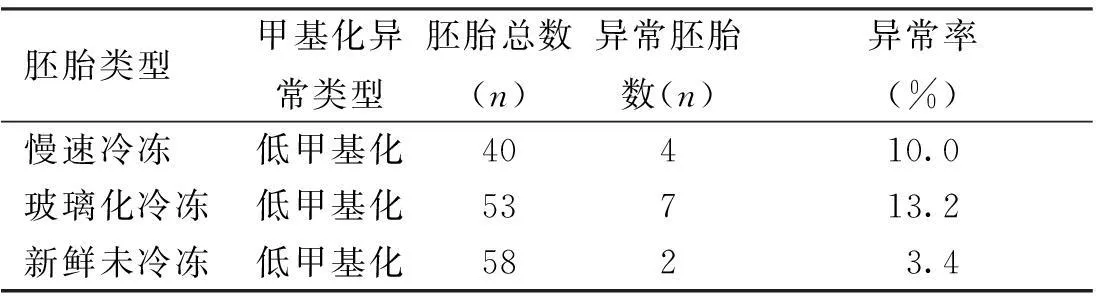
表3 3种类型胚胎H19基因的异常甲基化率
3讨论
低温冷冻对早期胚胎的影响一直存在争议,冷冻后胚胎的基因表达、细胞凋亡等方面已有较多研究。早期胚胎植入前容易发生甲基化的改变,H19基因属于父系甲基化印记基因,全长3 kb,共含有5个外显子,4个内含子。动物实验发现玻璃化冷冻后的小鼠胚胎出现H19基因甲基化状态异常和表达量的显著增加,提示冷冻技术可能影响DNA甲基化状态[7]。
本研究中仅有51.3%的慢速冷冻胚胎能成功的通过bisulfite-PCR扩增分析,其原因可能是慢速冷冻产生的冰晶对细胞造成了机械性损害。玻璃化冷冻由于不产生冰晶,对细胞的机械性破坏小,因而PCR成功率与新鲜胚胎无显著差别。由于温度、pH值以及培养液营养成分等因素,体外培养的早期胚胎存在一定比例的甲基化异常[8]。本研究亦发现3.4%的新鲜胚胎出现H19甲基化异常;慢速冷冻、玻璃化冷冻胚胎H19基因甲基化异常率分别为10.0%、13.2%,与新鲜胚胎比较无显著差别(P=0.175);定量分析提示3组胚胎的H19基因甲基化程度亦无显著差别(P=0.127)。
DNA甲基化的建立和维持是依赖DNA甲基化转移酶类(DNA methyltransferases, Dnmts)和甲基化结合蛋白(methyl-binding domain proteins)[8-10]。推测体外培养环境、冰晶、高浓度保护剂等因素可能影响了Dnmts的活性,从而导致胚胎出现甲基化异常。冷冻胚胎与新鲜胚胎比较,甲基化异常率无统计学差别,初步认为冷冻操作可能不增加胚胎甲基化异常的发生率,但冷冻胚胎的甲基化异常率有增高的趋势,需要扩大样本量,扩展基因种类进一步研究。
本研究检测的胚胎为不适合移植的低质量胚胎。低质量的胚胎一般作放弃处理,但在临床实践中,缺乏优质胚胎的情况下,部分患者仍会选择质量差的胚胎进行移植。低质量胚胎获得妊娠的机率较低,且出生子代的健康状况尚未见系统的研究报道,根据本研究的结果可初步推测,使用低质量胚胎可能会增加子代印记缺陷的风险。
4参考文献
[1] Hiura H, Okae H, Chiba H, et al. Imprinting methylation errors in ART[J]. Reprod Med Biol, 2014 (4):193-202.
[2] Halliday J, Oke K, Breheny S, et al. Beckwith-Wiedemann syndrome and IVF: a case-control study[J]. Am J Hum Genet, 2004 (3):526-528.
[3] Ishida M, Moore GE. The role of imprinted genes in humans[J]. Mol Aspects Med, 2013 (4):826-840.
[4] Choufani S, Shuman C, Weksberg R.Molecular findings in Beckwith-Wiedemann syndrome.[J]. Am J Med Genet C Semin Med Genet, 2013 (2):131-140.
[5] 施晓鋆,洪焱,黄绘,等. 不同载体和冷冻保护剂用于人胚胎玻璃化冷冻的初步研究.[J]. 中国计划生育学杂志, 2009(9):546-549.
[6] Chen SL, Shi XY, Zheng HY, et al. Aberrant DNA methylation of imprinted H19 gene in human preimplantation embryos.[J]. Fertil Steril, 2010(6):2356-2358.
[7] Wang Z, Xu L, He F. Embryo vitrification affects the methylation of the H19/Igf2 differentially methylated domain and the expression of H19 and Igf2[J]. Fertil Steril, 2010 (8):2729-2733.
[8] Shi XY, Chen SL, Zheng HY, et al. Abnormal DNA Methylation of Imprinted Loci in Human Preimplantation Embryos[J]. Reprod Sci, 2014(8):978-983.
[9] Petrussa L, Van de Velde H, De Rycke M. Dynamic regulation of DNA methyltransferases in human oocytes and preimplantation embryos after assisted reproductive technologies[J]. Mol Hum Reprod, 2014 (9):861-874.
[10]Denomme MM, Mann MR. Maternal control of genomic imprint maintenance[J]. Reprod Biomed Online, 2013 (6):629-636.
(2015-12-15收稿,2016-04-23修回)
中文编辑: 吴昌学; 英文编辑: 刘华
Research of DNA Methylation Status of Frozen Embryonic ImprintingH19 Gene
SHI Xiaoyun1, CHEN Shiling2, ZHENG Haiyan2, WANG Lele2, WU Yaqin2
(1.DepartmentofGynaecologyandObstetrics,theSecondPeople'sHospitalofGuiyang,Guiyang550081,Guizhou,r">China; 2.Reproductivecenter,DepartmentofGynaecologyandObstetrics,NanfangHospitalofSouthernmedicalUniversity,Guangzhou510515,Guangdong,China)
[Abstract]Objective: To investigate the DNA methylation status of human early embryonic imprinting H19 gene after slow-freezing or vitrification freezing, and preliminarily explore the effect of low temperature freezing on embryonic imprinting gene. Methods: 152 Day3-embryos (2PN, bad quality) with normal fertilization after embryo transplantation were collected and underwent freezing and resuscitation, of which 78 embryos were conducted by slow-freezing, 74 embryos by vitrification freezing. Besides, 70 fresh non-frozen embryos were collected as controls. The number of Bisulfite-PCR amplification of a single embryo was recorded in the three types. The Combined Bisulfite Restriction Analysis (COBRA) was used to determine H19 methylation status after embryos thawing. Results: The number of Bisulfite-PCR amplification of a single embryo in the three groups was 40 (slow-freezing), 53 (vitrification freezing) and 58 (fresh non-frozen), respectively. The average degree of H19 methylation in the three groups was (44.8±6.4)% (slow-freezing), (47.5±5.6)% (vitrification freezing) and 46.7%±6.0% (fresh non-frozen), respectively. The rate of abnormal methylation was 10.0% (slow-freezing), 13.2% (vitrification freezing) and 3.4% (fresh non-frozen), respectively. There was no statistical difference of H19 methylation degree and rate of abnormal methylation between three groups. Conclusion: The freezing technique may not increase the incidence of abnormal methylation in human embryos.
[Key words]embryo research; embryo transplantation; methylation; reproductive technology,auxiliary; imprinted genes,H19; slow-freezing; vitrification freezing
*[基金项目]国家自然科学基金项目(81460237)
[中图分类号]R714.8
[文献标识码]A
[文章编号]1000-2707(2016)05-0524-03
DOI:10.19367/j.cnki.1000-2707.2016.05.007
网络出版时间:2016-05-13网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160513.2129.048.html
