PPARγ激动剂干预对急性胰腺炎小鼠肝损伤的影响*
2016-06-15马增翼于文光田克立
马增翼,许 刚,于文光,田克立△
(1.济南军区第456医院,济南 250031;2.山东大学医学院,济南 250012)
PPARγ激动剂干预对急性胰腺炎小鼠肝损伤的影响*
马增翼1,许刚1,于文光2,田克立2△
(1.济南军区第456医院,济南 250031;2.山东大学医学院,济南 250012)
[摘要]目的探讨过氧化物酶体增殖物激活受体γ(PPARγ)激动剂罗格列酮对急性胰腺炎小鼠肝损伤的影响并对其机制进行初步研究。方法72只健康雄性昆明小鼠分为3组,急性胰腺炎组(AP组)、罗格列酮预处理组(AP-ROS组)和生理盐水组(NS组),每组24只。分别于建模后6 h、12 h和24 h处死小鼠,全自动生化分析仪检测血清淀粉酶、丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)水平。运用RT-PCR 方法检测肝脏组织NF-κB和PPARγ mRNA表达,应用Western blot技术检测肝脏组织PPARγ和NF-κB p65蛋白表达。结果小鼠血清淀粉酶、ALT 和AST水平在相对应的各时间点AP组比NS组明显升高(P<0.01),AP-ROS组较AP组明显降低(P<0.01)。AP组肝脏组织PPARγ mRNA和蛋白表达在造模后6 h和12 h均低于NS组(P<0.05);AP-ROS组PPARγ mRNA和蛋白表达在各时间点均明显高于AP组和NS组(P<0.01)。AP组肝脏组织NF-κB mRNA和NF-κB p65蛋白表达水平在各时间点与AP-ROS组和NS组相比较均升高(P<0.01)。结论NF-κB与小鼠急性胰腺炎肝损伤有明显关系,PPARγ在肝损伤中的表达受到抑制;罗格列酮在AP早期能增强PPARγ表达,抑制NF-κB的表达。
[关键词]核因子-κB;急性胰腺炎;肝损伤;雨蛙肽;过氧化物酶体增殖物激活受体γ
急性胰腺炎(acute pancreatitis,AP)是临床上的一种常见病,近年来发病率逐渐上升[1]。AP患者的严重程度不一,80%的患者为轻型胰腺炎,20%的患者发展为重型急性胰腺炎(severe acute pancreatitis,SAP),病死率可高达29.8%,其中肺、肝、肾等多器官功能衰竭是导致死亡的主要原因,尤以肝衰竭的病死率最高,可达到83%[2-5]。研究表明核因子-κB (NF-κB)是一种具有多向转录调节作用的蛋白质,能促进促炎因子基因的表达,在炎症反应中起着重要的调控作用[6-7]。过氧化物酶体增殖物激活受体γ(PPARγ)是一类依赖配体活化的转录因子,许多研究表明PPARγ通过抑制NF-κB的活化来发挥抗炎作用[8-10]。本实验通过建立雨蛙肽诱导的小鼠急性胰腺炎模型,观察NF-κB和PPARγ在AP和药物干预后肝脏中的表达情况,探讨AP肝功能损伤机制及新的治疗途径。
1材料与方法
1.1实验材料雨蛙肽购自美国Sigma公司,罗格列酮购自CAYMAN CHEMICAL COMPONY,Trizol 试剂盒购自Invitrogen公司,RT-PCR逆转录试剂盒购自Fermentas公司,鼠抗NF-κBp65和PPARγ单克隆抗体和兔抗β-actin单克隆抗体均购自Santa Cruz公司,辣根过氧化物酶标记山羊抗小鼠IgG和山羊抗兔IgG均购自金思特科技有限公司,PIPA裂解液和BCA蛋白定量试剂盒均购自盖宁生物科技(北京)有限公司。
1.2方法
1.2.1实验动物模型与分组健康雄性昆明小鼠72只,体质量(30±2)g,购自山东大学实验动物中心。将72只健康雄性昆明小鼠分为3组,即急性胰腺炎组(AP组)、罗格列酮预处理组(AP-ROS组)和生理盐水组(NS组),每组各24只。实验前小鼠禁食12 h,自由饮水。AP组小鼠腹腔注射雨蛙肽(50 μg/kg),1 h注射1次,共注射7次。AP-ROS组在建立AP模型前30 min腹腔内按10 mg/kg体质量注入罗格列酮。NS组用与AP组相同容积的生理盐水腹腔内注射。
1.2.2血清学检测各组动物分别在模型制备后的6、12、24 h,摘眼球取血,静置60 min,血液凝固后,3 000 r/min离心10 min,取血清,采用TOSHIBA-40FR全自动生化分析仪测定血清淀粉酶、ALT和AST水平,结果以国际单位(U/L)表示。
1.2.3组织学检查取血后引颈脱臼处死并解剖小鼠,沿前正中线剪开胸腹膜,收集小鼠胰腺和肝脏组织,一部分用于组织病理学检查,另一部分迅速置入冻存管内放入液氮冻存,用于进行RT-PCR和Western blot实验。
1.2.4肝脏组织NF-κB和PPARγ mRNA表达测定肝脏组织总RNA按Trizol试剂盒说明书提取,紫外分光光度计测定总RNA含量及A260/A280值(A260/A280在1.8~2.0)。逆转录反应按RevertAidTMFirst Strand cDNA Synthesis试剂盒(Invitrogen公司)说明书进行,合成cDNA。PCR反应体系(50 μL):双蒸水 37.5 μL,10 mmol/L dNTP 1 μL,10×PCR buffer 5 μL,25 mmol/L MgCl2(加之前要摇匀) 3 μL,上下游引物各1 μL,模板cDNA 1 μL。PPARγ引物序列为:上游引物5′-CGT GAT GGA AGA CCA CTC GC-3′,下游引物5′-AAC CTG ATG GCA TTG TGA GA-3′,扩增产物长度约477 bp;β-actin引物序列为:上游引物5′-TGG TGG GAA TGG GTC AGA-3′,下游引物 5′-ACG GTT GGC CTT AGG GTT-3′,扩增产物长度约218 bp;NF-κB引物序列为:上游引物5′-GTG ACA AGC CTG TAG CC-3′,下游引物 3′-CCA GAT GAA ACC CTA GTA A-5′,扩增产物长度约867 bp。PCR反应条件:94 ℃ 30 s,56 ℃ 45 s,72 ℃ 1 min,共35个循环。PCR扩增产物进行1%琼脂糖凝胶电泳,利用AlphaImager2200软件进行扩增条带灰度测定,将PPARγ、NF-κB扩增条带的扫描灰度值与内参照β-actin的灰度值的比值(即ratio值)作为该基因RNA的表达指数。
1.2.5Western blot检测PPARγ和NF-κB蛋白表达组织蛋白质按PIPA裂解液(盖宁生物科技有限公司)说明书提取,蛋白质浓度测定按BCA蛋白定量试剂盒(盖宁生物科技有限公司) 说明书操作。每个标本取20 μg总蛋白上样,以10%丙烯酰胺凝胶进行SDS-PAGE电泳分离后,恒流电转移到硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h。以1∶1 000稀释的小鼠抗PPARγ、NF-κB和兔抗β-actin单克隆抗体室温轻摇杂交6 h,以1∶4 000稀释的辣根过氧化物酶山羊抗小鼠和山羊抗兔二抗室温轻摇杂交2 h,用ECL发光试剂盒进行化学发光,显影,定影,最后进行凝胶图像分析,结果以目的蛋白灰度值与内参蛋白灰度值的比值来表示。

2结果
2.1血清淀粉酶变化AP组和AP-ROS组在各时间点的血清淀粉酶水平均高于NS组(P<0.01),其中12 h血清淀粉酶水平最高,AP-ROS组各时间点血清淀粉酶水平均显著低于AP组(P<0.01),见表1。

表1 各组血清淀粉酶水平比较±s,U/L)
2.2药物干预对小鼠血清ALT和AST的影响与NS组相比,AP组和AP-ROS组小鼠血清ALT和AST水平在各时点均升高,差异有统计学意义(P<0.01)。AP-ROS组与AP组相比较,血清ALT和AST水平均明显下降(P<0.05),见表2。
2.3药物干预对小鼠肝脏组织PPARγ和NF-κB mRNA表达的影响AP组肝脏组织PPARγ mRNA表达水平在制模后各时点较NS组降低,在6 h和12 h 两个时点差异有统计学意义(P<0.05),AP-ROS组肝脏组织PPARγ mRNA表达水平在造模后各时点明显高于AP组和NS组,且差异有统计学意义(P<0.01),见表3、图1。AP组肝脏组织NF-κB mRNA表达水平在各时点与NS组相比较均升高,其中以12 h时升高最显著(P<0.01);AP-ROS组肝脏组织NF-κB mRNA表达的变化趋势与AP组相似,但各时点NF-κB mRNA表达量均低于同时点AP组,二者比较差异有统计学意义(P<0.01),见表3、图2。

表2 药物干预对小鼠血清ALT和AST水平的影响±s)

表3 肝脏组织PPARγ和NF-κB mRNA表达

1:AP-ROS组24 h;2:AP组24 h;3:AP-ROS组12 h;4:AP组12 h;5:AP-ROS组6 h;6:AP组6 h;7:NS组6 h。
图1小鼠肝脏组织PPARγ mRNA 的表达
2.4药物干预对小鼠肝脏组织PPARγ和NF-κBp65蛋白表达的影响Western blot方法检测了小鼠肝脏组织内的PPARγ蛋白表达,结果发现AP组PPARγ蛋白表达在各时点均较NS组低(P<0.05);AP-ROS组肝脏组织PPARγ蛋白表达在各时点均比AP组和NS组高(P<0.01),见表4、图3。肝脏组织NF-κBp65蛋白在各时点检测的表达结果均为:AP组>AP-ROS组>NS组,在各时点各组间均差异有统计学意义(P<0.01),见表4、图4。

1:AP-ROS组24 h;2:AP组24 h;3:AP-ROS组12 h;4:AP组12 h;5:AP-ROS组6 h;6:AP组6 h;7:NS组6 h。
图2小鼠肝脏组织NF-κB mRNA的表达
表4 肝脏组织PPARγ和NF-κBp65蛋白表达
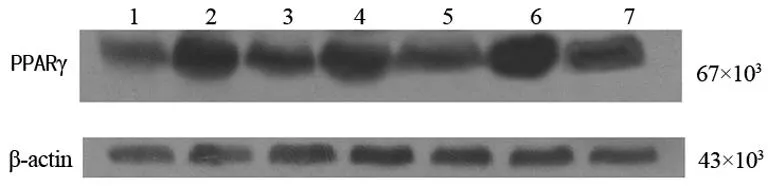
1:AP-ROS组24 h;2:AP组24 h;3:AP-ROS组12 h;4:AP组12 h;5:AP-ROS组6 h;6:AP组6 h;7:NS组6 h。
图3小鼠肝脏组织PPARγ蛋白表达
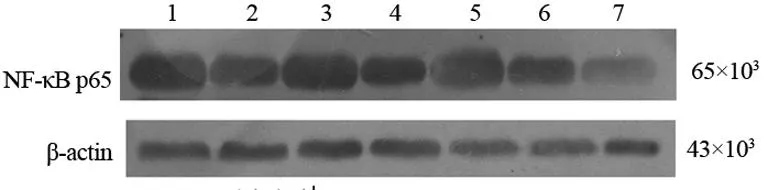
1:AP-ROS组24 h;2:AP组24 h;3:AP-ROS组12 h;4:AP组12 h;5:AP-ROS组6 h;6:AP组6 h;7:NS组6 h。
图4小鼠肝脏组织NF-κBp65蛋白表达
3讨论
AP常伴有全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS)发生,若得不到有效的控制,可并发多器官功能衰竭综合征(multiple organ dysfunction syndrome,MODS),最终危及生命。肝脏具有物质代谢、分泌、排泄和生物转化等功能且其血供丰富,因此在AP时非常容易合并肝损伤。肝脏是AP时胰外受损的主要器官之一,80%患者有肝功能损害[11]。肝脏损害程度与AP严重程度密切相关,且影响其病程和预后。本实验通过建立雨蛙肽诱导的小鼠AP模型,观察NF-κB和PPARγ在AP和药物干预后肝脏中的表达情况,探讨AP肝功能损伤机制及新的治疗途径。实验结果表明:与NS组相比,AP组和AP-ROS组小鼠血清淀粉酶、ALT和AST水平均明显升高,说明雨蛙肽诱导的小鼠AP发展过程中发生了肝功能损害;但应用罗格列酮后小鼠血清淀粉酶、ALT和AST升高的程度明显低于AP组,说明罗格列酮能有效地减轻AP小鼠肝损伤的程度。
NF-κB通常以同源或异源二聚体形式与其抑制蛋白IkBs非共价结合形成复合物,其中以p50/p65异源二聚体最常见,以无活性的形式存在于体内大多数细胞的细胞质中。当受到一定刺激后,NF-κB活化后进入细胞核内,诱导和协调靶基因表达。许多研究已表明,在炎症反应中可观察到NF-κB的活性增强,若抑制其活性则可阻止病程的进一步发展,有助于炎症尽早消退。Dunn等[11]通过动物实验发现,在AP早期的胰腺提取物中,NF-κB DNA结合活性明显增强,抑制NF-κB活性可阻止淀粉酶水平升高,促进炎症恢复。Satoh等[12]采用EMSA法检测了牛黄胆酸盐所致SAP小鼠腹膜和肺泡巨噬细胞中的NF-κB活化情况,结果发现NF-κB在造模后6 h就出现活化,认为在SAP早期阶段阻止NF-κB活动是防止多器官功能衰竭引起死亡的一种有效方法。为了探讨NF-κB是否参与了实验性小鼠胰腺炎造成的肝损伤。本实验用雨蛙肽复制小鼠AP模型,系统观测了NS组、AP组、AP-ROS组小鼠肝脏组织中NF-κB的mRNA和NF-κB p65蛋白表达情况,结果显示:NS组肝脏组织NF-κB微弱表达;AP组肝脏组织中NF-κB表达明显升高,以12 h升高最为显著,说明AP时肝脏组织中NF-κB被活化;AP-ROS组小鼠肝脏NF-κB的表达则明显低于AP组,表明ROS对AP小鼠肝脏NF-κB表达有抑制作用。近年来一系列实验证实,几种炎症介质(如IL-6、IL-8、TNF-α、单核细胞趋化蛋白-1等)与局部和系统组织损害有关,NF-κB的活化能增加这些引起体内免疫和炎症反应介质的表达[13-14]。作者推测NF-κB活性在AP时肝脏中被抑制的同时,也影响其他生物活性物质的进一步表达,从而阻止对其他脏器组织的损害。
近年研究发现PPARγ除参与糖和脂肪代谢、免疫调节、细胞生长和分化等过程外,还在炎症反应中发挥着重要作用。Rollins等[15]通过小鼠AP模型实验发现,预先用PPARγ激动剂能减轻AP的严重程度且呈剂量依赖性关系,认为PPARγ在AP早期阶段的炎症级联中起着直接作用。Ivashchenko等[16]的研究发现雨蛙肽对胰腺上皮PPARγ敲除小鼠所致炎症加重,且罗格列酮在水肿、巨噬细胞浸润和促炎细胞因子的表达方面的抗炎效应与对照组相比显著减弱,提示胰腺上皮PPARγ在抑制炎症过程中发挥重要作用。本试验结果显示,PPARγ在AP组肝脏中表达明显降低,用罗格列酮干预后,PPARγ表达量显著升高,得出结论与国外研究一致。
总之,本研究结果表明,肝脏NF-κB参与并能加重AP时肝损伤过程,罗格列酮有可能通过激活PPARγ的活性、抑制NF-κB的活化起到减轻肝脏损伤程度的作用,研究结果为AP治疗提供新的思路。对于肝脏损伤对AP恶化的影响及罗格列酮对NF-κB抑制的具体机制值得进一步探讨。
参考文献
[1]Bhatia M,Brady M,Shokuhi S,et al.Inflammatory mediators in acute pancreatitis[J].J Pathol,2000,190(2):117-125.
[2]Lund H,Tonnesen H,Tonnesen MH,et al.Long-term recurrence and death rates after acute pancreatitis[J].Scand J Gastroenterol,2006,41(3):234-238.
[3]Williams M,Simms HH.Prognostic usefullness of scoring systems in critically ill patients with severe acute pancreatitis[J].Crit Care Med,1999,27(10):901-907.
[4]陈畅,张文俊,刘岩,等.重症急性胰腺炎24例死亡病例分析[J].中华消化杂志,2007,27(6):382-384.
[5]Halonen KI,Pettila V,Leppaniemi AK,et al.Multiple organ dysfunction associated with severe acute pancreatitis[J].Crit Care Med,2002,30(6):1274-1279.
[6]Sen R,Baltimore D.Multiple nuclear factors interact with the immunoglobulin enhancer sequences[J].Cell,1986,46(5):705-716.
[7]Daniel SS,Gabriel P,Mei L,et al.15-Deoxy-D12,14-prostaglandin J2 inhibits multiple steps in the NF-kB signaling pathway[J].Proc Natl Acad Sci U S A,2002,97(9):4844-4849.
[8]Gabriel P,Amy LF,Sumito O,et al.A sumoylation-dependent pathway mediating transrepression of inflammatory response genes by PPARγ[J].Nature,2005,437(7059):759-763.
[9]Yi JH,Park SW,Kapadia R,et al.Role of transcription factors in mediating post-ischemic cerebral inflammation and brain damage[J].Neurochem Int,2007,50(7/8):1014-1027.
[10]Blamey SL,Imrie CW,Neill J,et al.Prognostic factors in acute pancreatitis[J].Gut,1984,25(12):1340-1346.
[11]Dunn JA,Li C,Ha T,et al.Therapeutic modification of nuclear factor-kB binding activity and tumor necrosis factor-a gene expression during acute biliary pancreatitis[J].Am Surg,1997,63(12):1036-1043.
[12]Satoh A,Shimosegawa T,Fujita M,et al.Inhibition of nuclear factor-kappaB activation improves the survival of rats with taurocholate pancreatitis[J].Gut,1999,44(2):253-258.
[13]Xue D,Zhang W,Zhang Y,et al.Adjusting effects of baicalin for nuclear factor-kappaB and tumor necrosis factor-alpha on rats with caerulein-induced acute pancreatitis[J].Mediators Inflamm,2006,5:26295.
[14]Algul H,Tando Y,Schneider G,et al.Acute experimental pancreatitis and NF-κB/Relactivation[J].Pancreatology,2002,2(6):503-509.
[15]Rollins MD,Sudarshan S,Firpo MA,et al.Anti-inflammatory effects of PPAR-gamma agonists directly correlate with PPAR-gamma expression during acute pancreatitis[J].J Gastrointest Surg,2006,10(8):1120-1130.
[16]Ivashchenko CY,Duan SZ,Usher MG,et al.PPAR-gamma knockout in pancreatic epithelial cells abolishes the inhibitory effect of rosiglitazone on caerulein-induced acute pancreatitis[J].Am J Physiol Gastrointest Liver Physiol,2007,293(1):G319-326.
The effect of PPARγ agonists in acute pancreatitis with hepatic injury*
Ma Zengyi1,Xu Gang1,Yu Wenguang2,Tian Keli2△
(1.456th Hospital of Ji′nan Military Region,Jinan,Shandong 250031,China;2.School of Medicine,Shandong University,Jinan,Shandong 250012,China)
[Abstract]ObjectiveTo observe the peroxidase body growth activated receptor γ (PPARγ) agonist rosiglitazone on acute pancreatitis in mice with hepatic injury and to investigate the mechanism of hepatic injury.MethodsSeventy-two male Kunming mice were randomly allocated into three groups(24 cases for each group):acute pancreatitis group(AP group),rosiglitazone group(AP-ROS group),saline group(NS group).Mice were killed at 6,12 and 24 h after induction of acute pancreatitis.Serum amylase,ALT and AST activities were measured.The expressions of NF-κB and PPARγ mRNA were assessed by RT-PCR.The expressions of NF-κB and PPARγ protein were assessed by Western blot.ResultsCompared with NS group,serum amylase,ALT and AST levels at each time point significantly increased in AP group(P<0.01);serum amylase,ALT and AST levels in AP-ROS group were significantly lower than those in AP group(P<0.01).Compared with NS group,the expressions of liver PPARγ mRNA and protein in AP group were markedly lower at 6 h and 12 h(P<0.05),and the expressions of PPARγ mRNA and protein in AP-ROS group were significantly higher than those in NS group and AP group(P<0.01).The expressions of liver NF-κB mRNA and NF-κB p65 protein in AP group were significantly higher than those in NS group and AP-ROS group at all time points(P<0.01).ConclusionThere are clear relationships between NF-κB and hepatic injury in acute pancreatitis.The expressions of PPARγ in injuried hepatic decreased.Rosiglitazone can increase the expressions of PPARγ and prevent the expressions of NF-κB in hepatic during the early phase of acute pancreatitis.
[Key words]NF-κB;acute pancreatitis;hepatic injury;cerulein;peroxidase body growth activated receptor γ
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.11.010
* 基金项目:山东省科技发展计划(2006GG2202021);山东省自然科学基金(Y2005C29)。
作者简介:马增翼(1979-),主治医师,主要从事消化内科工作。△通讯作者, E-mail:tiankeli@sdu.edu.cn。
[中图分类号]R34
[文献标识码]A
[文章编号]1671-8348(2016)11-1473-04
(收稿日期:2015-10-26修回日期:2015-12-31)
