普伐他汀和CRP对ADP诱导的血小板凝血酶受体PAR-1表达的调节*
2016-06-15楚罗湘周素娴覃月秋梁志山莫昌干王晓迪
楚罗湘,周素娴,杨 帆,覃月秋,梁志山,莫昌干,王晓迪
(广西医科大学第四附属医院心血管内科,广西柳州 545005)
普伐他汀和CRP对ADP诱导的血小板凝血酶受体PAR-1表达的调节*
楚罗湘,周素娴,杨帆,覃月秋,梁志山,莫昌干,王晓迪
(广西医科大学第四附属医院心血管内科,广西柳州 545005)
[摘要]目的探讨普伐他汀对二磷酸腺苷(ADP)诱导的血小板PAR-1表达的影响及机制。方法体外分离富血小板血浆,分别给予C反应蛋白(CRP)、普伐他汀干预和ADP刺激进行体外研究。试验分组分别为:对照组,单纯ADP组,低浓度普代他汀+ADP组,高浓度普伐他汀组+ADP组,CRP组,普伐他汀+CRP联合组。采用流式细技术检测PAR-1和LOX-1平均荧光强度(MFI)。采用酶联免疫试验检测TXB2和F1+2水平。结果5 μmol/L ADP刺激能促使血小板PAR-1表达增加35%。50 μg/mL CRP显著降低ADP诱导的血小板PAR-1的表达(P<0.01)。1 μmol/L、10 μmol/L普伐他汀均显著降低ADP诱导的血小板PAR-1的表达(P<0.01)。联合应用CRP和普伐他汀更能降低ADP诱导的血小板PAR-1表达,较单独使用CRP或普伐他汀降低更显著(P<0.05)。单纯ADP刺激后TXB2较基础时明显增高(P<0.01),50 μg/mL CRP、10 μmol/L普伐他汀干预后ADP刺激的TXB2分别下降为(112.68±24.48)pg/mL、(146.48±46.54)pg/mL,与单纯ADP刺激比较,差异均有统计学意义(P<0.01)。50 μg/mL CRP显著增加ADP诱导的F1+2水平(P<0.01),10 μmol/L普伐他汀对ADP诱导F1+2的生成无明显影响。普伐他汀呈浓度依赖性的方式降低ADP诱导的血小板LOX-1表达(1 μmol/L和10 μmol/L普伐他汀处理后MFI分别为:1.80±0.19和1.62±0.16),与单纯ADP刺激后LOX-1表达(MFI:3.16±0.23)比较,差异有统计学意义(P<0.01)。50 μg/mL CRP对ADP刺激的血小板LOX-1表达无明显影响。结论PAR-1在ADP 诱导的血小板活化中起重要作用,普伐他汀和CRP通过不同机制明显降低ADP诱导的血小板PAR-1的表达,提示在炎症状态下他汀仍能起着重要的抗血栓作用。
[关键词]C反应蛋白质;血小板;普伐他汀;凝血酶受体PAR-1
凝血酶是最强的血小板激活剂,人类血小板表达PAR-1和PAR-4两种凝血酶受体,PAR-1是人血小板最主要的凝血酶受体,低浓度凝血酶可与PAR-1结合激血小板[1]。临床研究发现PAR-1拮抗剂能减少心脏血栓事件发生[2]。
他汀类药物能改善心血管疾病的临床预后,这不仅与他汀药物降低低密度脂蛋白胆固醇有关,还与他汀调脂以外的多效性作用有关,如改善血管舒缩功能,促进血管再生及稳定易损斑块等,体内外的研究提示他汀药物还能减轻血栓负荷及抑制血小板活化,另外他汀的抗炎作用同样得到证实[3]。
C反应蛋白(CRP)是判断心血管事件发生的炎症因子,最近的研究发现CRP通过促发炎症和激活凝血系统而加重动脉硬化的进展[4]。然而有研究发现CRP对血小板的作用与其促血栓作用并不一致。PARIS临床研究发现多种他汀药物均能降低血小板PAR-1的表达,减少血小板的活化和血栓形成[5],然而其机制不清,在炎症状态下他汀药物对血小板PAR-1表达作用如何也少见报道。本文通过体外研究探讨普伐他汀对血小板PAR-1的作用及机制。
1材料与方法
1.1试剂ADP、CRP、普伐他汀购自 Sigma公司, PE标记的抗PAR-1流式抗体SPAN-12购自Beckman Coulter公司,FITC标记的LOX-1流式抗体购自Hycult Biotech 公司,TXB2试剂盒购自Cayman Chemical公司,F1+2购自Behring Diagnostica公司。
1.2试验分组本试验为体外研究,试验分组如下:对照组,只加入PBS;单纯ADP组,5 μmol/L ADP作用15 min;低浓度普伐他汀+ADP组,1 μmol/L普伐他汀干预10 min,再给予5 μmol/L ADP刺激15 min;高浓度普伐他汀+ADP组,10 μmol/L普伐他汀干预10 min,再给予5 μmol/L ADP刺激15 min;CRP组,50 μg/mL CRP作用10 min,再给予5 μmol/L ADP刺激15 min;普伐他汀+CRP联合组,50 μg/mL CRP+10 μmol/L普伐他汀干预10 min,再给予5 μmol/L ADP刺激15 min。
1.3制备富血小板血浆富血小板血浆从健康志愿者外周血分离而来,采用3.8%枸橼酸钠抗凝,血与抗凝剂体积比为9∶1。在室温下以150 r/min离心20 min,采集上层富血小板血浆。剩余血液再以500 r/min离心10 min获得贫血小板血浆。贫血小板血浆用来调整富血小板血浆中的血小板数目,试验过程血小板的数目调整为3×1011cell/L。试验方案通过了伦理学审查,参加试验的志愿者均获知情同意。
1.4血小板聚集试验血小板聚集试验采用美国Chrono-Log 聚集仪,本试验采用的致聚集为5 μmol/L ADP,血小板聚集率通过测量透光度来确定。
1.5流式细胞检测技术室温下在试验管内加入100 μL血小板悬液(数量为3×1011cell/L),给予5 μmol/L ADP刺激血小板15 min后,通过流式细胞技术检测血小板凝血酶受体PAR-1及氧化低密度脂蛋白受体LOX-1的表达。流式细胞仪为美国贝克曼库尔特公司的Epics-XL型。血小板洗涤后重悬于流式缓冲液中,然后各取5 μL富血小板血浆分别加入PE标记的SPAN12抗体及FITC标记的LOX-1抗体,在hepes缓冲液中培育10 min,最后用1%多聚甲醛固定,通过流式细胞仪检测,采用平均荧光强度(MFI)或阳性百分率表示,每次计算血小板数目为50 000个。
1.6酶联免疫分析法富血小板血浆中TXB2,凝血酶原片段F1+2的水平采用酶联免疫吸附试验方法检测。严格按照产品说明书进行检测。

2结果
2.1ADP对血小板PAR-1表达的影响ADP是激活血小板的非常重要的激动剂,首先检测不同浓度ADP诱导血小板聚集的情况。1 μmol/L ADP仅仅诱导血小板发生单相聚集,而且很快发生自发性解聚,5 μmol/L ADP诱导的血小板聚集为双相,10 μmol/L ADP诱导的血小板双相聚集溶合在一起,表现为持续的聚集曲线。最大的聚集率为61%,在本研究中,选择5 μmol/L ADP作为血小板的激动剂,通过流式细胞技术观察到血小板PAR-1表达,而5 μmol/L ADP刺激5 min能促使血小板PAR-1表达增加35%,见图1。
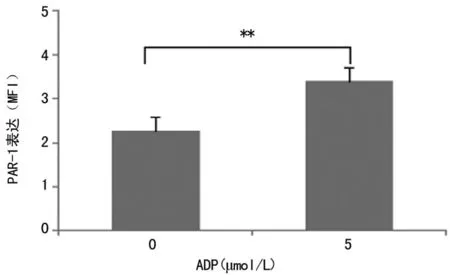
**:P<0.01。
图1ADP对血小板PAR-1表达的影响
2.2CRP对ADP诱导的血小板PAR-1表达的影响富血小板血浆预先给予CRP(25 μg/mL,50 μg/mL),干预10 min,然后加入5 μmol/L ADP,37 °C培育15 min,采用流式细胞术检测血小板PAR-1表达。结果显示CRP呈浓度依赖性的抑制ADP诱导的血小板PAR-1的表达。血小板PAR-1的MFI从3.33±0.11下降到3.06±0.15(25 μg/mL CRP),进一步下降至 2.82±0.10(50 μg/mL CRP)。见图2。

**:P<0.01,*:P<0.05。
图2CRP对ADP刺激的血小板PAR-1表达的影响
2.3普伐他汀对ADP诱导的血小板PAR-1表达的影响在室温下预先给予1 μmol/L、10 μmol/L普伐他汀于富血小板血浆中孵育10 min,然后加入5 μmol/L ADP再共同孵育15 min,流式细胞技术检测血小板PAR-1的表达。结果显示普伐他汀处理呈浓度依赖性抑制血小板PAR-1表达,1 μmol/L、10 μmol/L普伐他汀将PAR-1的MFI由单纯ADP刺激的3.33±0.11分别降至 3.11±0.18和2.72±0.14。
为验证在CRP存在的条件下普伐他汀对血小板PAR-1表达的影响,将50 μg/mL CRP 和10 μmol/L普伐他汀同时加入富血小板血浆共同孵育10 min,然后加入5 μmol/L ADP再共同孵育15 min,结果显示联合CRP和普伐他汀更明显抑制血小板PAR-1的表达(MFI为2.32±0.11),较单独使用CRP和普伐他汀下降得更显著(P<0.05),见图3。
2.4CRP和普伐他汀对血小板TXB2合成及凝血酶原片版F1+2生成的影响血小板TXA2合成酶将PGH2转化成TXA2,由于TXA2极不稳定,作者检测TXA2的稳定性代谢产物TXB2。富血小板血浆在ADP刺激之前预先给予50 μg/mL CRP或10 μmol/L普伐他汀干预10 min,再给予5 μmol/L ADP刺激15 min,TXB2的检测采用酶联免疫试剂盒检测富血小板血浆,单纯ADP刺激使富血小板血浆表达TXB2从(88.26±23.38)pg/mL 增加至 (185.30±41.82)pg/mL,而预先给予50 μg/mL CRP使TXB2降至(112.68±24.48)pg/mL,同样,10 μmol/L普伐他汀同样将TXB2降至(146.48±46.54)pg/mL。
凝血酶原片段F1+2可以反映血小板凝血酶的生成,采用酶联免疫试剂盒体测富血小板血浆F1+2的水平变化。富血小板血浆在ADP刺激之前预先给予50 μg/mL CRP或10 μmol/L普伐他汀干预10 min,再给予5 μmol/L ADP刺激15 min,单纯ADP刺激使F1+2从(0.65±0.20)nmol/L 上升至(1.18±0.80)nmol/L(P<0.05)。而预先给予50 μg/mL CRP使F1+2显著增加(P<0.05),而10 μmol/L普伐他汀对F1+2无明显影响(P>0.05)。见表1。

*:P<0.05,**:P<0.01。
图3普伐他汀和CRP对ADP刺激的血小板PAR-1表达的影响
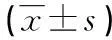
表1 CRP和普伐他汀对血小板TXB2合成及凝血酶原片段F1+2生成的影响
*P<0.01,与单纯ADP组比较。

**:P<0.01。
图4普伐他汀和CRP对ADP诱导的血小板LOX-1表达的影响
2.5CRP和普伐他汀对血小板LOX-1表达的影响LOX-1是ox-LDL的特异性受体,它在动脉粥样硬化和动脉血栓形成中起重要作用。而且血小板活化后LOX-1在其表面大量表达。通过流式细胞检测到ADP刺激后血小板LOX-1表达明显增加,作者研究CRP和普伐他汀是否会影响ADP诱导的血小板LOX-1表达。富血小板血浆在ADP刺激之前预先给予50 μg/mL CRP,1 μmol/L普伐他汀或10 μmol/L普伐他汀干预10 min,再给予5 μmol/L ADP刺激15 min,结果显示:ADP刺激后血小板LOX-1明显增加(MFI:3.16±0.23 vs.1.56±0.11,P<0.01)。CRP对ADP刺激的血小板LOX-1表达无明显影响,而普伐他汀呈浓度依赖性的方式降低ADP诱导的血小板LOX-1表达(MFI分别为:1.80±0.19、1.62±0.16,与单纯ADP刺激比较,P<0.01)。见图4。
3讨论
血小板凝血酶受体PAR-1对于ADP诱导血小板聚集和活化非常重要[6]。通过流式细胞技术检测,ADP刺激能增加血小板表面PAR-1表达35%左右,而且是在ADP刺激5 min后就能产生这种变化,这提示血小板表面的PAR-1增加不是通过翻译和合成来的,因为这通常需要几小时至十几小时。这提示PAR-1在血小板表面的增加只是贮存在细胞内的抗原转到表面而被流式细胞仪检测到,ADP刺激能促进位于血小板内部的PAR-1受体向细胞膜表面表达。
大量临床试验证实,CRP不仅是判断心血管疾病预后的炎症标志物,同时它也是动脉血栓事件的重要调节因子[7]。Danenberg等[8]通过实验发现CRP转基因鼠在血管损伤时股动脉完全闭塞发生率明显增高,这提示CRP参与了动脉血栓形成。CRP在炎症状态下参与宿主反应的调节,CRP能抑制T淋巴细胞活性和血小板的活化[9],但能激活补体系统和加强凝血功能[10-11];在本研究中观察到CRP不仅能减少ADP刺激的血小板聚集,而且能减少ADP刺激的血小板PAR-1的表达,这提示炎症状态可能抑制血小板PAR-1的表达,这与文献报道一致[12]。因此CRP促进血栓形成并不是通过影响血小板PAR-1的表达,而可能是通过影响凝血功能起作用。已有报道证实,CRP直接作用于组织纤溶酶原系统和影响血管细胞组织因子的活性等增强凝血功能[13-14]。CRP下调血小板PAR-1的机制不清楚,本研究发现,CRP能降低TXB2的表达,而TXB2是TXA2较稳定的代谢产物,TXA2在ADP诱导血小板第二次聚集反应至关重要。还有一些研究发现CRP干扰前列腺素生成和代谢,而这些均与花生四烯酸水解有关。研究发现CRP能与磷脂结合起到稳定细胞膜[15],防止组织损伤的作用,这可能是其抑制血栓素的形成的机制,从而在CRP下调ADP刺激血小板PAR-1表达中起一定的作用。另一方面,证实CRP能增加凝血酶原片段F1+2表达,这提示CRP能促使凝血酶形成,而生成的凝血酶将与血小板表面的PAR-1结合并水解其N端从而激活受体,而PAR-1一旦裂解激活,PAR-1会失去再与凝血酶结合的能力,也不能被PAR-1抗体识别而检测。
他汀类药物具有防止血栓形成等血管保护作用,而且不依赖于其调脂作用。通过流式细胞技术,证实普伐他汀体外干预能抑制ADP诱导血小板PAR-1的表达,这与临床研究中报道的各种他汀均能降低血小板PAR-1的活性和表达水平相一致[5]。本研究还发现普伐他汀能下调ADP依赖的血栓素形成,同样在临床研究中使用他汀也有类似的作用。有研究报道辛伐他汀和普伐他汀能直接与血小板作用,抑制GPIIb-IIIa 受体表达,进而能抑制血栓素的形成[16]。由于PAR-1在ADP诱导的血小板聚集和活化中起重要作用,作者推测普伐他汀对血栓素的作用与抑制血小板PAR-1有关。他汀类药物通过阻断ROS形成和减少NAD+/NADH 比例起着抗氧化作用[17]。LOX-1是ox-LDL特异性受体,一般认为在氧化应激状态下LOX-1会上调,LOX-1在动脉硬化形成、进展及血栓形成中均起重要作用。研究表明阻断LOX-1能抑制ADP诱导的血小板聚集[18],这提示氧化应激在ADP诱导的血小板聚集和活化中同样存在。通过流式细胞技术发现ADP能诱导血小板LOX-1表达,与P-选择素类似,LOX-1表达与血小板活化程度一致,普伐他汀能下调ADP诱导的血小板LOX-1表达,这可能是其抑制血小板PAR-1表达的一个重要机制。由于CRP对ADP诱导的血小板LOX-1表达无明显影响,而在CRP和普伐他汀均存在的情况下,ADP诱导的血小板PAR-1表达下降更明显,这提示CRP 和普伐他汀抑制ADP诱导的血小板PAR-1表达有不同的机制。
总之,PAR-1在ADP 诱导的血小板活化中起重要作用,普伐他汀和CRP通过不同机制明显降低ADP诱导的血小板PAR-1的表达,提示在炎症状态下他汀仍能起着重要的抗血栓作用,这为临床使用他汀类药物减少缺血事件提供了理论依据。
参考文献
[1] Coughlin SR.Protease-activated receptors in hemostasis,thrombosis and vascular biology[J].J Thromb Haemost,2005,3(8):1800-1814.
[2]Storey RF,Kotha J,Smyth SS,et al.Effects of vorapaxar on platelet reactivity and biomarker expression in non-ST-elevation acute coronary syndromes.The TRACER Pharmacodynamic Substudy[J].Thromb Haemost,2014,111(5):883-891.
[3]Tousoulis D,Psarros C,Demosthenous M,et al.Innate and adaptive inflammation as a therapeutic target in vascular disease:the emerging role of statins[J].J Am Coll Cardiol,2014,63(23):2491-2502.
[4]Johnson GJ,Leis LA,Slater BC,et al.Elevated platelet count,C-reactive protein and thromboxane analog-induced platelet aggregation in patients with Gulf War veterans′ illnesses:evidence of a chronic inflammatory state?[J].Blood Coagul Fibrinolysis,2013,24(7):736-741.
[5]Serebruany VL,Miller M,Pokov AN,et al.Effect of statins on platelet PAR-1 thrombin receptor in patients with the metabolic syndrome (from the PAR-1 inhibition by statins[PARIS]study)[J].Am J Cardiol,2006,97(9):1332-1336.
[6]Jiang L,Xu C,Yu S,et al.A critical role of thrombin/PAR-1 in ADP-induced platelet secretion and the second wave of aggregation[J].J Thromb Haemost,2013,11(5):930-940.
[7]Bisoendial RJ,Kastelein JJ,Levels JH,et al.Activation of inflammation and coagulation after infusion of C-reactive protein in humans[J].Circ Res,2005,96(7):714-716.
[8]Danenberg HD,Grad E,Swaminathan RV,et al.Neointimal formation is reduced after arterial injury in human crp transgenic mice[J].Atherosclerosis,2008,201(1):85-91.
[9]Hansson GK,Libby P.The immune response in atherosclerosis:a double-edged sword[J].Nat Rev Immunol,2006,6(7):508-519.
[10]Bisoendial RJ,Kastelein JJ,Peters SL,et al.Effects of CRP infusion on endothelial function and coagulation in normocholesterolemic and hypercholesterolemic subjects[J].J Lipid Res,2007,48(4):952-960.
[11]Fujita Y,Yamaguchi S,Kakino A,et al.Lectin-like oxidized LDL receptor 1 is involved in CRP-mediated complement activation[J].Clin Chem,2011,57(10):1398-1405.
[12]Reiter R,Derhaschnig U,Spiel A,et al.Regulation of protease-activated receptor 1 (PAR1) on platelets and responsiveness to thrombin receptor activating peptide (TRAP) during systemic inflammation in humans[J].Thromb Haemost,2003,90(5):898-903.
[13]Wu J,Stevenson MJ,Brown JM,et al.C-reactive protein enhances tissue factor expression by vascular smooth muscle cells:mechanisms and in vivo significance[J].Arterioscler Thromb Vasc Biol,2008,28(4):698-704.
[14]Singh U,Devaraj S,Jialal I.C-reactive protein decreases tissue plasminogen activator activity in human aortic endothelial cells:evidence that C-reactive protein is a procoagulant[J].Arterioscler Thromb Vasc Biol,2005,25(10):2216-2221.
[15]Vigo C.Effect of C-reactive protein on platelet-activating factor-induced platelet aggregation and membrane stabilization[J].J Biol Chem,1985,260(6):3418-3422.
[16]Luzak B,Rywaniak J,Stanczyk L,et al.Pravastatin and simvastatin improves acetylsalicylic acid-mediated in vitro blood platelet inhibition[J].Eur J Clin Invest,2012,42(8):864-872.
[17]Lim S,Barter P.Antioxidant effects of statins in the management of cardiometabolic disorders[J].J Atheroscler Thromb,2014,21(10):997-1010.
[18]Marwali MR,Hu CP,Mohandas B,et al.Modulation of ADP-induced platelet activation by aspirin and pravastatin:role of lectin-like oxidized low-density lipoprotein receptor-1,nitric oxide,oxidative stress,and inside-out integrin signaling[J].J Pharmacol Exp Ther,2007,322(3):1324-1332.
Modulation of PAR-1 expression by pravastatin and C reactive protein in vitro blood platelets*
Chu Luoxiang,Zhou Suxian,Yang Fan,Qin Yueqiu,Liang Zhishan,Mo Changgan,Wang Xiaodi
(Department of Cardiology,the Fourth Affiliated Hospital of Guangxi Medical University, Liuzhou,Guangxi 545005,China)
[Abstract]ObjectiveTo study the modulation of protease-activated receptor-1 (PAR-1) expression by pravastatin and C reactive protein(CRP) in vitro blood platelets.MethodsPlatelet-rich plasma (PRP) was isolated from peripheral blood,PRP were treated with CRP,pravastatin and ADP stimulation in vitro study.Experimental groups:blank control group,simple ADP stimulated group,low concentration of pravastatin+ADP group,high concentration pravastatin group+ADP group,CRP group,pravastatin+CRP united group.PAR-1 and LOX-1 expression on platelets were detected by flow cytometry,the result were shown by mean fluorescence intensity (MFI).TXB2 and F1+2 levels were detected by enzyme-linked immunosorbent assay.ResultsThe 5 μmol/L ADP stimulation significantly increased PAR-1 expression on platelets by 35%.The 50 μg/mL CRP significantly reduced platelet PAR-1 expression induced by ADP(P<0.01).1,10 μmol/L pravastatin significantly reduced platelet PAR-1 expression induced by ADP(P<0.01).Platelet PAR-1 expression induced by ADP was further reduction by combination treatment of CRP,which were significantly reduced compared with treatment of CRP or pravastatin alone(P<0.05).Simple ADP stimulation significantly increased TXB2 level(P<0.01).50 μg/mL CRP and 10 μmol/L pravastatin respectively reduced TXB2 level treated by ADP to (112.68±24.48)pg/mL and (146.48±46.54)pg/mL.Both were reduced significantly compared with ADP stimulation alone(P<0.01).The 50 μg/mL CRP significantly increased level of prothrombin fragment 1+2 induced by ADP(P<0.01),10 μmol/L pravastatin,in contrast,did not influence F1+2 level.Pravastatin reduced platelet LOX-1 expression induced by ADP in a concentration dependent manner,MFI of LOX-1 on platelets treated by 1 μmol/L and 10 μmol/L pravastatin were 1.80±0.19 and 1.62±0.16 respectively,both were reduced significantly compared with that treated by ADP alone(MFI:3.16±0.23),P<0.01.The 50 μg/mL CRP had no significant effect on the expression of LOX-1 stimulated by ADP.ConclusionPAR-1 served as a critical mechanism to relay the platelet activation process induced by ADP.CRP and pravastatin reduced PAR-1 expression in platelet induced by ADP in different way.It is suggested that statins can still play an important role in the antithrombotic effect in the inflammatory state.
[Key words]C-reactive protein;platelet;pravastatin;protease-activated receptor-1
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.11.006
* 基金项目:国家自然科学基金资助项目(81160030)。
作者简介:楚罗湘(1968-),主任医师,博士,主要从事冠心病基础和临床研究。
[中图分类号]R363
[文献标识码]A
[文章编号]1671-8348(2016)11-1459-04
(收稿日期:2015-11-28修回日期:2016-01-07)
