二维及微团培养法对软骨细胞表型的影响*
2016-06-15宋雄波吴江怡刘宝荣
宋雄波,吴江怡,黄 术,陈 诚,杨 柳,刘宝荣△
(1.湖南省人民医院/湖南师范大学第一附属医院关节外科,长沙 410005;2.南华大学第一附属医院骨科,湖南衡阳 421001;3.第三军医大学西南医院关节外科,重庆 400038)
二维及微团培养法对软骨细胞表型的影响*
宋雄波1,吴江怡2,黄术1,陈诚3,杨柳3,刘宝荣1△
(1.湖南省人民医院/湖南师范大学第一附属医院关节外科,长沙 410005;2.南华大学第一附属医院骨科,湖南衡阳 421001;3.第三军医大学西南医院关节外科,重庆 400038)
[摘要]目的探讨二维及微团培养对软骨细胞表型的影响。方法体外高密度二维及微团培养方法培养兔软骨细胞,从细胞形态、细胞外基质表达情况分析软骨细胞表型的差异。 结果高密度二维方案培养兔软骨细胞,2周后软骨细胞多层分布,HE染色显示细胞呈圆形,细胞间联系较密,阿尔新蓝染色显示细胞外蛋白多糖分泌较少;微团培养方法培养兔软骨细胞,2周后形成肉眼可见的白色组织,HE染色显示细胞呈多边形,细胞较分散,阿尔新蓝染色显示细胞外蛋白多糖分泌明显多于二维培养,差异有统计学意义(P<0.05)。结论微团培养方法培养兔软骨细胞,有利于软骨细胞分泌细胞外基质。
[关键词]软骨细胞;二维培养;微团培养;软骨表型
关节软骨由软骨细胞及细胞外基质构成,缺乏血管和神经,一旦受损,很难通过自我进行有效的修复[1]。传统的治疗方法,如微骨折法,修复物为纤维软骨而不是透明软骨,耐磨性差,容易导致关节退行性变,且只适用于急性关节软骨损伤,疗效受患者的年龄、软骨缺损面积的限制[2-5]。目前临床上通常采用自体软骨细胞移植来修复关节软骨缺损,疗效肯定。进行自体软骨细胞移植,需要足够数量的软骨细胞。因此,通常在关节非负重区获取正常软骨细胞,将软骨细胞在体外培养扩增,待软骨细胞数目达到修复要求时,再将软骨细胞移植至关节缺损处。体外培养扩增软骨细胞,一般采用单层培养方法,在培养过程中,往往会发生软骨细胞去分化表现,导致移植失败。因此,本实验提出应用二维及微团培养法培养软骨细胞,比较两种方法培养软骨细胞的有效性,尝试建立合适的软骨细胞培养体系。
1材料与方法
1.1材料、试剂与仪器新西兰大白兔(第三军医大学实验动物中心提供),DMEM高糖培养基、胎牛血清、胰酶(Hyclone),Ⅱ型胶原酶、Pronase酶、地塞米松、抗坏血酸(Sigma),ITS(Gibco),重组人TGF-β1(Peprotech),青霉素-链霉素溶液(Beyotime),HE染色液、阿利新蓝 8GX(Solarbio),CO2培养箱(Thermo Forma)、台式冷冻离心机ST-40R(Thermo scientific)、倒置显微镜 IX71。
1.2方法
1.2.1软骨细胞的提取及培养新西兰大白兔,2~3月龄,体质量2.0~2.5 kg,雌雄不限。无菌条件获取膝关节软骨片(约1.5 mm×1.5 mm),Pronase酶(0.25%)消化1 h,Ⅱ型胶原酶(0.025%)消化8~10 h,40 μm细胞滤网过滤消化液,2 000 r/min离心8 min,10%胎牛血清培养基重悬细胞,种植于25 cm2培养瓶,3 d后首次换液,以后每隔2天换液,待细胞融合90%以上时传代,以第1代软骨细胞为种子细胞。
1.2.2软骨细胞二维培养计数细胞,使24孔板每孔细胞数目为2×105个。加入软骨细胞诱导培养基(DMEM高糖培养基,含有2%胎牛血清、1%青霉素-链霉素溶液、1% ITS、50 μg/mL抗坏血酸、100 nmol/L地塞米松及10 ng/mL TGF-β)重悬细胞,将细胞悬液从孔中间加入,并将24孔板在超净台上做十字形移动,使细胞分布均匀后于37 ℃、5%CO2孵箱中培养。3 d后首次换液,以后每隔2天换液,培养2周。
1.2.3软骨细胞微团培养计数细胞,使细胞数目为1×107个,用1 mL软骨细胞诱导培养基重悬细胞。取15 mL一次性离心管,吸取20 μL上述细胞悬液加入离心管底,再加入1 mL软骨细胞诱导培养基,充分混匀,1 000 r/min离心5 min,拧松管盖后静置于37 ℃、5%CO2孵箱中培养。3 d后首次换液,以后每隔2天换液,培养2周。
1.2.4指标检测
1.2.4.1大体观观察二维培养组及微团培养组软骨细胞形成物大小、形态。
1.2.4.2二维培养组软骨细胞HE及阿尔新蓝染色HE染色:4%多聚甲醛固定30 min,超纯水洗,苏木素染色20 min,自来水洗,分化液分化30 s,自来水浸泡,伊红染色2 min,自来水洗,甘油封片,镜下观察。阿尔新蓝染色:4%多聚甲醛固定30 min,超纯水洗,3%冰醋酸平衡30 min,0.2%阿尔新蓝染液染色30 min,3%冰醋酸洗,甘油封片,镜下观察。
1.2.4.3微团培养组软骨细胞HE及阿尔新蓝染色HE染色:二甲苯脱蜡,梯度乙醇脱水,超纯水洗,苏木素染色,自来水冲洗,盐酸乙醇分化,自来水浸泡,伊红染色,梯度乙醇水化,二甲苯透明,中性树脂封片,镜下观察;阿尔新蓝染色:二甲苯脱蜡,梯度乙醇脱水,超纯水洗,冰醋酸平衡,阿尔新蓝染色,冰醋酸浸泡,梯度乙醇水化,二甲苯透明,中性树脂封片,镜下观察。

2结果
2.1软骨细胞形态原代软骨细胞在4 h后就有少量细胞贴壁生长,3 d后90%以上的软骨细胞贴壁生长,呈长梭状。首次换液后,细胞呈多边形,增殖迅速,1周后可达90%融合。传代细胞12 h基本贴壁铺展,呈比较均一的铺路石样,见图1。
2.2不同培养方式后软骨细胞形态软骨细胞高密度二维培养2周后,软骨细胞多层分布,表现为较均一的圆形;软骨细胞微团培养2周后,可见软骨细胞形成较明显的细胞微团组织,直径约3 mm,厚0.5 mm,色白、质软,有弹性,见图2。
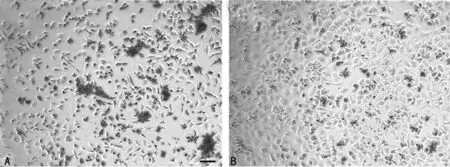
A:原代软骨细胞4 d;B:第1代软骨细胞6 d;标尺:100 μm。
图1软骨细胞形态

A:二维培养2周;B:微团培养2周;标尺:100 μm。
图2不同培养方式后软骨细胞形态
2.3软骨细胞HE染色二维培养组显示软骨细胞密集,呈多层分布,排列紧密,表现较为均一的圆形;微团培养组显示软骨细胞分布较为分散,核大,表现较为均一的椭圆形,接近正常软骨细胞形态,见图3。
2.4软骨细胞阿尔新蓝染色二维培养组显示软骨细胞外基质染色淡,蛋白多糖分泌少;微团培养组显示软骨细胞外基质染色深,蛋白多糖分泌多。统计数据分析显示微团培养组蛋白多糖表达明显多于二维培养组,差异有统计学意义(P<0.05),见图4、5。

A、C:二维培养组;B、D:微团培养组;标尺:100 μm。
图3软骨细胞HE染色
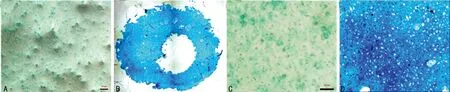
A、C:二维培养组;B、D:微团培养组;标尺:100 μm。
图4软骨细胞阿尔新蓝染色
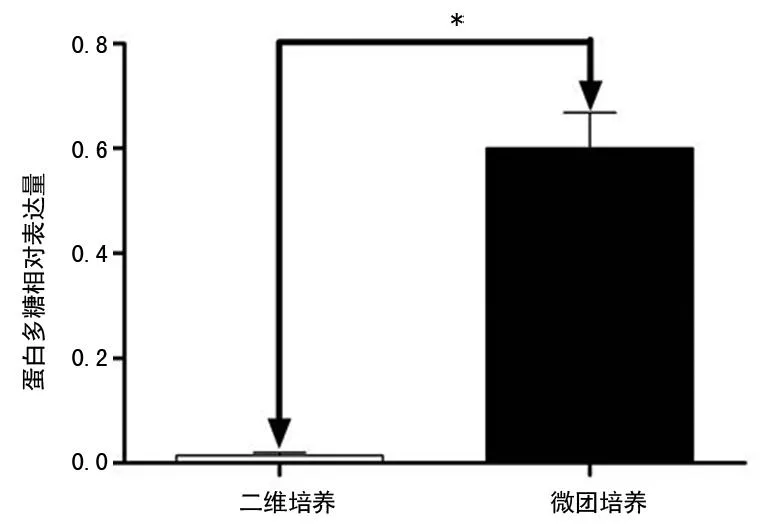
*:P<0.05。
图5蛋白多糖相对表达量比较
3讨论
关节软骨主要由软骨细胞及细胞外基质组成,软骨细胞分布于由Ⅱ型胶原和蛋白聚糖组成的致密细胞外基质中,形成软骨陷窝,迁移性差,且关节软骨不受神经支配,缺乏血管及淋巴引流,营养靠周围滑液弥散和滑液毛细血管渗透而获得,细胞合成能力低下,一旦受损,导致其很难通过自身进行有效的修复[1]。
传统的手术治疗方法,如微骨折法,修复物为纤维软骨而不是透明软骨,耐磨性差,容易导致关节退行性变;且只适用于急性关节软骨损伤,疗效受患者的年龄、软骨缺损面积等的限制[2-5]。目前自体软骨细胞移植已经在临床推广应用。进行自体软骨细胞移植,需要足够数量的软骨细胞,因此,通常在关节非负重区获取正常软骨细胞,将软骨细胞在体外培养扩增,待软骨细胞数目达到修复要求时,再将软骨细胞移植至关节缺损处。研究发现,采用单层二维方法培养软骨细胞,在第2代软骨细胞时,Ⅱ型胶原及蛋白多糖的表达有了明显的下降,软骨细胞表现出去分化现象[6-7]。
为了克服软骨细胞培养过程中去分化表现,研究者采取了多种方法维持软骨细胞表型,如应用不同的培养基及生长因子、蛋白包被、共培养及三维支架培养[8]。研究发现,增加TGF-β1及葡萄糖的浓度,同时降低地塞米松的浓度,可以促进软骨细胞表达Ⅱ型胶原及维持软骨细胞特性;同时还发现TGF-β1联合无血清培养基较含血清培养基更能促进软骨细胞表达Ⅱ型胶原[9-10]。有研究发现,应用Ⅰ、Ⅲ型胶原包被培养瓶,可以促使软骨细胞表达更多的Ⅱ型胶原及蛋白多糖,但是对比应用Ⅰ、Ⅱ型胶原包被,却未发现Ⅱ型胶原及蛋白多糖的表达有明显差异[11-12]。Meretoja等[13]研究发现,将软骨细胞和间充质干细胞共同培养,比单独的软骨细胞、间充质干细胞培养更能适应组织工程的发展需求。研究还发现,将软骨细胞和间充质干细胞、胚胎干细胞及诱导多功能干细胞分别进行共培养,能促进Ⅱ型胶原及SOX9的表达,同时有利于软骨基质的形成[1,14-15]。本研究发现,应用微团方法培养软骨细胞,软骨细胞可形成白色透明的类软骨组织,质软,弹性可。HE染色显示软骨细胞表现为均一的椭圆形,接近正常软骨细胞形态,且形成类似软骨陷窝样表现。阿尔新蓝染色显示软骨细胞外多糖物质染色深,分泌多,含量明显高于二维培养。作者分析,采用微团方法培养软骨细胞,模拟了体内干细胞向软骨细胞分化及软骨形成过程,更加符合软骨细胞生长特性,从而有利于维持软骨细胞特性。因此,微团培养法是比较合适的软骨细胞培养体系。采用微团方法培养软骨细胞,需注意以下事项:(1)最好使用原代软骨细胞,且要保证软骨细胞数目;(2)软骨细胞离心后不能晃荡离心管,否则会使细胞分散,达不到培养目的;(3)细胞换液时需倾斜离心管,小心吸除培养基,并沿管壁轻轻注入新鲜培养基,避免软骨细胞微团组织漂浮。
参考文献
[1]Chung C,Burdick JA.Engineering cartilage tissue[J].Adv Drug Deliv Rev,2008,60(2):243-262.
[2]Knutsen G,Engebretsen L,Ludvigsen TC,et al.Autologous chondrocyte implantation compared with microfracture in the knee.A randomized trial[J].J Bone Joint Surg Am Vol,2004,86(3):455-464.
[3]Nehrer S,Spector M,Minas T.Histologic analysis of tissue after failed cartilage repair procedures[J].Clin Orth Rel Res,1999,20(365):149-162.
[4]Mithoefer K,McAdams T,Williams RJ,et al.Clinical efficacy of the microfracture technique for articular cartilage repair in the knee:an evidence-based systematic analysis[J].Am J Sport Med,2009,37(10):2053-2063.
[5]Miller BS,Steadman JR,Briggs KK,et al.Patient satisfaction and outcome after microfracture of the degenerative knee[J].J Knee Surg,2004,17(1):13-17.
[6]Benya PD,Padilla SR,Nimni ME.Independent regulation of collagen types by chondrocytes during the loss of differentiated function in culture[J].Cell,1978,15(4):1313-1321.
[7]Hamada T,Sakai T,Hiraiwa H,et al.Surface markers and gene expression to characterize the differentiation of monolayer expanded human articular chondrocytes[J].Nagoya J Med Sci,2013,75(1/2):101-111.
[8]Chen JL,Duan L,Zhu W,et al.Extracellular matrix production in vitro in cartilage tissue engineering[J].J Transl Med,2014,12:88.
[9]Enochson L,Brittberg M,Lindahl A.Optimization of a chondrogenic medium through the use of factorial design of experiments[J].Bio Res Open Acce,2012,1(6):306-313.
[10]Giannoni P,Pagano A,Maggi E,et al.Autologous chondrocyte implantation (ACI) for aged patients:development of the proper cell expansion conditions for possible therapeutic applications[J].Oste Res Soc,2005,13(7):589-600.
[11]Barbero A,Grogan SP,Mainil-Varlet P,et al.Expansion on specific substrates regulates the phenotype and differentiation capacity of human articular chondrocytes[J].J Cell Bioc,2006,98(5):1140-1149.
[12]Rutgers M,Saris DB,Vonk LA,et al.Effect of collagen type I or type II on chondrogenesis by cultured human articular chondrocytes[J].Tissue Eng Part,2013,19(1/2):59-65.
[13]Meretoja VV,Dahlin RL,Wright S,et al.The effect of hypoxia on the chondrogenic differentiation of co-cultured articular chondrocytes and mesenchymal stem cells in scaffolds[J].Biomaterials,2013,34(17):4266-4273.
[14]VatsA,BielbyRC,TolleyN,etal.Chondrogenicdifferentiationofhumanembryonicstemcells:
the effect of the micro-environment[J].Tissue Enginee,2006,12(6):1687-1697.
[15]Qu C,Puttonen KA,Lindeberg H,et al.Chondrogenic differentiation of human pluripotent stem cells in chondrocyte co-culture[J].Int J Bioc Cell Biol,2013,45(8):1802-1812.
Effects of 2D culture and micropellet culture on the chondrocyte phenotype*
Song Xiongbo1,Wu Jiangyi2,Huang Shu1,Chen Cheng3,Yang Liu3,Liu Baorong1△
(1.Department of Joint Surgery,Hunan Provincial People′s Hospital/First Affiliated Hospital ofHunan Normal University,Changsha,Hunan 410005,China;2.Department of Orthopedics, First Affiliated Hospital of South China University,Hengyang,Hunan 421001,China;3.Department of Joint Surgery,Southwest Hospital,Third Military Medical University,Chongqing 400038,China)
[Abstract]ObjectiveTo analyze the effects of 2D culture and micropellet culture on the chondrocyte phenotype.MethodsHigh density 2D culture and micropellet culture were used to culture rabbit chondrocytes,the cell morphology and level of matrix expression were measured.ResultsAfter 2 weeks of 2D high density culture,multilayer chondrocyte distribution was observed.HE staining showed that the cells were round in shape,and were closely connected with each other,alcian blue staining showed that the secretion of proteoglycan was low;after 2 weeks of micropellet culture,cartilage-like white tissue was formed.HE staining showed that the cells were polygonal in shape,and were sparsely distributed,alcian blue staining showed that the secretion of proteoglycan was significantly higher than that in 2D culture(P<0.05).ConclusionUsing micropellet to culture rabbit chondrocytes is favorable for the secretion of extracellular matrix.
[Key words]chondrocytes;2D culture;micropellet culture;cartilage phenotype
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.11.005
* 基金项目:国家自然科学基金资助项目(31300773);中国博士后科学基金资助项目(2013M532152)。
作者简介:宋雄波(1986-),医师,硕士,主要从事软骨细胞表型调控、软骨细胞-干细胞相互作用的研究。△通讯作者, E-mail:lbr9391@163.com。
[中图分类号]R68
[文献标识码]A
[文章编号]1671-8348(2016)11-1456-03
(收稿日期:2015-12-08修回日期:2016-02-01)
