冬虫夏草菌丝体提取物抑制顺铂诱导的肾小管上皮细胞损伤
2016-06-15岳会敏宋玉仙侯亚义
公 伟 刘 丹 岳会敏 宋玉仙 侯亚义
(南京医科大学附属南京儿童医院 儿科重点实验室,南京210008)
冬虫夏草菌丝体提取物抑制顺铂诱导的肾小管上皮细胞损伤
公伟刘丹①岳会敏①宋玉仙①侯亚义①
(南京医科大学附属南京儿童医院 儿科重点实验室,南京210008)
[摘要]目的:探讨冬虫夏草菌丝体(Hirsutella sinensis mycelium,HSM)提取物对顺铂(CDDP)诱导的小鼠肾小管上皮细胞(RTEC)损伤的影响及可能的调控机制。方法:体外实验分5组:正常对照组、顺铂诱导的损伤模型组及低、中、高剂量的HSM干预组。RTEC经HSM预处理2 h后加CDDP刺激,24 h后收取细胞,分别采用Annexin V/PI双染法检测细胞凋亡、Real-time PCR检测凋亡相关基因、炎性因子及模式识别受体的相对表达量。体内实验分3组:对照组、CDDP诱导的小鼠急性肾损伤模型组及HSM治疗组,分别取肾组织进行HE染色及提取RNA和相关基因mRNA水平的检测。结果:HSM预处理可缓解CDDP诱导的凋亡,促进抗凋亡基因Bcl-2的表达,并抑制BAX与Caspase-9;同时降低TNF-α和TLR4的表达。体内实验则显示HSM可有效缓解CDDP诱导的小鼠肾小管损伤。结论:HSM可以降低RTEC凋亡、减轻炎症以改善CDDP诱导的RTEC损伤。
[关键词]冬虫夏草菌丝体;顺铂;肾小管上皮细胞;细胞凋亡
顺铂(CDDP)是临床化疗的常用药,用于多种实体肿瘤的治疗且效果显著,然而,CDDP的疗效受肾毒性限制[1,2]。CDDP经静脉注射后会在肾小管富集,诱发近端小管上皮细胞(RTEC)凋亡与炎症反应,并进一步导致肾小管损伤[3,4]。因此,有效缓解CDDP肾毒性是提高化疗质量的重要措施。冬虫夏草菌丝体(Hirsutella sinensis mycelium,HSM)提取物是从天然虫草中获取的人工发酵制品,以多糖为主要活性物质[5]。研究指出HSM能显著提高免疫力、抗疲劳与降血脂等功效,尤其对多种原因引发的肾损伤具有良好的防护作用,但具体作用机制尚未阐明[6,7]。本研究通过探讨HSM对顺铂诱导的RTEC损伤的影响及其可能的作用机制,为临床缓解CDDP肾毒性提供新思路。
1材料与方法
1.1材料鼠源RTEC购于齐式生物科技有限公司,CDDP购自江苏恒瑞医药公司,HSM购自南京中科集团股份有限公司(每200 mg冬虫夏草菌丝体中含虫草多糖50 mg),DMEM/F12培养基、胎牛血清、胰蛋白酶(Gibco公司),Annexin V/PI 双染凋亡试剂盒(BD公司),SYBR Green PCR Master Mix (Bio-Rad公司),CCK-8试剂盒(日本同仁公司)。
1.2方法
1.2.1实验分组将传代培养的RTEC分为以下5组:(1)空白对照组:正常RTEC;(2)模型组:以10 ng/ml CDDP处理RTEC;(3)低剂量干预组:25 μg/ml HSM+10 ng/ml CDDP处理RTEC;(4)中剂量干预组:50 μg/ml HSM +10 ng/ml CDDP处理RTEC;(5)高剂量干预组:100 μg/ml HSM +10 ng/ml CDDP处理RTEC。
1.2.2细胞培养将RTEC细胞置于含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM/F12培养液中,培养于37℃、5%CO2培养箱中,培养至80%以上后,用0.25%胰酶(含EDTA)进行消化并传代培养。
1.2.3CCK-8检测细胞活力将处于对数生长期的RTEC按照5×104个/ml的密度接种于96孔板,每孔100 μl完全培养液。待细胞贴壁后,分别用PBS或者不同浓度的HSM(12.5、25、50、100、200 μg/ml)处理细胞。24 h后,移除培养液,重新添加含10% CCK-8的培养基至每孔中继续在培养箱孵育3 h后在酶标仪上450 nm处检测吸光值(OD值)并计算细胞活力。细胞活力=(处理组平均OD值-空白孔OD值)/(对照组平均OD值-空白孔OD值)×100%。
1.2.4流式细胞术检测细胞凋亡按照Annexin V/PI 双染凋亡试剂盒的说明书操作。将RTEC细胞按照2×105个/ml接种于12孔板,按照实验分组,分别给予25、50、100 μg/ml的HSM处理2 h后,再添加10 ng/ml CDDP处理24 h。收取细胞,PBS清洗2次后用binding buffer重悬,分别添加FITC-Annexin V与PI各5 μl,避光孵育5 min后上机检测。
1.2.5Real-time PCR检测相关基因mRNA水平的表达引物经Primer 5设计并由上海英骏公司合成,引物序列见表1。按照Trizol试剂盒(Invitrogen)说明书提取细胞总RNA,取1.5 μg总RNA,按反转录试剂盒的使用说明将其反转成cDNA。使用Sybr Green PCR Master Mix和Applied Biosystems (Foster,CA,USA)进行实时定量PCR反应。以GAPDH作为内参,采用2-ΔΔCt法计算基因的相对表达量。
1.2.6顺铂诱导的小鼠急性肾损伤模型的构建及HSM的体内干预SPF级雄性C57BL/6小鼠购于南京大学模式动物所。实验分三组:正常对照组,腹腔注射0.9%的生理盐水0.2 ml;模型组,腹腔注射10 mg/kg的顺铂-生理盐水溶液(浓度为1 g/L);HSM治疗组,给以腹腔注射10 mg/kg顺铂-生理盐水,同时每天灌胃给药200 mg/kg。注射药物72 h后处死小鼠,留取肾脏组织,4%多聚甲醛固定,同时部分组织液氮冻存备用。
2结果
2.1HSM对RTEC的细胞活力的影响HSM浓度分别为12.5、25、50、100 μg/ml时,RTEC的细胞活力与对照组相比没有显著性差异,当HSM浓度为200 μg/ml时,细胞活力(%)降为0.85 ± 0.14,差异具有显著性(P<0.05),可见HSM在≤ 100 μg/ml的浓度范围内不影响细胞的正常活力,此后实验所用浓度均在此范围内。见图1。
2.2HSM缓解CDDP诱导的RTEC细胞凋亡结果显示,模型组细胞凋亡率(%)为54.27 ± 0.38,而高剂量HSM处理组凋亡率(%)降为44.33 ± 2.4,可见HSM预处理可减少RTEC细胞的晚期凋亡。同时,与模型组相比,低、中、高剂量HSM预处理组Bcl-2的mRNA表达上调,同时BAX、Caspase-9表达降低,高剂量效果更为明显。见图2。
2.3HSM抑制CDDP诱导的RTEC炎症反应本研究同时关注HSM对RTEC炎症反应的效果。结果显示,CDDP可促进RTEC产生TNF-α和TLR4,HSM预处理能剂量依赖地抑制TNF-α与TLR4的表达,高剂量组具有显著性差异。见图3。
表1引物序列表
Tab.1Table of PCR primer sequences

GenesSequences5'-3'LengthBcl-2F:ATGCCTTTGTGGAACTATATGGC120bpR:GGTATGCACCCAGAGTGATGCBAXF:CCGGCGAATTGGAGATGAACT229bpR:CCAGCCCATGATGGTTCTGATCaspase-9F:TCAGGGGACATGCAGATATGG196bpR:TTGGCAGTCAGGTCGTTCTTCTNF-αF:CCCTCACACTCAGATCATCTTCT61bpR:GCTACGACGTGGGCTACAGTLR4F:CCTGATGACATTCCTTCT255bpR:AGCCACCAGATTCTCTAAGAPDHF:AACGACCCCTTCATTGAC191bpR:TCCACGACATACTCAGCAC

图1 CCK-8检测HSM对RTEC细胞活力的影响Fig.1 Effects of HSM on RTEC cell viabilityNote: *.P<0.05 vs control.

图2 HSM对CDDP诱导的RTEC细胞凋亡及相关凋亡基因表达的影响Fig.2 Effects of HSM on apoptosis and gene-associated with apoptosis in CDDP-treated RTECNote: A.Apoptosis measured by Flow Cytometry;B-D.mRNA expressions of Bcl-2 (B),BAX (C) and Caspase-9 (D).**.P<0.01,***.<0.001 vs control;#.P<0.05,##.P<0.01,###.P<0.001 vs CDDP-treated group.

图3 HSM对CDDP作用下RTEC表达TNF-α和TLR4的影响Fig.3 Effects of HSM on expressions of TNF-α and TLR4 induced by CDDPNote: ***.P<0.001 vs control;##.P<0.01 vs CDDP-treated group.
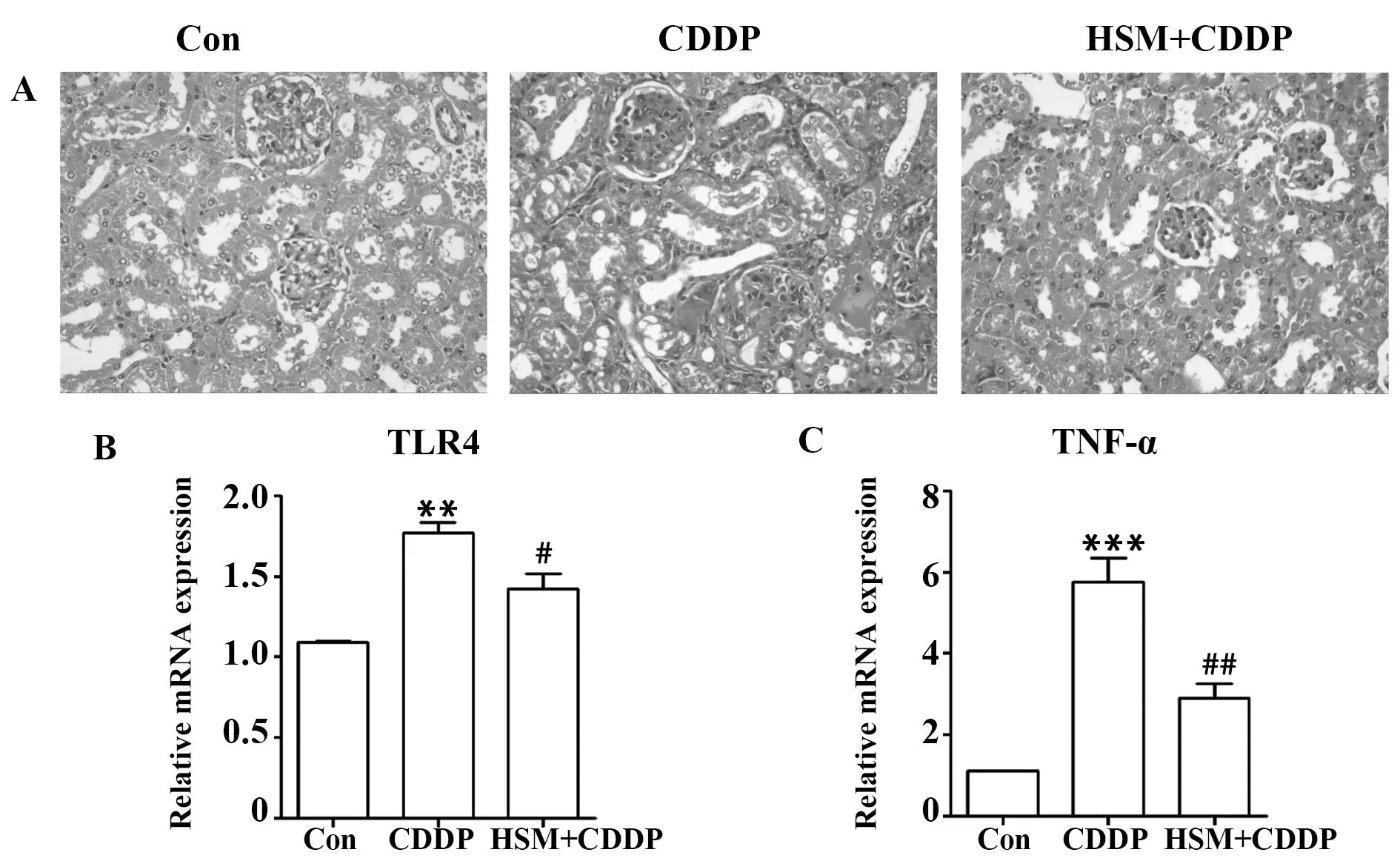
图4 HSM对CDDP诱导的小鼠急性肾损伤的影响Fig.4 Effects of HSM on CDDP-induced acute kidney injuryNote: A.Kidney sections were subjected to H&E staining (×400);B-C.mRNA expressions of TLR4 (B) and TNF-α in kidney tissue.**.P<0.01,***.<0.001 vs control;#.P<0.05,##.P<0.01 vs CDDP-treated group.
2.4HSM缓解顺铂诱导的小鼠急性肾损伤通过腹腔注射顺铂制备小鼠的急性肾损伤模型,可见肾小管病变,表现为小管细胞肿胀,上皮细胞刷状边缘缺失及管腔扩张,同时可见蛋白管型。而HSM治疗组肾脏小管病变明显改善。另外,TLR4及炎性因子TNF-α在治疗组小鼠肾脏中的表达较模型组显著降低,提示HSM能够缓解顺铂诱导的急性肾损伤。见图4。
3讨论
CDDP是临床上应用最为广泛的抗肿瘤化疗药物之一,常用于多种实体肿瘤的治疗且疗效显著,其疗效与用药剂量成正比,然而增加药物剂量会导致肾毒性,包括近端小管损伤、氧化应激、炎症和肾脏血管损伤等。肾毒性并发症的临床发病率高达30%,成为化疗用药的极大障碍,缓解CDDP引发的肾损伤,对提高化疗效果有着重要意义[8-11]。病理研究表明,因肾小管上皮细胞RTEC具有的转运功能,CDDP经静脉注射后会在肾小管富集,诱发RTEC损伤,主要表现为细胞凋亡进而坏死、线粒体功能障碍、炎症反应等[4,12,13]。冬虫夏草是我国的传统中药,已有动物实验表明人工发酵的冬虫夏草菌丝体HSM在肾脏疾病的治疗方面有疗效,但分子机制尚未明确[14]。本研究针对HSM在CDDP诱导的小管细胞损伤方面的影响进行了探讨。
CDDP诱导细胞凋亡伴随着一系列凋亡相关基因的表达变化。Bcl-2与BAX分别是Bcl-2家族中抗凋亡与促凋亡蛋白中的核心因子,Bcl-2/BAX比例下降可促进多种细胞凋亡,其调控途径为通过Bcl-2家族蛋白活化,释放细胞色素C、凋亡诱导因子等,最终激活Caspase家族,启动凋亡级联反应[15,16]。在本研究中,HSM预处理组可明显缓解CDDP诱导的晚期凋亡,在对基因水平的分析中发现,HSM可有效调节Bcl-2/BAX之间的平衡,进而抑制下游Caspase-9的表达,减少细胞死亡。
炎症是RTEC损伤的重要方面,研究证实,CDDP诱导的急性肾损伤小鼠中TNF-α明显增多,并且来源于RTEC而非炎症细胞[17]。同时,作为免疫样细胞,RTEC表达模式识别受体TLR4,CDDP可通过TLR4加剧小管细胞损伤[18]。而HSM可以剂量依赖的方式抑制CDDP诱导的RTEC表达TNF-α和TLR4,高剂量组具有显著差异,提示HSM具有抑炎的效果。已有文献证实冬虫夏草菌丝体在改善慢性肾脏病大鼠的微炎症反应方面具有优势,这与我们的研究结果一致[19]。
为了进一步确认HSM对小管损伤的影响,本研究制备了顺铂诱导的小鼠急性肾损伤模型,在体内观察HSM对小管损伤的疗效。实验表明,HSM可以有效缓解顺铂诱导的小鼠肾脏小管细胞肿胀及管腔扩张,减少上皮细胞刷状边缘缺失,减少蛋白管型,提示HSM对顺铂诱导的肾损伤具有潜在的治疗效果。
本研究通过CDDP诱导的RTEC损伤模型,探讨了人工发酵的冬虫夏草菌丝体HSM对肾小管细胞损伤的影响,发现HSM可有效缓解CDDP诱导的RTEC损伤,提示其对CDDP肾毒性以及肾脏病的防治具有重要的研究价值。然而,本研究中HSM在不同剂量所表现出的效果差异及涉及的信号通路尚未揭示,还需进一步深入研究以阐明HSM的作用机制。
参考文献:
[1]Miller R P,Tadagavadi R K,Ramesh G,etal.Mechanisms of Cisplatin nephrotoxicity[J].Toxins (Basel),2010,2(11) :2490-2518.
[2]Pabla N,Dong Z.Cisplatin nephrotoxicity:mechanisms and renoprotective strategies[J].Kidney Int,2008,73(9):994-1007.
[3]Motohashi H,Nakao Y,Masuda S,etal.Precise comparison of protein localization among OCT,OAT,and MATE in human kidney[J].J Pharm Sci,2013,102(9):3302-3308.
[4]Pabla N,Murphy R F,Liu K,etal.The copper transporter Ctr1 contributes to cisplatin uptake by renal tubular cells during cisplatin nephrotoxicity[J].Am J Physiol Renal Physiol,2009,296(3) :F505-11.
[5]Zhou X,Gong Z,Su Y,etal.Cordyceps fungi:natural products,pharmacological functions and developmental products[J].J Pharm Pharmacol,2009,61(3):279-91.
[6]胡政,李华屏,叶茂青.冬虫夏草菌药理功能研究进展[J].氨基酸和生物资源,2003,25(4):20-22.
[7]赵欢,王莹,缪小亮.虫草多糖的分离提纯及对体外肾细胞损伤和急性肾衰动物模型的保护与治疗作用[J].Progress in Pharmaceutical Sciences,2013,37(7):340-347.
[8]刘华顶,王世亮,叶红杨,等.顺铂植入剂经皮肝植入治疗肝癌的药动学研究[J].中国药学杂志,2010,45(22):1753-1757.
[9]Saad AA,Youssef MI,El-Shennawy LK.Cisplatin induced damage in kidney genomic DNA and nephrotoxicity in male rats:the protective effect of grape seed proanthocyanidin extract[J].Food Chem Toxicol,2009,47(7):1499-1506.
[10]Wang D,Lippard SJ.Cellular processing of platinum anticancer drugs[J].Nat Rev Drug Discov,2005,4(4):307-320.
[11]Razzaque MS.Cisplatin nephropathy:is cytotoxicity avoidable?[J].Nephrol Dial Transplant,2007,22(8):2112-2116.
[12]Clark JS,Faisal A,Baliga R,etal.Cisplatin induces apoptosis through the ERK-p66shc pathway in renal proximal tubule cells[J].Cancer Lett,2010,297(2):165-170.
[13]Linkermann A,Himmerkus N,Rolver L,etal.Renal tubular Fas ligand mediates fratricide in cisplatin-induced acute kidney failure[J].Kidney Int,2011,79(2):169-178.
[14]Lin CY,Ku FM,Kuo YC,etal.Inhibition of activated human mesangial cell proliferation by the natural product of Cordyceps sinensis (H1-A):an implication for treatment of IgA mesangial nephropathy[J].J Lab Clin Med,1999,133(1):55-63.
[15]Cilenti L,Kyriazis GA,Soundarapandian M M,etal.Omi/HtrA2 protease mediates cisplatin-induced cell death in renal cells[J].Am J Physiol Renal Physiol,2005,288(2):F371-379.
[16]Sun X,Wu Y,Chen B,etal.Regulator of calcineurin 1 (RCAN1) facilitates neuronal apoptosis through caspase-3 activation[J].J Biol Chem,2011,286(11):9049-9062.
[17]Kono H,Rock KL.How dying cells alert the immune system to danger[J].Nat Rev Immunol,2008,8(4):279-289.
[18]Ramesh G,Zhang B,Uematsu S,etal.Endotoxin and cisplatin synergistically induce renal dysfunction and cytokine production in mice[J].Am J Physiol Renal Physiol,2007,293(1) :F325-332.
[19]吴涛,高蕾,李学刚,等.虫草菌丝对慢性肾功能衰竭大鼠微炎症反应的影响[J].中国药理学与毒理学杂志,2010,24(4):274-279.
[收稿2015-08-05修回2015-10-16]
(编辑倪鹏)
Effect of Hirsutella Sinensis Mycelium on Cis-dia minodichloroplatin-induced injury of renal tubular epithelial cell
GONGWei,LIUDan,YUEHui-Min,SONGYu-Xian,HOUYa-Yi.
NanjingKeyLaboratoryofPediatrics,NanjingChildrenHospital,AffiliatedtoNanjingMedicalUniversity,Nanjing210008,China
[Abstract]Objective:To investigate the effects of Hirsutella Sinensis Mycelium (HSM) on Cis-dia minodichloroplatin (CDDP)-induced renal tubular epithelial cell (RTEC) injury and its possible mechanism.Methods: RTEC was divided into five groups:control group,CDDP-treated group and low,middle,high doses of HSM pre-treated groups.After pre-treated with HSM 2 h,RTEC was then treated with CDDP for 24 h.Cell apoptosis was detected by Annexin V/PI double staining flow cytometry,and the mRNA expressions of apoptosis-related genes,inflammatory cytokine TNF-α and pattern recognition receptor TLR4 were detected by Real-time PCR.Besides,for in vivo experiments,mice model of acute kidney injury (AKI) was induced by i.p.injection with CDDP,and the HSM was given by gavage once a day with a dose of 200 mg/kg.Results: HSM pre-treatment increased the mRNA expression of Bcl-2 while inhibited the BAX and Caspase-9.Besides,HSM reduced the inflammatory factor TNF-α and pattern recognition receptor TLR4.Furthermore,HSM-treated mice subjected to AKI showed reduced symptoms of tubule injury.Conclusion: HSM can alleviate the RTEC injury induced by CDDP.
[Key words]Hirsutella sinensis mycelium;Cis-dia minodichloroplatin;Renal tubular epithelial cell;Apoptosis
doi:10.3969/j.issn.1000-484X.2016.05.015
作者简介:公伟(1986年-),女,博士,主要从事药物免疫与信号转导方面的研究,E-mail:viwi1986@sina.com。通讯作者及指导教师:侯亚义(1960年-),男,博士,教授,博士生导师,主要从事细胞与分子免疫方面的研究,E-mail:yayihou@nju.edu.cn。
中图分类号R285.5
文献标志码A
文章编号1000-484X(2016)05-0669-04
①南京大学医学院和生物医药技术国家重点实验室,南京210093。