2-氯-1,1-二氟乙烯的制备与应用
2016-06-12戴佳亮徐卫国金杭丹浙江省化工研究院有限公司浙江杭州310023
戴佳亮,徐卫国,金杭丹(浙江省化工研究院有限公司,浙江 杭州 310023)
氟化工
2-氯-1,1-二氟乙烯的制备与应用
戴佳亮,徐卫国,金杭丹
(浙江省化工研究院有限公司,浙江杭州310023)
摘要:2-氯-1,1-二氟乙烯可用来制备含氟烯烃、烷烃和各类含氟化学品,应用广泛。本文详细介绍了2-氯-1,1-二氟乙烯的制备,并对其涉及的反应及应用进行了详细综述。
关键词:2-氯-1,1-二氟乙烯;制备;应用
0 前言
2-氯-1,1-二氟乙烯(R1122),英文名1,1-difluoro-2-chloroethene,CAS号359-10-4,分子式C2HClF2(CF2=CHCl),结构式见Fig.1,分子量98.48,熔点-138.5℃,沸点-17.7℃,比重1.274,闪点-75℃。本文总结了2-氯-1,1-二氟乙烯的各类制备方法及其参与的各类反应及应用,并对其进行了详细综述。以下简称二氟氯乙烯。

Fig.1
1 二氟氯乙烯的制备
1.1以1,2,2-三氯-1,1-二氟乙烷(HCFC-122)为原料
1961年,陶氏化学的Ilgenfritz等人[1]以1,1-二氟-1,2,2-三氯乙烷(HCFC-122)制备二氟氯乙烯。在反应器中加入HCFC-122、锌粒、氯化铝、水和全氟辛酸,搅拌回流3 h,回流温度在50℃~68℃,直到无油状相存在。将产物分段精馏,得到二氟氯乙烯的纯度为95%,原料HCFC-122转化率73%。
1988年,意大利氟产品的主要生产商Ausimont SPA公司的Gervasutti[2]通过氢解特定的氟氯乙烷制备含氢氟乙烯和氟氯乙烯。制备二氟氯乙烯是以HCFC-112为原料,以0.5%的炭载钯为催化剂,反应温度220℃~400℃,常压下导入氢气和R112混合气,比例可在1.7~5.0之间,接触反应时间20 s左右。反应产物中含二氟氯乙烯、偏二氟乙烯、二氟二氯乙烯等,二氟氯乙烯的含量最高可达30%。
1990年,英国帝国化学工业的Forsyth等人[3]以电化学方法还原卤代烃制备得到氟碳化合物。以HCFC-122为原料可以得到二氟氯乙烯:CrCl3溶解在水中作为电解液,以全氟磺酸膜为离子交换膜,阳极为6 cm2铂片,阴极是11 cm2的汞池。阴极电解液电解前以氮气彻底脱气,加入HCFC-122,持续通入1.13 A的电流150 min。深绿色的阴极电解液变为深天蓝色CrCl2,二氟氯乙烯的收率为98%。
1993年,苏威公司的Vanlautem等人[4]以HCFC-122为原料,经催化加氢脱氯制备二氟氯乙烯。催化剂的制备方法采用活性炭作为载体,负载金属铜和第VⅢB族贵金属元素,比如Cu-Pt二元金属制得加氢脱氯催化剂,在氢气压力1.0 MPa,反应温度为240℃下将HCFC-122、氢气和氦气通入反应管内接触反应2.4 s,通入时间10 h,原料转化接近100%,二氟氯乙烯选择性92%。
2013年,中化蓝天集团的付庆等人[5]公开了以HCFC-122为原料制备二氟氯乙烯的方法,路线见Scheme_1。在氮气保护下,反应器中加入环丁砜、活化过的锌粉和连二亚硫酸钠,于160℃反应,滴入HCFC-122(GC纯度大于95%),反应3 h,粗产品收集在钢瓶中,加压精馏,其中加压精馏的条件为:加压釜的温度为60℃~65℃,压力为1.1~1.3 MPa,精馏后得二氟氯乙烯12 g,GC纯度>98%,产率75%。
2013年,兰州交通大学的Wang等人[6]以HCFC-122为原料,经催化还原脱氯制备二氟氯乙烯,路线同Scheme_1。乙醇和HCFC-122混合,在80℃下加入325目的锌粉,加料完毕后,回流2 h,在-60℃~ -80℃冷井中收集到二氟氯乙烯粗品,气相色谱检查纯度95%,收率92.3%。

scheme_1
1.2以1-氯-2,2,2-三氟乙烷(R133a)为原料
1991年,杜邦公司的Fernandez等人[7]以1-氯-2,2,2-三氟乙烷(R133a)为原料进行卤素交换氟化反应,主要转化为1,1,1,2 -四氟乙烷(CF3CH2F,HFC-134a)、二氟氯乙烯、偏二氟乙烯等产物。取氟化钾粉末置于反应管中,于305℃下通入气态R133a,对反应产物流定期取样,经测定,产物基本上由1,1,1,2-四氟乙烷(HFC-134a)、二氟氯乙烯、偏二氟乙烯组成。以CCl2FCH2Cl为原料[8],经类似的方法,得到的气相产物中含二氟氯乙烯,1-氟-1,2-二氯乙烯(HCFC-1121),HFC-134a等产物。
1995年,法国国家科学研究中心的Brunet等人[9]将R133a在铬氧化物存在下,氟化得到主要产物1,1,1,2-四氟乙烷(HFC-134a)、二氟氯乙烯。反应在常压、380℃固定床反应器中进行,催化剂为三价氧化铬催化剂,R133a混合氮气流导入反应器中。反应后,产物二氟氯乙烯和HFC-134a的量基本相同,最高时分别可占10%左右。当三价氧化铬催化剂氟化处理后,二氟氯乙烯的生成量小于HFC-134a;当存在HF时,产物则为HFC-134a。
2001年,美国卤碳公司的Sprague等人[10]公布了一种制备脂肪族碳氟化合物的方法,二氟氯乙烯是通过热解R133a制得,反应在氧化铝管式反应器中进行,R133a进料速率0.177 mol/h,用20%的氮气稀释,反应温度700℃,保留时间3.6 s,二氟氯乙烯收率85.8%。
1.3以1,1-二氟-1,2-二氯乙烷(R132b)制备二氟氯乙烯
1953年,美国Allied chem & dye corp的Miller[11]以1,1-二氟-1,2-二氯乙烷(HCFC-132b)制备二氟氯乙烯。HCFC-132b和四氯化碳混合物通过管式反应器,反应温度600℃,通入时间为90 min,冷井收集产物。经分析,其中含52%的二氟氯乙烯、29%的HCFC-132b和13%的四氯化碳,二氟氯乙烯收率70%(以转化的HCFC-132b计算)。
1955年,美国B.F. Goodrich公司的Frederick[12]以HCFC-132b制备二氟氯乙烯。1%的大豆卵磷脂溶解于HCFC-132b中,加入约等摩尔量的30%的氢氧化钠溶液,在50℃反应,得到二氟氯乙烯,收率较好。
1980年,德国拜耳公司的Mitschke等人[13]通过R132b脱氯化氢制备二氟乙烯,不添加任何乳化剂。在氮气保护下,NaOH和水以泵送入至R132b和水中,反应温度90℃,在5 bar压力下,反应1 h得到二氟氯乙烯,收率88%。
1.4以其他原料制备二氟氯乙烯
1955年,美国Allied chem & dye corp[14]以偏二氟乙烯和氯气制备得到二氟氯乙烯和1,1-二氟-2,2-二氯乙烷。1,1,-二氟乙烯、氯气和二氟二氯甲烷于镍反应器中,650℃下反应1.5 h。反应后的产物除去HCl和高沸点物质,精馏,产物中二氟氯乙烯占22.7%,1,1-二氟-2,2-二氯乙烷占51.2%,其余为高沸点物质。
1956年,美国M.W.Kellogg公司的Davis等人[15]将各种卤代烷脱卤化氢制备相应的卤代烯烃,以1,1,1-三氟-2,2-二氯乙烷(R123)、1,1,2-三氯-1,2,2-三氟乙烷(R113)、1,1,2-三氟-1,2-二氯乙烷(R123b)等卤代烷为原料,可以制备得到二氟氯乙烯。以R123为原料为例:水、R123、锌粉和硬脂酸聚乙二醇醚加入反应器中,室温下搅拌4 h,收集产物,得到氟碳产品,其中含二氟氯乙烯84%,1,1,1-三氟氯乙烷85%,未反应的R123含量8%。
2002年,宾夕法尼亚大学的Eckenhoff等人[16]以1-溴-1-氯-2,2,2-三氟乙烷为原料制备二氟氯乙烯,路线同Scheme_2。在反应器中加入锌粉和1,4-二氧六环,加热至95℃~100℃,滴加1-溴-1-氯-2,2,2-三氟乙烷,滴加时间3 h,控制体系温度不超过100℃,滴加完毕,再持续反应1 h。将反应后的气相产物转移至-78℃冷井中,经检测,原料1-溴-1-氯-2,2,2-三氟乙烷的转化率81%,产物为二氟氯乙烯。
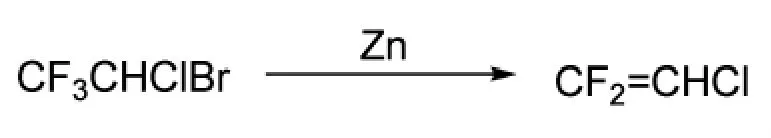
scheme_2
2 二氟氯乙烯的应用
二氟氯乙烯是一种重要的氟精细化工原料,是生产含氟整理剂、含氟表面活性剂及其他含氟精细化学品的关键中间体。可用于热交换材料、航天推动剂、发泡剂、溶剂、清洗剂、替代干燥剂、抛光剂、聚合媒介、气体电介质、灭火剂等。下文对二氟乙烯的化学转化利用进行综述。
2.1制备含氟烯烃
1973年,美国哈佛大学的Jacobson等人[17]研究二氟氯乙烯和三氟乙烯在环戊二烯环加成中的竞争机理,在加热环加成反应中,二氟氯乙烯的亲二烯的活性是三氟氯乙烯的三倍,其在170℃下反应可得到环加成产物降冰片烯衍生物1a和1b,两者的比率为5:3,路线见Scheme_3。
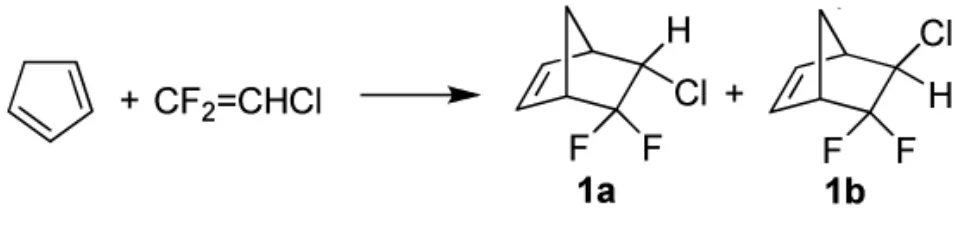
scheme_3
2005年,法国国家科学研究中心的Guiot等人[18]制备了一种溴化的偏氟单体,在共聚体中,溴原子有利于聚合物的交联如弹性体聚合物,而且溴原子的参与能给共聚物带来其他的特性。二氟氯乙烯可参与制备溴化的偏氟单体2(路线见Scheme_4),收率82%。2a理论上可以寻找合适的方法与乙烯形成2b后脱去Br-Cl得到偏氟单体2。偏氟单体2可与偏二氟乙烯形成共聚体,还可制备其余偏氟单体如2c、2d、2e、2f等。
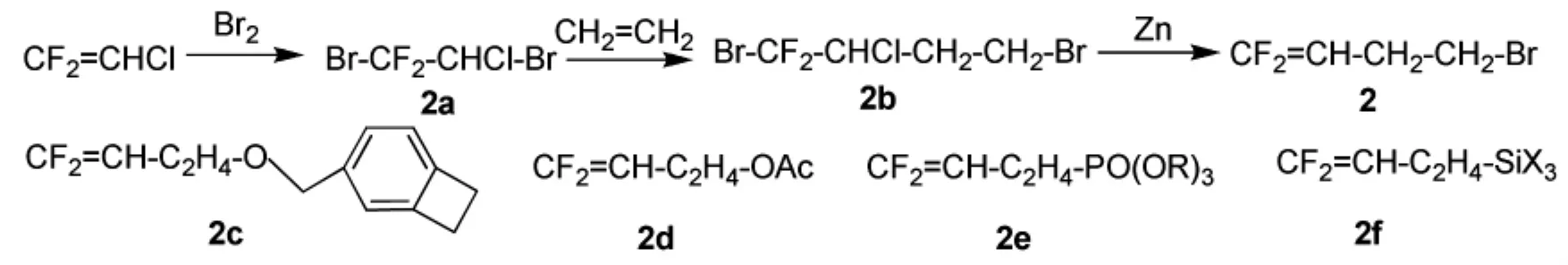
scheme_4
2011年,美国陶氏公司的Tirtowidjojo等人[19]发明了一种制备氟化烯烃(HFO)的方法,HFO预期对大气产生影响较小,表现为对臭氧层的有害影响较小和较低的GWP,还具有低可燃性和低毒性。二氟氯乙烯(CF2=CHCl)可以和氟氯甲烷(CH4-a-bClaFb)合成相应的氟氯丙烯(CF2=CH-CH3-a-bClaFb)。通过调节反应区的温度,调节二氟氯乙烯和CH4-a-bClaFb的摩尔比,在30 s的总停留时间下,CF2=CHCl转化率约为12%±5%,产物选择性为可达50%~90%之间。
2.2制备氟氯烷烃
1992年,帝国化学工业的Shields等人[20]将二氟氯乙烯与氟化氢在50℃~180℃下液相反应转化为1,1,1-三氟氯乙烷(R133a)。在没有催化剂的条件下,液体无水氢氟酸加入至反应釜中,加热至85℃,注入二氟氯乙烯,搅拌反应,在反应釜顶端不定时取出样品,以气相色谱分析。在15 min后,发现样品中只含有33%的二氟氯乙烯,而产物R133a则呈同比例的增加。
1994年,日本大金公司的Shibanuma等人[21]以氟氯烯烃和氟化氢为原料,气相氟化法制备氟氯烷烃,催化剂选择至少含一种钛、钒、锆、钼、铅、氧化铝等金属元素的氟化物。以二氟氯乙烯制备1,1,1-三氟氯乙烷(R133a)为例:氯化锑和氧化铝脱水、HF氟化后得到催化剂,其中氟化铝占65%(以AlF3计)。取此氟化催化剂填入反应管中,通入HF、HFC-134a(CF3CFH2)和二氟氯乙烯,在175℃下反应后,经检测,有36.6 %的二氟氯乙烯转化为R133a,选择性100%。
1995年,德国赫斯特公司的Franz等人[22]将氟氯烯烃与HF加成制备相应的氟氯甲烷,HF来源选择至少含一个HF分子的含氟试剂[B·nHF],B为烷基胺,n≤4。如二氟氯乙烯可与[(n-C4H9)3N·2.6 HF]加成制备得到1,1,1-三氟氯乙烷(R133a)。在高压釜中,在反应物自发压力下升温至65℃反应22 h,再升温至82℃反应46 h。以冷井收集挥发性产物,气相色谱分析,其中含12% 的R133a。
2.3制备含氟环烷烃
1986年,美国佛罗里达大学的Dolbier等人[23]以氟氯烯烃制备3,3-二氟环丁烯,可进一步与重氮甲烷生成吡唑啉化合物。二氟氯乙烯可制备得到1,1,2-三氯-3,3,-二氟环丁烷3,路线见Scheme_5,收率为3%。

scheme_5
1991年,富兰克林和马歇尔学院的Thomsen等人[24]以红外射线诱导二氟亚乙烯基4a和1,2-聚丁二烯4b反应,见Scheme_6。二氟亚乙烯基4a可以经二氟氯乙烯脱去一个HCl产生,但二氟氯乙烯在红外射线下不存在强烈的吸收峰,在反应中需要使用SiF4作为敏化剂,使用当量为二氟氯乙烯的两倍。SiF4可以从射线中吸收能量,通过能量转移激活二氟氯乙烯向二氟亚乙烯基4a转换。当4a产生后,转移至1,2-聚丁二烯4b表面,生成含二氟甲烯基环丙烷基团的聚丁二烯4。

scheme_6
1995年,杜邦公司的Petrov等人[25-26]制备了一系列的聚氟氧杂环丁烷,以六氟丙酮或其余氟酮、氟环氧化物与卤代烯烃为原料,强路易斯酸为催化剂,在100℃~150℃下反应得到聚氟氧杂环丁烷。聚氟氧杂环丁烷可用作溶剂和增塑剂,具有很高的稳定性。利用六氟丙酮、二氟氯乙烯和CFCl3、AlCl3复合催化剂,在100℃下震荡反应18 h。气相色谱检测,六氟丙酮转化率为22%,聚氟氧杂环丁烷选择性为95%。将产物精馏,经19F NMR和气-质联用色谱分析,其中含90%的主产物5和10%的异构产物5’,合成路线见Scheme_7。
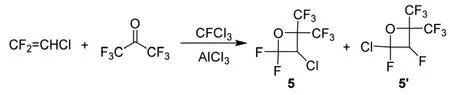
scheme_7
2000年,杜伦大学的Chambers等人[27]以含氟烯烃和醇、胺和醚为原料制备氟化氧杂环丁烷和环氧乙烷,如6b。以二氟氯乙烯和乙醇为原料,1:1加成反应形成6a,然后在室温下经氢氧化钾作用快速生成二氟氧杂环丁烷6b,收率82%。氟化的氧杂环丁烷是制备氟化聚醚的关键中间体,二氟氧杂环丁烷6b就可以在三氟甲磺酸存在下,开环再调聚形成低聚物6,转化率为70%,总路线见Scheme_8。

scheme_8
2002年,英国杜伦大学(Durham)的Cooper等人[28]研究环己烷或环戊烷与偏氟类烯烃的自由基加成反应,经环烷烃上的C-H键发生均裂后,能得到一系列的二氟亚甲基化合物R-CF2-CXYH(R=C5H9或C6H11,X、Y=Cl或F)。这些加成物脱氟化氢后可得到新的多卤化的烯烃。二氟氯乙烯和环己烷或环戊烷加成后可得到7a、7b和7c、7d,路线见Scheme_9,投料为环己烷,产物中7a含量49%,7b含量4%,氯代环己烷含量1%;投料环戊烷时,产物中只检测到24%的7c和痕量的7d。

scheme_9
2.4制备麻醉剂
1991年,美国华盛顿大学的Kharasch等人[29]研究挥发性麻醉药氟甲氧基-2,2-二氟-1-三氟甲基乙烯基醚(FDVE)的代谢途径。在大鼠和人体内,FDVE能在谷胱甘肽和β-裂解酶作用下,最终水解生成硫醚氨酸8a和3,3,3-三氟-2-氟甲氧基丙酸。Kharasch等人以二氟氯乙烯制备了N-乙酰基-S-(2,2-二氟乙烯基)-L-半胱氨酸8,用作分析硫醚氨酸8a的内标物,合成路线见Scheme_10。

scheme_10
2000年,美国佛罗里达大学的Hudlicky等人[30]通过氟化溴为氟化试剂,制备了一系列的氟化乙基甲基醚,均为已知的麻醉剂,收率高,生物学评估纯度好(>99%)。二氟氯乙烯可得到溴氟化物9a,再脱去HBr后经甲醇钠作用生成二氟乙基甲基醚9,详细路线见Scheme_11。溴和二氟氯乙烯制备溴氟化物9a,纯度>98%,收率97.2%;烯烃9b纯度99.4%,收率90.5%;最后得到纯度98.5%的9,收率85%。此产品容易在100℃分解,可在90℃下减压精馏得到纯度更高的产品9,用于麻醉剂。

scheme_11
2002年,为了研究吸入式麻醉剂的作用机理和目标靶向,宾夕法尼亚大学的Eckenhoff等人[31]合成了六种结构和物理性质和常用临床麻醉药氟烷(1-溴-1-氯-2,2,2-三氟乙烷)类似的化合物,其中二氟氯乙烯合成的卤代三碳吖丙因10(路线见Scheme_12),显现出强力的麻醉效力,且无毒,能加强GABA中氯离子的活动,稳定血清白蛋白及其他氟烷所含有的特性。

scheme_12
2.5其他
1968年,英国曼彻斯特大学的Gregory等人[32]以二氟氯乙烯和三氟碘甲烷辐射反应得到收率为92%的1:1加成物3-氯-1,1,1,2,2-五氟-3-碘丙烷11a和2-氯-1,1,1,3,3-五氟-3-碘丙烷11b,两者比例为92:8,副产物为1,1-二氟碘乙烯,路线见Scheme_13。二氟氯乙烯和三氟碘甲烷混合后,距离10~15 cm处辐射150 h,得3-氯-1,1,1,2,2-五氟-3-碘丙烷11a的收率24%,2-氯-1,1,1,3,3-五氟-3-碘丙烷11b得收率为10%。
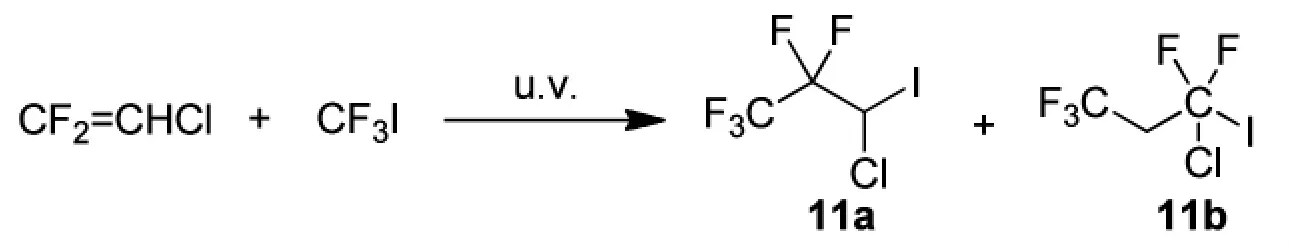
scheme_13
1974年,英国曼彻斯特大学的Bevan等人[33]以二氟氯乙烷和三氯硅烷为原料,在辐射下进行反应,主要产物为三氯-(2,2-二氟乙基)硅烷12a、三氯-(1,1-二氟乙基)硅烷12b、三氯-(2-氯-2,2-二氟乙基)硅烷12c和三氯-(2-氯-1,1-二氟乙基)硅烷12d。反应随二氟氯乙烷和三氯硅烷投料比例的变化而变化,机理可能为三甲基氯硅烷在辐射下产生三氯硅自由基,加成至二氟氯乙烯的二氟甲基上或亚甲基上,形成上述产物,路线见Scheme_14。

scheme_14
1979年,拜耳公司的Lantzsch等人[34]设计了一种含氟苄酯或醚结构的化合物,类似于拟除虫菊酯,可用于防治害虫,如昆虫、螨虫。二氟氯乙烯可制备得到含氟苄醚13,路线见Scheme_15。四亚甲基砜、氢氧化钾、邻苯二酚,加热至100℃,搅拌30 min。在110℃下通入二氟氯乙烯,通入时间3 h。将反应物在15 mmHg、100℃下蒸馏,得到含氟苄醚13,收率65%。
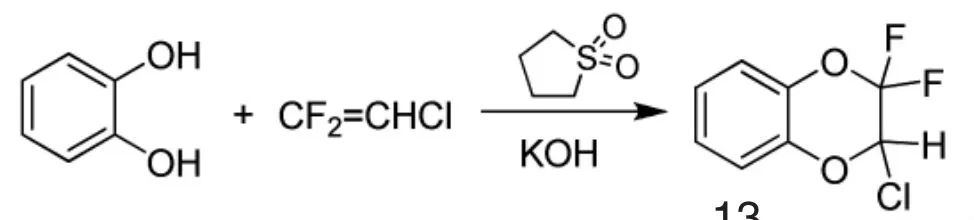
scheme_15
1980年,波特兰州立大学的Mir等人[35]通过将SF5Br加成至氟化烯烃,得到含SF5Br的氟化有机物,成功将SF5导入含氟有机物中。二氟氯乙烯和SF5Br,加热至100℃反应14 d,得到产品含SF5Br氟化物14,收率73%,路线见Scheme_16。

scheme_16
2000年,日本摄南大学的Shigeoka等人[36]将氟氯乙烯如三氟氯乙烯或二氟氯乙烯在仲丁基锂存在下与氯化锌得到新的氟乙烯基锌试剂如15b,可与3,8-二碘次卟啉二甲基酯或其锌络合物15c在钯催化下形成含氟次卟啉化合物。二氟氯乙烯可合成乙烯基锌试剂如15b,从而得到含氟次卟啉化合物15,路线见Scheme_17。

scheme_17
2002年,法国国家科学研究中心的Guiot等人[37]以氟氯烯烃与甲醇调聚反应制备相应的氟氯甲醇,如二氟氯乙烯可得到3-氯-2,2-二氟丙醇(Scheme_18),烯烃中的氟原子能刺激羟甲基自由基的反应活性,氯原子则不利用反应进行。二氟氯乙烯制备3-氯-2,2-二氟丙醇较好的反应条件为在407 K起始温度下,选用2,5-二甲基-2,5-二(叔丁基过氧基)己烷(DHBP)为引发剂,反应7 h,反应产物为淡黄色液体,19F NMR检测,原料转化80%,无其余异构化副产物。334 K~336 K、20 mmHg下精馏后可得无色液体3-氯-2,2-二氟丙醇。

scheme_18
3 总结
二氟氯乙烯除可用于材料、助剂、清洗剂、抛光剂、气体电介质、灭火剂等方面外,还可制备各类含氟烯烃、烷烃、环烷烃及麻醉剂等多种下游氟精细产品。随着二氟氯乙烯的应用研究的逐渐增多,开拓二氟氯乙烯的制备工艺路线可以作为未来发展的一个重要规划。
参考文献:
[1] Ilgenfritz E M, Ruh R P. Method for the preparation of alkenes and alkadienes: US, 2996556 [P]. 1961-08-15.
[2] Gervasutti C. Process for preparing hydrogen containing fluoroethylenes and chlorofluoroethylenes from chlorofluoroethanes: EP, 253410[P].1988-01-20.
[3] Forsyth S R, Grady B T. Production of fluorocarbons: EP, 364103[P]. 1990-04-18.
[4] Vanlautem N, Wilmet V, Pirotton J. et al. Process for the preparation of 1,1-difluoro-2-chloroethylene from 1,1-difluoro-1,2,2-trichloroethane: EP,0556893[P]. 1993-08-25.
[5]付庆,向绍基,姚汉清,等.一种1-氯-2,2-二氟乙烯的制备方法: CN, 102992945 [P]. 2013-03-27.
[6] Wang N, Yang L, Xiang S. An efficient synthesis of 1 -chloro-2,2-difluoroethylene via the reductive dechlorination of 1,2,2 -trichloro -1,1 -difluoroethane [J]. J. Chem. Res.,2013, 37(5):273-275.
[7] Fernandez R E, Gumprecht W H. Halogen exchange fluorination: WO, 9113048[P]. 1991-09-05.
[8] Fernandez R E, Kaplan R B. Dehydrohalogenation process: US,5180860 [P]. 1993-01-19.
[9] Brunet S, Requieme B, Colnay E. et al. Catalytic gas-phase fluorination of 1,1,1-trifluoro-2-chloroethane over chromium(III)oxide: Preparation of hydrofluoroalkanes [J]. Appl. Catal., B: Environmental, 1995, 5(4): 305-317.
[10] Sprague L, Graham D, Ferstandig L. Production of aliphatic fluorocarbons: WO, 2001007384 [P]. 2001-02-01.
[11] Miller C B. Manufacture of fluoroolefins : US, 2628989 [P]. 1953-02-17.
[12] Frederick M R. Process for preparing chlorofluoroethylenes: US,2709181 [P]. 1955-05-24.
[13] Mitschke K H, Niederpruem H. Process for the preparation of 1,1-difluoro-2-chloroethylene and its utilisation as a blowing gas or a blowing agent: DE,2846812[P]. 1980-05-08.
[14] Litant I, Miller C B. Production of 1, 1-difluoro-2, 2-dichloroethylene : US,2723297 [P]. 1955-11-08.
[15] Davis H R, Chiang S H K. Process for dehalogenation of organic compounds in the presence of a detergent: US, 2774798 [P].1956-12-18.
[16] Eckenhoff R G, Knoll F , Greenblatt E P,et al. Halogenated diazirines as photolabel mimics of the inhaled haloalka-ne anesthetics[J]. J. Med. Chem., 2002, 45(9):1879-1886.
[17] Jacobson B M, Bartlett P D, Cycloaddition X V. Competing mechanisms in the reactions of cyclopentadiene with trifluoroethylene and 2-chloro-1,1-difluoroethylene [J]. J. Org. Chem.,1973, 38(5): 1030-1041.
[18] Guiot J, Neouze M -A, Sauguet L. et al. Synthesis and copolymerization of fluorinated monomers bearing a reactive lateral group. XX. Copolymerization of vinylidene fluoride with 4-bromo-1,1,2-trifluorobut-1-ene [J]. J. Polym. Sci., Part A: Polym. Chem.,2005, 43(5): 917-935.
[19] Tirtowidjojo M M, Chakraborty D, Eiffler J. et al. Process for the production of chlorinated and/or fluorinated propenes: WO, 2011044447 [P]. 2011-04-14.
[20] Shields C J. Process for the purification of 1,1,1,2-tetrafluoroethane: EP, 507458 [P]. 1992-10-07.
[21] Shibanuma T, Yamada Y, Yoshimura T,et al. Process for fluorinating halogenated hydrocarbon: WO, 9413610 [P]. 1994-06-23.
[22] Franz R, Siegemund G. Process for the addition of HF to halogenated alkenes: EP, 634383 [P]. 1995-01-18.
[23] Dolbier Jr W R, Al-Fekri D M. Synthesis of new fluorovinylzinc reagents and their application for synthesis of fluorine analogs of protoporphyrin [J]. J. Org. Chem.,1987, 52(9):1872-1874.
[24] Thomsen M W, Kimmich B F. Infrared laser-induced reactions of difluorovinylidene with 1,2 -polybutadiene [J]. Macromolecules ,1991, 24(23): 6343-6345.
[25] Petrov V A, Smart B E. Process for preparing polyfluorooxetanes: WO, 9523795[P].1995-09-08.
[26] Petrov V A, Davidson F, Smart B E. A new synthesis of fluorinated oxetanes[J]. J. Org. Chem., 1995, 60(11):3419 -3422.
[27] Chambers R D, Gilani A H S, Gilbert A F,et al. Free-radical chemistry Part XII: Radical reactions of trifluoroethene [J]. J. Fluorine Chem ., 2000, 106(1):53-67.
[28] Cooper J A, Copin E, Sandford G,et al. Free radical addition of cyclopentane and cyclohexane to halogeno derivatives of 1,2-difluoroethene [J]. J. Fluorine Chem., 2002, 115(1):83-90.
[29] Kharasch E D, Jubert C, Spracklin D K,et al. Dose-dependent metabolism of fluoromethyl-2,2-difluoro-1-(trifluoromethyl)vinyl ether(compound A), an anesthetic degradation product, to mercapturic acids and 3,3,3-trifluoro-2-(fluoromethoxy)propanoic acid in rats [J]. Toxicol. Appl. Pharmacol,1999, 160(1):49-59.
[30] Hudlicky T, Duan C, Reed J W,et al. Practical preparation of potentially anesthetic fluorinated ethyl methyl ethers by means of bromine trifluoride and other methods [J]. J. Fluorine Chem., 2000, 102: 363-367.
[31] Eckenhoff R G, Knoll F J, Greenblatt E P,et al. Halogenated diazirines as photolabel mimics of the inhaled haloalkane anesthetics [J]. J. Med. Chem., 2002, 45(9): 1879-1886.
[32] Gregory R, Haszeldine R N, Tipping A E. Addition of free radicals to unsaturated systems. XV. Investigation of the direction of radical addition to chloro-1,1-difluororethylene[J]. J. Chem. SOC.(C): Organic,1968,(24): 3020-3025.
[33] Bevan W I, Haszeldine R N, Middleton J,et al. Polyfluoroalkyl compounds of silicon. XII. Reactions of trichlorosilane with 2-chloro- and 2-bromo-1,1-difluoroethylene [J]. J. Chem. Soc., Dalton Trans., Inorganic Chemistry(1972-1999), 1974,(21):2305-2309.
[34] Lantzsch R, Marhold A, Behrenz W,et al. Preparation of fluoro -substituted benzodioxoles and benzodioxanes: DE, 2819788 [P]. 1979-11-08.
[35] Mir Q C, Debuhr R, Haug C,et al. The addition of pentafluorosulfur bromide to fluoroolefins. II [J]. J. Fluorine Chem.,1980, 16(4): 373-383.
[36] Shigeoka T, Kuwahara Y, Watanabe K,et al. Synthesis of new fluorovinylzinc reagents and their application for synthesis of fluorine analogs of protoporphyrin [J]. J. Fluorine Chem ., 2000, 103(2):99-103.
[37] Guiot J, Ameduri B, Boutevin B,et al. Synthesis of fluorinated telomers. Part 7. Telomerization of 1,1-difluoro-2-chloroethylene and 1,2-difluoro-1,2-dichloroethylene with methanol[J]. New J. Chem., 2002, 26(12): 1768-1773.
Preparation and Application of 2-Chloro-1,1-difluoroethylene
DAI Jia-liang, XU Wei-guo, JIN Hang-dan
(Zhejiang Chemical Industry Research Institute Co.,Ltd., Hangzhou,Zhejiang 310023 , China)
Abstract:2-chloro-1,1-difluoroethylene can be used for the preparation of fluoride alkenes, alkanes and fluoride chemicals, has a widely applications in various fields. This paper introduces the preparation of 2-chloro-1,1-difluoroethylene, and various application of 2-chloro-1,1-difluoroethylene were reviewed in detail.
Keywords:2-chloro-1,1-difluoroethylene;preparation;application
文章编号:1006-4184(2016)2-0001-08
收稿日期:2015-11-11
作者简介:戴佳亮(1984-),男,工程师,主要从事含氟精细化学品的研究开发工作。E-mail: daijialiang@sinochem.com。
