动态动力学拆分在手性药物合成中的应用
2016-06-12吕力琼蒋成君浙江新东港药业股份有限公司浙江台州38000浙江科技学院生物与化学工程学院浙江杭州3003
林 义,吕力琼,黄 俊,蒋成君*(.浙江新东港药业股份有限公司,浙江 台州 38000;.浙江科技学院生物与化学工程学院,浙江 杭州 3003)
医药化工
动态动力学拆分在手性药物合成中的应用
林义1,吕力琼2,黄俊2,蒋成君2*
(1.浙江新东港药业股份有限公司,浙江台州318000;2.浙江科技学院生物与化学工程学院,浙江杭州310023)
摘要:动态动力学拆分是合成手性化合物最方便和最有效的方法之一,该方法的主要特征是用酶催化拆分和金属催化原位外消旋化未反应的底物,克服了经典动力学拆分最高产率只有50%的缺陷,理论上可以达到100%的收率。本文概述了动态动力学拆分技术在手性药物合成中的应用。
关键词:化学-酶;手性药物;动态动力学拆分;研究进展
修回日期:2015-09-04
绝大多数的药物由手性分子构成,两种手性分子可能具有明显不同的生物活性。药物分子必须与受体(起反应的物质)分子几何结构匹配,才能起到应有的药效,就如右手只能带右手套一样。因此,往往两种异构体中仅有一种是有效的,另一种无效甚至有害。目前世界上使用的药物总数约为1900种,手性药物占50%以上,在临床常用的200种药物中,手性药物多达114种。手性药物的合成方法,包括天然产物中提取、手性合成、外消旋化合物的拆分,其中外消旋化合物的拆分又可分为结晶拆分法、化学拆分法、生物拆分法。生物拆分法是以微生物和酶作为催化剂、立体选择性控制合成手性化合物的方法。酶催化的动力学拆分具有高度的化学、区域和对映选择性、反应条件温和等优点。但是,对单一目标产物而言,酶催化的动力学拆分理论收率最高只有50%。为了克服这个缺陷,人们将金属催化消旋化与酶催化动力学拆分反应相结合,即动态动力学拆分。本文对动态动力学拆分合成抗高血压、抗炎镇痛、抗抑郁及抗肿瘤等手性药物研究的最新进展进行了综述。
1 治疗抑郁症药物盐酸舍曲林
盐酸曲舍林,化学名为(1S,4S)-4-(3,4-二氯苯基)-1,2,3,4-四氢-N-甲基-1-萘胺盐酸盐,是美国辉瑞公司研发的选择性5-羟色氨酸再取抑制剂(SSRI),1992年首次在美国作为抗抑郁药上市,1996年又批准用于治疗强迫性精神障碍等症。本品抑制神经递质回收的专一性好,具有长效、体内清除快、对肝脏毒性低、适合老年患者服用等优点。
Jan-E. Bäckvall等[1]以CALB酶与钌催化剂1动态动力学拆分1,2,3,4-四氢-1-萘胺,收率70%,ee值99%。以此为原料合成盐酸舍曲林路线如下,见图1。
Thalén等[2]以1,2,3,4-四氢-1-萘胺为底物,钌催化剂2和CALB酶协同进行动态动力学拆分,获得具有光学活性的盐酸曲舍林,见图2,产率28%,ee值99%。

图1 盐酸曲舍林合成路线1

图2 盐酸曲舍林合成路线2
2 盐酸普萘洛尔
盐酸普萘洛尔,即1-异丙氨基-3-(1-萘氧基)-2-丙醇盐酸盐,是β受体阻断类药物中的代表药物,应用于临床已有20余年历史。在临床上广泛应用于治疗心律失常、高血压、心绞痛等疾病。普萘洛尔一直是以外消旋体方式供药,其S-(-)-异构体阻滞β-受体作用比R-(+)-异构体强约100倍,且在血液中有更长的半衰期,钌催化剂3与CALB酶协同动态动力学拆分可以有效地合成(R)-普萘洛尔(图3)[3],ee值98%。

图3 (R)-普萘洛尔合成路线
3 盐酸度洛西汀
盐酸度洛西汀,即(S)-(+)-N,N-二甲基-3-(1-萘氧基)-3-(2-噻吩)-丙胺盐酸盐,是Eli Lilly公司开发的一个5-羟色胺和去甲肾上腺素再摄取抑制剂。5-羟色胺和去甲肾上腺素均属中枢神经递质,在调控情感和对疼痛的敏度方面起着重要作用。度洛西汀能够抑制神经元对5-羟色胺和去甲肾上腺素的再摄取,由此提高这两种中枢神经递质在大脑和脊髓中的浓度,故可用于治疗抑郁症和焦虑症以及缓解中枢性疼痛如糖尿病外周神经病性疼痛和妇女纤维肌痛等。度洛西汀也能作用于尿道中的5-羟色胺和去甲肾上腺素受体,从而增强尿道括约肌的神经性紧张程度和收缩能力,所以对妇女应激性尿失禁症治疗也有效。
以β-羟基腈为底物,CALB酶和钌催化剂4进行DKR获得相应的β-腈基酯[4],产率87%,ee 值98%,紧接着可制备出(R)-度洛西汀和(S)-度洛西汀,见图4[5]。

图4 度洛西汀的合成路线
4 β受体阻滞药-(R)-丁呋洛尔
(S)-丁呋洛尔是一个有效的芳乙醇胺类β-阻滞剂,被用作研究细胞色素P450(CYP)酶的底物,可用于治疗轻、中度高血压。目前光学活性丁呋洛尔的合成主要有外消旋体拆分法[6-7]和化学不对称合成法[8-9]等。韩世清[10]以7-乙基苯并呋喃-2-甲醛为原料,经酶致转腈化、Ritter反应、酰胺还原合成了光学活性的(S)-丁呋洛尔,见图5,产率23.3%,ee值达71%。

图5 (S)-丁呋洛尔的合成路线
Johnston等[11]提出氯乙醇消旋法可以用于光学活性的(R)-丁呋洛尔的合成中,指出β-氯代乙醇是DKR的关键(图6)。
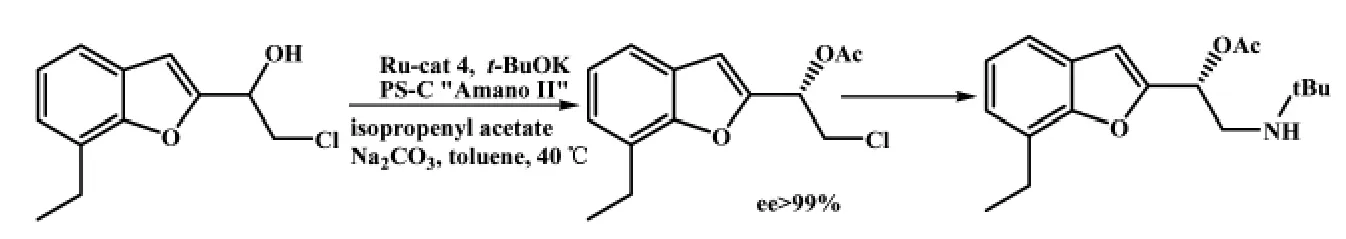
图6 (R)-丁呋洛尔的合成路线
5 (+)-NPS R-568
钯催化剂和CALB酶协同作用进一步应用在钙(+)-NPS R-568的合成中,包括合成中的关键步骤酮肟中间体的不对称还原酰化,见图7[12],产率63%,ee值96%。

图7 钙化合物(+)-NPS R-568的合成路线
6 苯乙醇胺-N-甲基转移酶(S)-抑制剂
以α-三氟甲基酮为底物,CALB酶与金属催化剂协同作用动态动力学拆分合成苯乙醇胺-N-甲基转移酶(S)-抑制剂(图8),产率72%,ee值98%。

图8 苯乙醇胺-N-甲基转移酶(S)-抑制剂合成路线
7 (R)-imperanene的合成
以香草醛为底物,V-MPS和B. cepacia lipase协同催化得到具有光学活性的(R)-imperanene,产率92%,ee值99%,见图9[13]。

图9 (R)-imperanene的合成路线
8 迷迭香裂碱
从迷迭香的花和叶子中能提取具有优良抗氧化性的抗氧化剂和迷迭香精油。广泛用于医药、油炸食品、富油食品及各类油脂的保鲜保质,而迷迭香香精则用于香料、空气清新剂、驱蚁剂以及杀菌、杀虫等日用化工业。迷迭香裂碱可通过动态动力学拆分合成,见图10,产率50%,ee值>99%。

图10 迷迭香裂碱的合成路线
9 氯哌斯汀
别名咳平,化学名为1-(2-((4-氯苄基)苄基)乙基)哌啶,中枢性镇咳药,主要抑制咳嗽中枢而镇咳,也有微弱的抗组胺作用,镇咳作用弱于可待因。以a为底物,LPL-D1[14]与金属催化剂协同作用进行动态动力学拆分,见图11,产率94%,ee值96%。

图11 氯哌斯汀的合成路线
10 结束语
伴随着手性药物的发展,各种手性药物合成的新方法不断扩充和完善。然而由于一些新方法使用的催化剂存在价格昂贵、重复性使用差,以及对底物浓度限制、分离困难等问题,使这些方法在工业上的广泛应用还有很大的距离。动态动力学拆分技术将酶催化和化学催化有机地结合起来,克服了经典动力学拆分最高产率只有50%的缺陷,理论上可以达到100%的收率。动态动力学拆分技术在工业生产中的应用,将是本领域科学工作者今后研究的重点。
参考文献:
[1] Lisa K,Zhao D B,Sortais J B,et al. Bäckvall. A chemoenzymatic approach to enantiomerically pure amines using dynamic kinetic resolution: application to the synthesis of norsertraline[J]. Chemistry-A European Journal,2009,15 (14):3403-3410.
[2] Jans P,Jan E B. Chemoenzymatic dynamic kinetic resolution of primary amines [J]. Journal of the American Chemical Society,2005,127(50):17620-17621.
[3] Pilar H,Vittorio P,Andres R A. Dynamic kinetic resolution via hydrolase-metal combo catalysis in stereoselective synthesis of bioactive compounds[J]. Advanced Synthesis & Catalysis,2012,354:2585-2611.
[4] Belén M M,Michaela E,Krisztián B,et al. Highly compatible metal and enzyme catalysts for efficient dynamic ki netic resolution of alcohols at ambient temperature [J]. Angewandte Chemie International Edition,2004,43(47):6535-6539.
[5] Annika T,Richard L,Bäckvall J E. A chemoenzymatic dynamic kinetic resolution approach to enantiomerically pure (R)-and(S)-duloxetine[J]. The Journal of Organic Chemistry,2011,76(10):3917–3921.
[6] Machin P J,Hurst D N,Osbond J M.β-Adrenoceptor activity of the stereoisomers of the bufuralol alcohol and ketone metabolites[J]. Journal of Medicinal Chemistry,1985,28(11):1648-1651.
[7] Hull J D,Feodor S,Turner N J. Synthesis of optically active methadones,LAAM and bufuralol by lipase-catalyzed acylations [J]. Tetrahedron:Asymmetry,2003,14(5):567-576.
[8] Marek Z,Agnieszka T K,Andrzej P K. Enantioselective reduction of benzofuryl halomethyl ketones:asymmetric synthesis of(R)-bufuralol[J]. Tetrahedron:Asymmetry,2005,16(19):3205-3210.
[9] Marek Z,Agnieszka T K,Andrzej P K. Asymmetric synthesis of(S)-bufuralol and a propafenone analogue[J]. Tetrahedron:Asymmetry,2003,14(12):1659-1664.
[10]韩世清,褚朝森,韦萍.(R)-醇腈酶催化法合成光学活性(S)-丁呋洛尔[J].精细化工,2008,25(11):1106-1109.
[11] Johnston E V,Krisztián B,Bäckvall J E. Enantioselective synthesis of(R)-bufuralol via dynamic kinetic resolution in the key step[J]. The Journal of Organic Chemistry,2010,75(13):4596–4599.
[12] Kiwon H,Kim Y W,Jaiwook P,et al. Chemoenzymatic synthesis of the calcimimetics(+)-NPS R-568 via asymmetric reductive acylation of ketoxime intermediate [J]. Tetrahedron Letters,2010,51(27):3536-3537.
[13] Masahiro E,Koji S,Moriaki S,et al. A mesoporous-silicaimmobilized oxovanadium cocatalyst for the lipase -catalyzed dynamic kinetic resolution of racemic alcohols [J]. Angewandte Chemie International Edition,2013,52(13):3654-3658.
[14] Lee J,Yeonock O,Choi Y K,et al. Dynamic kinetic resolution of diarylmethanols with an activated lipoprotein lipase [J]. ACS Catalysis,2015,5:683-689.
Application of Dynamic Kinetic Resolution in the Preparation of Chiral Drugs
LIN Yi,LV Li-qiong,HUANG Jun,JIANG Cheng-jun
(Neo-Dankong Pharmacetical Co., Ltd., Taizhou, Zhejiang 318000, China; School of Biological and Chemical Engineering,Zhejiang University of Science & Technology,Hangzhou,Zhejiang 310023, China)
Abstract:The dynamic kinetic resolution (DKR) of racemic compounds provides one of the most convenient and efficient routes to a wide range of chiral molecules. A key feature of this methodology is the use of metal catalysts for the in situ racemization of enzymatically unreactive enantiomers in the enzymatic resolution of racemic substrates. It overcomes the limitation of the maximum 50% yield in the traditional kinetic resolution. In this way, all of the substrate could be converted into a single product isomer with a 100% theoretical yield. In this review and the latest research progress as well as the application in preparation of chiral drugs are also presented.
Keywords:chemoenzyme; chiral drugs; dynamic kinetic resolution; research progress
文章编号:1006-4184(2016)2-0012-05
基金项目:中国博士后科学基金(2014M551745);浙江省自然科学基金(LY15B060008)。
作者简介:林义(1977-),男,浙江玉环人,工程师,主要从事医药化工研究工作。E-mail: linyi12@hotmail.com。
*通讯作者:蒋成君(1981-),男,博士,高级工程师。E-mail jcj312@163.com
