三氟乙酰肼的合成及应用研究进展
2015-11-28李伟徐卫国杭晓春
李伟,徐卫国,杭晓春
(浙江省化工研究院有限公司,浙江杭州310023)
氟化工
三氟乙酰肼的合成及应用研究进展
李伟,徐卫国,杭晓春
(浙江省化工研究院有限公司,浙江杭州310023)
对三氟乙酰肼的概况、合成及应用进行了详细的综述。
三氟乙酰肼;合成;应用
三氟乙酰肼是一种常用的有机氟化工原料,主要用于合成三氟甲基三氮唑及其衍生物以及其它一些常见的五元或六元含氮杂环化合物,在农药、医药及有机金属配合物中用途广泛。
1 三氟乙酰肼的性质
三氟乙酰肼是一种白色粉末状固体,CAS号为1538-08-5,分子式为C2H3F3N2O,分子量为128.05,常压下熔点为111℃,沸点为192.3℃。肼类化合物一般性质比较活泼,引入-CF3这一强吸电子基团,更增强了分子的活性,本文对三氟乙酰肼的主要制备方法及其在合成中的应用进行综述。
2 三氟乙酰肼的合成
2.1 以三氟乙酸乙酯为原料和水合肼反应
文献报道较多的制备三氟乙酰肼的方法是三氟乙酸乙酯和水合肼反应,反应路线见式1:
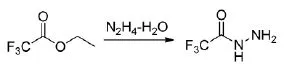
式1
Groth R H[1]等早在1960年就报道了采用此路线来合成三氟乙酰肼的方法,他采用0.75 mol的三氟乙酸乙酯和0.825 mol 85%的水合肼在150 mL 95%乙醇中回流3 h,得到96 g粗品,然后用丁醇重结晶得到该产品。
Sitzmann M E[2]等报道了以三氟乙酸乙酯和80%水合肼为原料,在25℃下,在甲醇中反应16 h得到该产品。
D.Searle等[3]在专利US6423713、US6514977及US6979686报道了采用0.10 mol的三氟乙酸乙酯和0.11 mol 80%的水合肼在25 mL乙醇中回流6 h,以96%的收率得到该产品。
Mishra[4]报道了以三氟乙酸乙酯和80%水合肼为原料,在70℃~75℃下,在乙醇中反应6 h得到该产品。
Kim Ji Na等[5]报道了用0.08 mol的三氟乙酸乙酯和0.1 mol 80%的水合肼在8 mL甲醇中室温下反应13 h,以67%的收率得到该产品。
Gruenenthal GmbH等[6]在专利US2012/46301中报道了采用三氟乙酸乙酯和1.1当量的80%的水合肼为原料,在乙醇中回流3 h,以57%的收率得到该产品。
Funabiki等[7]报道了采用三氟乙酸乙酯和80%的水合肼为原料,以四氢呋喃为溶剂回流1 h制得该产品。
MERCK公司[8]在专利WO2006/9886、WO2006 /119260中报道了用三氟乙酸乙酯和80%的水合肼为原料,在水和乙腈混合溶剂中在14℃~25℃下反应2 h,处理得到该产品。
2.2 以三氟乙酸酐为原料和水合肼反应
见诸文献报道的关于三氟乙酰肼的合成也有采用三氟乙酸酐为起始原料,Incyte公司[9]在专利WO2007/150026中就报道了采用三氟乙酸酐和水合肼为原料,在0℃~20℃下,以四氢呋喃为溶剂制得三氟乙酰肼,其反应路线见式2。

式2
2.3 以三氟乙酸酐为原料和肼基甲酸苄酯反应
Bredikhin,Aleksei等[10]报道了经过两步反应来制备三氟乙酰肼的新方法,该法先由三氟乙酸酐和肼基甲酸苄酯反应生成中间体三氟乙酰基肼基甲酸苄酯,再通过还原得到产物三氟乙酰肼,其反应路线见式3。
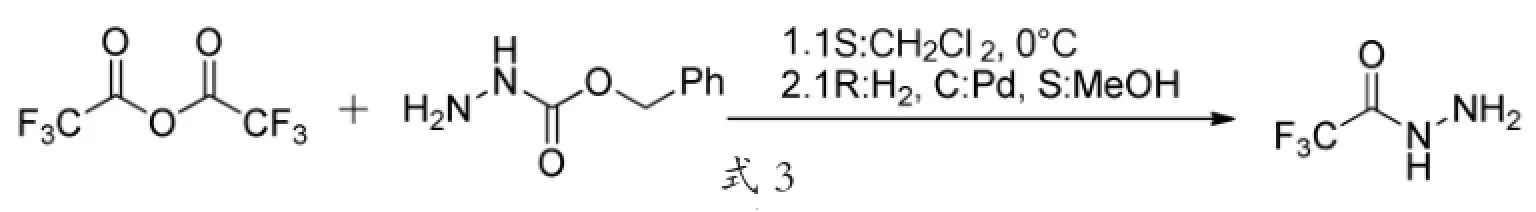
式3
2.4 以三氟乙酸酐和邻苯二甲酰亚肼反应
Brosse,Nicolas等[11]报道了用三氟乙酸酐和邻苯二甲酰亚肼反应来制备三氟乙酰肼的方法,该方法通过两步反应来实现,先在邻苯二甲酰亚肼的肼基上一个三氟乙酰基团,再通过水解得到三氟乙酰肼,其反应路线见式4。
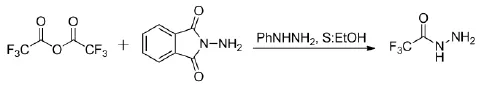
式4
3 三氟乙酰肼的应用
以上简要介绍了三氟乙酰肼的合成方法,三氟乙酰肼是制备三氟甲基氮杂环化合物的常用中间体,广泛应用于农药、医药及配位化学等领域。
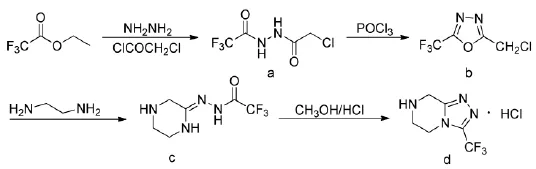
式5
2010年,刘安昌教授对这一路线进行了改进,使反应时间由24 h缩短为12 h,收率由44.8%提高到53.6%[14]。
早在1961年,Brown H C和Chambers W J就分别报道了用三氟乙酰肼来制备2,5-二(三氟甲基)-1,3,4-口恶二唑,它是一种环合螯合试剂,可以用来合成多种含有两个三氟甲基的杂环化合物[15-16]。他们采用三氟乙酸甲酯和肼反应首先制得三氟乙酰肼,再与三氟乙酰氯生成N,N-二(三氟乙酰)肼,N,N-二(三氟乙酰)肼经过环化制得2,5-二(三氟甲基)-1,3,4-口恶二唑,只是产物的收率较低,仅为24%,后来经Reitz和Finkes改进,N,N-二(三氟乙酰)肼的环合采用五氧化二磷进行共热脱水制得2,5-二(三氟甲基)-1,3,4-口恶二唑,收率大大提高,达到了86%[17],反应路线见式6。
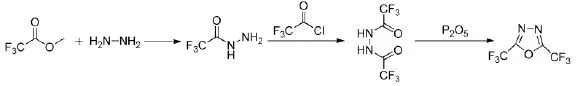
式6
3.2 合成三氟甲基三氮唑类化合物
三氟乙酰肼也是合成三氟甲基三氮唑类化合物的重要中间体,三氮唑类化合物中含有较多的氮杂原子,能够比较容易的和金属原子配位,强拉电子基团三氟甲基的存在能够进一步增强其配位能力,三氟甲基三氮唑类化合物在配位化学中有重要的用途,Hea Jung Park等[5]合成了一系列的三氟甲基三氮唑和金属铱(Ⅲ)的配合物(见式7),这些配合物在OLED电子器件中表现出优越的性能。
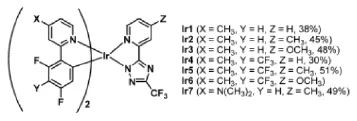
式7
式7中的三氟甲基三氮唑配体部分是由三氟乙酰肼和取代的氰基吡啶在强碱的作用下合成的,合成路线见式8。

式8
另外,三氮唑类化合物在药物分子中也有重要用途,Metcalf等[9]在专利WO2007150026中报道了使用三氟乙酰肼来制备三氮唑类治疗冠状动脉疾病的药物分子,其结构通式(式9)及中间体的合成方法(式10)如下:

式9药物分子中间体的结构通式

式10药物分子中间体的制备路线
药物活性测试表明,在分子中引入三氟甲基基团,分子的抗病活性明显提高,Metcalf等在不同的部位对这一类分子进行修饰,得到了十几种药物活性较好的新型结构。
同样的,三氮唑类化合物在农药分子中也有重要用途,2010年,Pallwal等人[18]开发了一系列抗真菌的化合物,该系列化合物的抗菌活性较好,其中结构式为VII的化合物活性最好,三氟乙酰肼是制备该结构化合物的关键中间体。其合成路线见式11。

式11
2012年Hoyt S B等[19]合成了一系列的醛固酮合酶抑制剂,在这些结构中,化合物F具有较好的活性,三氟甲基三氮唑是该化合物的重要结构单元,该化合物以3,4-二氢-1-(2H)-萘酮为起始原料,经过如下几步反应来得到化合物F,其合成路线见式12。
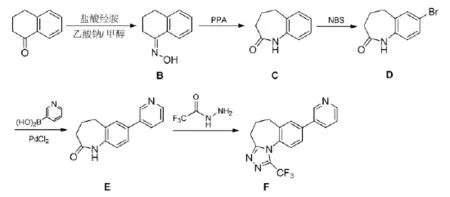
式12
Antonio Espinosa等[20]曾报道了具有较好选择性的一锅法来制备三唑的吡嗪类化合物的新方法,该法以二氯喹喔啉为起始原料,改变了传统需要两步的合成方法,新方法操作更简单。通过该法制备的9-三氟甲基-6-氯吡咯并[3,2,e]-[1,2,4]-三唑[4,3,a]吡嗪经生物活性测试,推断该化合物可能具有抗抑郁的效果,其合成路线见式13。
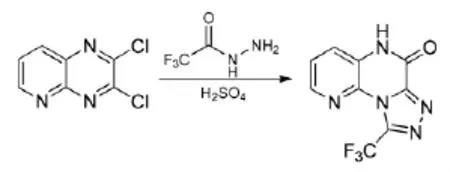
式13
三氟乙酰肼在合成化学中也有重要应用,Christina Ng Di Marco等[21]以环丙烷基硫酰胺为原料经串联和重排环化反应来制备稠环的1,2,4-三氮唑类化合物,该反应以异丙醇为溶剂,加入三乙胺,先发生一个重排反应,生成二氢吡咯硫醚,然后再加入三氟乙酰肼生成二氢吡咯1,2,4-三唑,其反应路线见式14。
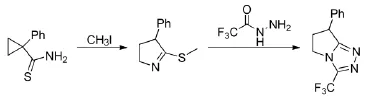
式14
3.3 合成三嗪类化合物
三氟乙酰肼是合成杀虫剂吡蚜酮(pymetrozine)的重要中间体,吡蚜酮(Pymetrozine)是瑞士诺华公司1988年开发的新型杂环类杀虫剂,具有高效、低毒、高选择性、对环境友好等特点。K.H.Muller等[22]在专利US 4952701中报道了吡蚜酮的工艺路线,该路线以三氟乙酸乙酯和水合肼为起始原料,经过缩合反应制得三氟乙酰肼;三氟乙酰肼与光气经过环合反应制得2-三氟甲基-1,3,4-口恶二唑-5(4H)-酮;与氯丙酮经过烷基化反应制得2,3-二氢-5-三氟甲基-2-氧-1,3,4-口恶二唑-3-丙酮,再与水合肼经过扩环反应制得4-三氟乙酰胺基-6-甲基-3-氧-2,3,4,5-四氢-1,2,4-三嗪,酸性条件下水解得到4-胺基-6-甲基-3-氧-2,3,4,5-四氢-1,2,4-三嗪,最后再经过缩合反应制得目标产物吡蚜酮。其工艺路线见式15。

式15
3.4 合成三氟甲基取代的吡唑类化合物
吡唑类化合物在农药和医药中用途广泛,引入三氟甲基基团往往能够改良药物的性质,生物体内的P38组激酶是生物丝裂原活化蛋白激酶中的一组,它调节生物体内的磷酸化过程和转录过程,它的紊乱会给生物体带来极大的损伤,而吡唑类化合物在抗P38组激酶紊乱中发挥重要作用,Ashok S.等[23]在专利US6979686 B1中报道了多种具有抑制P38组激酶紊乱的吡唑类化合物,其中含三氟甲基吡唑的化合物活性表现较其它化合物活性好,其合成路线式16。

式16
3.5 合成多三氟乙酰基取代的联氨类化合物
三氟乙酰肼可以继续和三氟乙酸乙酯或三氟乙酸酐等含有三氟乙酰基的化合物反应来得到N,N-二取代的三氟乙酰肼,二取代的三氟乙酰肼则很难与三氟乙酸乙酯或三氟乙酸酐继续反应,可能是由于分子中引入两个较强的拉电子基团导致-NH的亲核性减弱,而继续加入活性更高的三氟乙酰氯,在强碱BuLi的作用下,可以继续生成三个三氟乙酰基取代的化合物,进一步反应可以生成四个三氟乙酰基取代的三氟乙酰肼[24],其反应路线见式17。
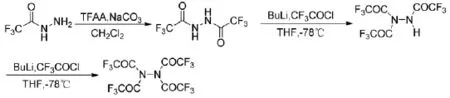
式17
4 总结
综上所述,三氟乙酰肼的制备原料易得,工艺简单,其在制备含三氟甲基的杂环化合物中应用广泛,而这些杂环化合物一般是药物分子中主要的活性位点,因此三氟乙酰肼在制备含氟农药、医药及其他化工中间体中有广阔的应用前景,开发三氟乙酰肼及其下游产品对我国氟化工行业有重要的意义。
[1]Groth R H.Effects of perfluoroalkyl groups on adjacent functions[J].J.Org.Chem.,1960,25(1):102-105.
[2]Sitzmann M E.1,3,4-Oxadiazoles with SF5-containing substituents[J].J.Fluo.Chem.,1995,70(1):31-38.
[3]Naraian A,Clare M,Collins P.Substituted pyrazoles as p38 kinase inhibitors:US,6514977[P].2002-02-04.
[4]Mishra,Paliwal,Rakesh,et al.Synthesis of substituted-3-chloro-1-(3-(trifluoromethyl)-5-methoxy-4H-1,2,4-triazol-4-yl)-4-phenylazetidin-2-ones[J].J.Indi.Chem.Soc., 2010,87(5):589-593.
[5]Park,Hea J,Yoo.Rational design,synthesis,and characterization of deep blue phosphore-scent Ir(III)complexes containing(4'-Substituted-2'-pyridyl)-1,2,4-triazole ancillary ligands[J].J.Org.Chem.,2013,78(16):8054-8064.
[6]Gruenenthal Gmbh.Substituted cyclic carboxamide and urea derivatives as ligands of the vanilloid receptor:WO, 2012022487 A1[P].2012-02-23.
[7]Funabiki,Kazumasa,Noma N Kuzuya,et al.A direct and general synthesis of 5-substituted 3-trifluoromethyl-1,2,4-triazoles via the three-component condensation reaction of ethyl trifluoroacetate,hydrazine and amidines[J].Journal of Chemical Research.,1999,(5):300-301.
[8]Amatruda,John M.Combination of dipeptidyl peptidase-IV inhibitor and a cannabinoid Cb1 receptor antagonist for the treatment of diabetes and obesity:WO,2006119260A2[P].2006-09-11.
[9]Metcalf B,Hang K.Purinone derivatives as HM74A agonists:WO,2007150026[P].2007-12-27.
[10]Bredikhin,Aleksei.Increasing the N-H acidity:Introduction of highly electronegative groups into the hydrazine molecule[J].Synlett.,2005,(12):1939-1941.
[11]Brosse,Nicolas.Synthesis of N-(protected)aminophthalimid es:application to the synthesis of singly labeled isoniazid [J].Journal of the Chemical Society-Perkin Transactions 1, 1998,(22):3685-3688.
[12]Falchi A,Stivanello M,Serafini S.Process for the preparation of fluorophenylacetic acid and derivatives thereof:WO, 2008078350[P].2008-07-03.
[13]Perlman N,Etinger M,Niddam-Hildesheim V.Preparation of 3(R)-amino-4-(2,4,5-trifluoro-phenyl)butanoic acid esters as intermediates in synthesis of sitagliptin:WO, 2009064476[P].2009-05-22.
[14]田志高,刘安昌,张良,等.3-三氟甲基-5,6,7,8-四氢-1,2,4-三唑[4,3-α]吡嗪盐酸盐[J].中国医药工业杂志, 2010,41:805-806.
[15]Brown H C,Pilipovich D.Synthesis of 2,5 bis(perfluoroalkyl)-1,3,4-oxadiazoles[J].J.Org.Chem.,1961,26:4407-4409.
[16]Chambers W J,Coffman D D.Synthesis of-2,5-bis(perfluoroalkyl)-1,3,4-oxadiazoles and Thiadiazoles[J].J.Org.Chem.,1961,26:4410-4412.
[17]Reitz D B,Finkes M J.Reaction of 2,5-bis(trifluoromethyl) -1,3,4-oxadiazole with primary amines.Synthesis of 4-substituted-3,5-bis(trifluoromethyl)-4H-1,2,4-triazoles[J].J.Hetero.Chem.,1989,26:225-230.
[18]Paliwal R,Sekhar K C,Taneja A,et al.Synthesis of substituted 3-chloro-1-(3-(trifluoromethyl)-5-methoxy-4H-1,2,4-tri-azol-4-yl)-4-phenylazetidin-2-ones[J].J.Indian Chem.Soc.,2010,87:589-593.
[19]HoytSB.Aldosteronesynthaseinhibitors:WO,2012148808A1 [P].2012-04-20.
[20]Antonio E.Regioselective one-pot synthesis of-9-alkyl-6-chloropyrido[3,2-e][1,2,4]triazolo-[4,3-a]pyrazines[J].J.Org.Chem.,2005,87:2878-2880.
[21]Christina N D M,Scott D Kuduk.Synthesis of fused[5,5] -1,2,4-triazoles via tandem thioimidate cyclopropane rearrangement-cyclization[J].Syn.Commu.,2006,36:3377-3386.
[22]Muller K H.Preperation of 4-amino-1,2,3-triazlo-5-ones: US,4952701[P].1990-08-28.
[23]Naraian Ashok S,Clare M.Substituted pyrazoles as P38 kinase inhibitors:US,6423713[P].2002-07-23.
[24]Aleksei B.Increasing the N-H acidity:introduction of highly electronegative groups into the hydrazine molecule [J].Synlett.,2005,(12):1939-1941.
Progress in Synthesis and Application of 2,2,2-Trifluoroacetohydrazide
LI Wei,XU Wei-guo,HANG Xiao-chun
(Zhejiang Chemical Industry Research Institute Co.,Ltd.,Hangzhou,Zhejiang 310023,China)
The general properties,synthesis and applications of 2,2,2-trifluoroacetohydrazide were reviewed.
trifluoroacetohydrazide;synthesis;application
1006-4184(2015)4-0001-06
2014-10-31
李伟(1987-),男,硕士,主要从事含氟精细化学品的研究开发工作。E-mail:liwei41@sinochem.com。
