糖尿病大鼠颈性前庭诱发肌源性电位的观察
2016-06-06袁艺昕梁勇刘小龙黄雪琴杨衬张威李琦
袁艺昕 梁勇 刘小龙 黄雪琴,2 杨衬 张威 李琦
·实验研究·
糖尿病大鼠颈性前庭诱发肌源性电位的观察
袁艺昕1梁勇1刘小龙1黄雪琴1,2杨衬1张威1李琦1
【摘要】目的观察糖尿病大鼠不同时期的颈性前庭诱发肌源性电位(cervical vestibular evoked myogenic potential,cVEMP)的变化及意义。方法将220只雄性SD大鼠随机分为对照组(20只)及糖尿病组(200只),应用链脲佐菌素(streptozotocin, STZ)诱导糖尿病大鼠模型,再按照造模的时间将糖尿病组分为糖尿病4、6、8、10、12周组,每组40只,观察各组大鼠的一般情况及血糖、ABR、cVEMP检测结果。结果糖尿病组大鼠造模后出现多饮、多食、多尿等典型糖尿病症状,与对照组比较,血糖升高(P<0.01)、体重下降(P<0.01);糖尿病组从第6周开始出现ABR反应阈值升高(P<0.05);糖尿病组cVEMP阈值第8周(53.87±11.16 dB nHL)、第10周(67.00±12.74 dB nHL)、第12周(67.00±9.23 dB nHL)升高(P<0.01),P1波潜伏期第8周(5.01±0.33 ms)、第10周(5.37±0.45 ms)、第12周(5.39±0.24 ms)延长(P<0.01),N1波潜伏期第10周(8.98±0.86 ms)、第12周(9.08±0.45 ms)延长(P<0.01),但糖尿病组P1-N1波间振幅与对照组比较差异无统计学意义(P>0.05)。结论糖尿病大鼠从造模成功第8周开始,cVEMP阈值开始升高、P1波及N1波潜伏期延长,出现不同程度的前庭终器损伤,提示cVEMP可作为早期诊断前庭功能损害的方法之一。
【关键词】糖尿病; 颈性前庭诱发肌源性电位; 前庭功能
糖尿病(diabetes mellitus, DM)是一种胰岛素相对或绝对缺乏而使血糖水平异常增高、脂肪和蛋白质代谢紊乱的一种代谢紊乱性疾病。前庭平衡功能障碍是糖尿病并发症之一[1],Lindsey[2]、Agrawal[3]通过对糖尿病患者进行问卷调查发现65岁以上糖尿病患者摔倒年发生率为39%,是对照组的3倍,糖尿病患者出现姿势不稳、摔倒的风险增高,而引起患者前庭平衡功能障碍的病理生理基础是高血糖导致的微血管病变及周围神经病变。颈性前庭诱发肌源性电位(cervical vestibular evoked myogenic potentials,cVEMP)是通过高强度的声刺激在紧张的胸锁乳突肌上记录到来源于球囊的的肌电位。cVEMP传导通路包括球囊斑、前庭下神经、前庭侧核、前庭脊髓束及同侧胸锁乳突肌运动神经元,此通路上的各种病变均可导致cVEMP阈值升高、潜伏期延长、振幅降低乃至波形消失等。因此,可以用cVEMP来评价球囊和前庭下神经的功能[4]。Konukseven等[5]对30例糖尿病患者、糖尿病前期组患者及对照组进行眼性前庭诱发肌源性电位(ocular vestibular evoked myogenic potentials,oVEMP)和cVEMP检测,发现在糖尿病组oVEMP和cVEMP 的P1、N1波潜伏期平均值较糖尿病前期组及对照组显著延长。目前虽已有诸多研究表明糖尿病会影响患者前庭功能,但因为临床研究容易受到研究对象用药、年龄及样本量等因素的干扰,导致研究结果不尽相同,而且缺少相应的实验病理模型说明其发生发展的机制。因此,本实验拟通过建立糖尿病大鼠模型,观察糖尿病大鼠cVEMP阈值、P1、N1波潜伏期及P1-N1波间振幅出现异常的时间点,为进一步研究其病理机制提供实验依据,以便指导对糖尿病患者平衡功能损伤相关并发症进行早期干预。
1材料与方法
1.1实验动物及分组雄性SD大鼠220只,体重300~350 g(购于南方医科大学实验动物中心),耳廓反射灵敏,鼓膜标志正常,无自发性眼震。将动物随机分为对照组(20只)及糖尿病组(200只),再按照造模后观察时间将糖尿病组分为糖尿病4、6、8、10及12周组,每组40只。
1.2糖尿病大鼠模型制备[6]糖尿病组大鼠适应性饲养1周后进行糖尿病造模:链脲佐菌素(streptozotocin,STZ)以0.1 mol/L、pH 4.2~4.6的柠檬酸缓冲液配制成的1% STZ溶液,按55 mg/kg一次性腹腔注射STZ;对照组予腹腔注射等量柠檬酸缓冲液。注射后两组均给予充足的饮水及食物。
1.3观察指标和方法
1.3.1一般情况观察及血糖检测糖尿病大鼠造模后, 观察各组大鼠进食、饮水量,小便的量、色、味,精神状态、体形、毛色,造模成功率及死亡率。注射STZ后第7天测量大鼠尾静脉随机微量血糖,血糖大于16.7 mmol/L则表示糖尿病大鼠造模成功。此后每隔一周测一次尾静脉微量血糖。
1.3.2ABR检测各组大鼠用2%戊巴比妥钠0.2 ml/100 g麻醉后,应用Smart EP听觉诱发电位仪(美国智听系统公司)检测大鼠ABR阈值;将银针电极的记录电极置于颅顶正中皮下,参考电极置于同侧乳突,接地电极置于后足部;刺激声为疏密相交替的12.1次/秒的短声,持续时间为0.1 ms,带通滤波300~3 000 Hz,观察时程20 ms,叠加次数1 024次;在距外耳道口1.5 cm处通过插入式耳机给声,刺激声强从100 dB SPL开始,以10 dB递减,以能分辨出波Ⅲ的最低刺激强度确定ABR阈值。
1.3.3cVEMP检测[7,8]应用美国GSI公司Audera V2.7听觉诱发电位仪检测各组大鼠cVEMP。大鼠同法麻醉后将大鼠头部抬起,向前上方牵引,使颈部肌肉尽量处于过伸状态。采用银针插入电极,于双侧背部颈伸肌平C3颈椎棘突水平插入记录电极,枕骨正中线插入参考电极,后足部插入接地电极。插入式耳机固定于外耳道深部0.5 cm处,刺激声为click声,交替波,刺激强度由100 dB nHL开始,10 dB递减,重复率为5.00 Hz,扫描204次,扫描时间40 s,带通滤波10~1 000 Hz。每侧耳均接受两次cVEMP测试,取平均值。将记录到的第一个双相波分别命名为P1(正波)和Nl(负波),P1和N1波出现即认为cVEMP引出,阈值为能引出cVEMP的最小刺激强度,绝对峰间振幅为P1-N1之间的波间振幅。
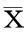
2结果
2.1一般情况观察与对照组相比,糖尿病组大鼠出现多饮、多食、多尿,体重下降等典型糖尿病症状,精神萎靡,活动力下降,毛发发黄,后期有部分糖尿病大鼠出现视网膜病变、坏疽、腹水等症状。总造模成功率76.50%(153/200),总死亡率22.22%。正常对照组大鼠生长状况良好,未出现以上表现。将糖尿病组中耳镜检查外耳道干净、鼓膜完整的119只大鼠纳入进一步实验,余则剔除。
2.2各组大鼠血糖与体重与对照组相比,各组糖尿病大鼠血糖明显升高(F=64.07,P<0.01),体重明显下降(F=17.44,P<0.01),差异均具有统计学意义,说明DM造模成功(表1)。

表1 对照组与糖尿病不同时期组大鼠血糖、体重及
注:与对照组比较, *P<0.05, **P<0.01
2.3各组大鼠ABR反应阈比较糖尿病不同时期组ABR反应阈值从第6周开始升高,并随着病程延长ABR反应阈值升高更加显著,与对照组相比,差异有统计学意义(P<0.05)(表1)。
2.4各组大鼠cVEMP比较图1为对照组与糖尿病第4、6、8、10、12周组cVEMP的结果。表2为对照组与糖尿病不同时期组cVEMP各项指标之间的比较,可见,糖尿病第4、6周组的cVEMP阈值与对照组比较差异无统计学意义(P>0.05),而糖尿病第8、10、12周组的阈值与对照组比较差异有显著统计学意义(P<0.05或P<0.01)。糖尿病第4、6周的P1波潜伏期与对照组比较无统计学差异(P>0.05),而糖尿病第8、10、12周组的P1波潜伏期与对照组比较差异有显著统计学意义(P<0.05或P<0.01)。糖尿病第4、6、8周组的N1波潜伏期与对照组比较差异无统计学意义(P>0.05),而糖尿病第10、12周组的N1波潜伏期与对照组比较差异有统计学意义(均为P<0.01)。糖尿病不同时期组的cVEMP的P1-N1波间振幅与对照组比较差异无统计学意义(F=0.87,P>0.05)。
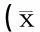
表2 对照组与糖尿病不同时期组大鼠cVEMP阈值、P1、N1波潜伏期及振幅比较±s)
注:与对照组比较, *P<0.05, **P<0.01
3讨论
内耳对体内血糖浓度及胰岛素水平的改变极敏感,葡萄糖可为细胞提供钠钾泵所需的能量以维持正常生理功能,当葡萄糖代谢紊乱时会导致内耳能量供应障碍,内淋巴液及外淋巴液离子浓度改变使得迷路电位发生变化,引发眩晕[9]。Perez等[10]对饮食诱导的糖尿病沙鼠进行了短潜伏期前庭诱发电位检测,发现糖尿病组短潜伏期前庭诱发电位的第一波潜伏期比对照组显著延长且振幅显著降低,表明糖尿病沙鼠出现了前庭终末器官功能障碍。但短潜伏期前庭诱发电位是利用旋转角加速度刺激沙鼠,以远场方式记录电位,由于加速度对双耳均产生刺激,结果易受到对侧耳功能状况的影响,因此其应用及结果的可靠性受到了限制。糖尿病早期便出现外周前庭系统以及中枢前庭系统受损,但因为前庭感受终器受单一血管终末支支配,相对中枢前庭系统更容易受损,因而早期常表现为周围前庭功能减退[11]。
人类球囊的主要作用是感知平衡,但也有声敏感特性。球囊是前庭器官对声音最敏感的部分,可能是其位于蹬骨足板下,最易受到鼓膜传来声波的影响。cVEMPs是目前评价球囊功能(前庭下神经)的唯一方法[12],Bektas等[13]对2型糖尿病患者与正常对照组进行了VEMP检测,发现两组间无论潜伏期、振幅均无明显统计学差异;Kamali等[9]对10例伴周围神经病变的1型糖尿病患者、14例不伴周围神经病变的糖尿病患者及正常对照组进行cVEMP检测,发现除了糖尿病伴周围神经病变患者的cVEMP潜伏期较正常对照组延长外,其余指标均无明显统计学差异;出现上述结果的原因可能与这两项研究的样本量少有关。Konukseven等[5]对30例糖尿病患者、30例糖尿病前期患者及31例正常对照组行cVEMP检测,发现cVEMP的P1波潜伏期延长程度与糖尿病组血浆糖化血红蛋白(HbA1c)和空腹血糖水平呈正相关,并提出亚临床前庭神经性疾病是糖尿病并发症之一。
本实验依据国内外公认的制造糖尿病动物模型方法[6], 成功制作了糖尿病大鼠模型, ABR测试发现自糖尿病造模后第6周开始,糖尿病组大鼠出现ABR反应阈值升高,说明糖尿病大鼠耳蜗功能受损,并随着病程的发展逐步加重。Matsuzaki等[14]对豚鼠应用阿卡米星肌肉注射,通过药物破坏大鼠耳蜗功能,而保留前庭功能,结果发现实验组豚鼠ABR未引出,但仍可引出VEMP,说明VEMP不受耳蜗功能的影响,其肌源性电位是源于前庭感受器,而非耳蜗感受器。尽管目前对于听觉功能障碍是否会影响VEMP仍有一定争议,但大多数研究表明这种影响不明显,尤其是在听功能部分损坏的情况下。
本实验对糖尿病组及对照组大鼠进行cVEMP的测试方法及参数设置均参考国外动物cVEMP的测试方法[7,8],对P1、N1波判断除参考相关文献外,同时每个强度重复测试2次,使P1、N1波形具有良好的重复性,对照组及糖尿病4~6周组结果与Sakakura[7]测试大鼠cVEMP中各指标的正常值相符。cVEMP各项指标中,阈值最稳定,推测当外周前庭终器出现损害时,球囊感知声强敏感性下降,需要更强的刺激才可引出。cVEMP波潜伏期延长考虑是因迷路后脱髓鞘病变,特别是前庭脊髓束病变,导致神经传导速度降低,除了cVEMP神经传导通路的变性外,糖尿病导致的肌肉骨骼退化也可能会影响测试结果[5]。Myers等[15,16]对糖尿病动物进行解剖发现,糖尿病血流动力学改变导致球囊与椭圆囊出现了微血管病变以及神经髓鞘病变,糖尿病动物血液粘稠度增加及红细胞变形能力减弱,使得红细胞运输氧至周围器官的能力下降,神经组织灌注受限,逐渐出现外周神经节段性脱髓鞘、轴索变性等改变。文中结果显示随着糖尿病病程的延长,糖尿病大鼠cVEMP的阈值与N1、P1波潜伏期从第8周开始逐渐出现不同程度的异常,而糖尿病大鼠cVEMP的波间振幅与对照组比较却无明显差异,振幅与胸锁乳突肌肌力成正比,肌力改变会使振幅出现改变,但肌力与振幅这种未量化的关系指标很难客观评价前庭功能,除非将cVEMP 标准化[17,18]。本实验过程中大鼠头部拉伸的程度不一,肌力难以达到统一标准,可能是导致各组间振幅无明显差异的原因。

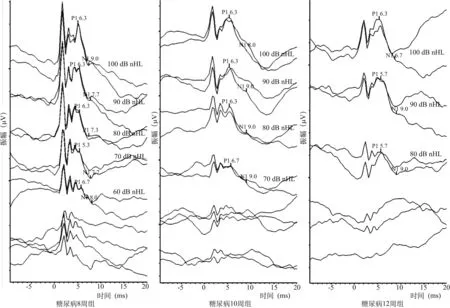
图1 对照组及糖尿病4、6、8、10、12周组大鼠的cVEMP波形
综上所述,本研究结果表明,糖尿病大鼠从第8周开始出现外周前庭终器及前庭传导通路损伤,表现为cVEMP阈值明显升高、P1波潜伏期延长。糖尿病的严重程度和病程都可能对患者的前庭功能产生影响,cVEMP为糖尿病的早期诊断和检测及进一步研究糖尿病的病理机制提供了一定的理论基础和实验方法。
4参考文献
1Özel HE, ÖzkiriM, Gencer ZK, et al. Audiovestibular functions in noninsulin-dependent diabetes mellitus[J]. Acta Oto-Laryngologica,2014,134: 51.
2Lindsey M, Tilling TK, Haled D, et a1. Falls as a complication of diabetes mellitus in older people[J].J Diabetes Complications,2006,20:158.
3Agrawal Y, Carey JP, Della Santina CC, et al. Diabetes, vestibular dysfunction, and falls: analyses from the national health and nutrition examination survey[J]. Otol Neurotol,2010,31:1445.
4Rauch SD.Vestibular evoked myogenic potentials[J].Curt Opin Otolaryngol Head Neck Surg,2006,14:299.
5Konukseven O, Polat SB, Karahan S, et al. Electrophysiologic vestibular evaluation in type 2 diabetic andprediabetic patients:air conduction ocular and cervical vestibular evoked myogenic potentials[J]. Int J Audiol,2015,54:536.
6Yumuk Z, Kucukb asmaci O, Buyukbaba Boral O, et al. The effects of streptozotocin -induced diabetes on brucellosis of rats[J]. FEMS Immunol Med Microbiol,2003,39:275.
7Sakakura K, Miyashita M, Chikamatsu K, et al. Tone burst-evoked myogenic potentials in rat neckextensor and flexor muscles[J]. Hear Res, 2003,185:57.
8Yang TH, Young YH. Click-evoked myogenic potentials recorded on alert guinea pigs[J]. Hear Res, 2005,205:277.
9Kamali B, Hajiabolhassan F, Fatahi J, et al. Effects of diabetes mellitus type Ι with or without neuropathyon on vestibular evoked myogenic potentials[J]. Acta Med Iran, 2013,51:107.
10Perez R, Ziv E, Freeman S, et a1. Vestibular end-organ impairment in an animal model of type 2 diabetes mellitus[J]. Laryngoscope,2001,111:110.
11李鹃, 张天宇, 沈建中, 等. 糖尿病患者前庭功能的改变及其临床意义[J]. 临床耳鼻咽喉头颈外科杂志, 2008,22:10.
12王博琛, 梁勇, 刘小龙, 等. 量化的胸锁乳突肌表面肌电对颈部前庭诱发肌源性电位的影响[J]. 中华耳鼻咽喉头颈外科杂志, 2013,48:470.
13Bektas D, Gazioglu S, Arslan S, et al. VEMP responses are not affected in non-insulin-dependent diabetes mellituspatients with or without polyneuropathy[J]. Acta Otolaryngol,2008,128:768.
14Matsuzaki M, Murofushi T. Click-evoked potentials on the neck of the guinea pig[J]. Hear Res,2002,165:152.
15Myers SF. Myelin-sheath abnormalities in the vestibularnerves of chronically diabetic rats[J]. Otolaryngol Head NeckSurg, 1998,119:432.
16Myers SF, Ross MD, Jokelainen P, et a1. Morphological evidence of vestibularpathology in long-term experimental diabetes mellitus. I.Microvascular changes[J]. Acta Otolaryngol,1985,100:351.
17张萍, 梁传余, 郑芸, 等. 前庭诱发电位[J]. 听力学及言语疾病杂志, 2004,12:197.
18吴子明, 张素珍, 周娜, 等. 前庭诱发的肌源性电位临床应用[J]. 中华耳科学杂志, 2006,4:298.
(2016-01-14收稿)
(本文编辑周涛)
网络出版时间:2016-4-2615:54
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20160426.1554.040.html
Cervical Vestibular Evoked Myogenic Potential in Diabetes Rats
Yuan Yixin*, Liang Yong, Liu Xiaolong, Huang Xueqin, Yang Chen, Zhang Wei, Li Qi
(*Department of Otolaryngology Head and Neck Surgery,Nanfang Hospital,Southern Medical University, Guangzhou, 510515,China)
【Abstract】ObjectiveTo verify whether cervical vestibular evoked myogenic potential (cVEMP) can be used as an effective method to assess vestibular functions in diabetic rats, we examined and analyzed cervical vestibular evoked myogenic potential (cVEMP) in different duration diabetic rats and normal rats. MethodsA total of 220 male SD rats were randomly divided into control group (n=20) and diabetes group (n=200). The diabetic rats were further divided into 4,6,8,10, and 12 week groups (40 rats each group) according to the diabetes duration. Diabetes was induced by STZ. The general situation,ABR and cVEMP were conducted in all the groups.ResultsAll diabetic groups appeared typical diabetic symptoms including polydipsia, polyuria, more food, weight loss (P<0.01) and blood glucose elevation (P<0.01). The threshold of ABR was significantly elevated (P<0.05) in the 6,8,10, and 12 week diabetic group. Compared to the normal group, the threshold of cVEMP was significantly elevated in 8 week(53.87±11.16 dB nHL),10 week(67.00±12.74 dB nHL),12 week(67.00±9.23 dB nHL) diabetes groups(P<0.01) and the mean latency of P1 peak was significantly prolonged (P<0.01) in 8 week(5.01±0.33 ms),10 week(5.37±0.45 ms),and 12 week(5.39±0.24 ms) . The mean latency of N1 peak was significantly prolonged (P<0.01) in 10 week (8.98±0.86 ms), and 12 week (9.08±0.45 ms) compared to the control group. As to P1-N1 amplitudes, there was no significantly difference among all groups (P>0.05).ConclusionIn the cVEMP test , the threshold increased, the PI peak latency and N1 peak latency prolonged from the 8 th week of diabetes rats models. Vestibular functions were descent gradually due to different degrees of vestibular end-organ impairment.All data indicated that VEMP could be used as an early diagnostic method.
【Key words】Diabetes mellitus;Cervical vestibular voked myogenic potentials;Vestibular function
【中图分类号】R587.1;R764.34
【文献标识码】A
【文章编号】1006-7299(2016)03-0260-05
DOI:10.3969/j.issn.1006-7299.2016.03.010
作者简介:袁艺昕,女,湖南人,医学硕士,主要研究方向为耳科学。通讯作者:梁勇(Email:yliang@smu.edu.cn)
1南方医科大学南方医院耳鼻咽喉头颈外科(广州510515);2广东医学院附属医院耳鼻咽喉科
