新高考探究性实验试题的命题趋势及应对策略
2016-06-05毛锋
◎毛锋
新高考探究性实验试题的命题趋势及应对策略
◎毛锋
本文探究了新高考探究性实验试题的命题趋势及应对策略,旨在为学生备战高考奠定良好的基础。
新高考;探究性实验;命题趋势;应对策略
一、命题趋势
近年来,化学高考命题,主要以考查探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求考生必须冷静地审题,联系所学过的知识和掌握的技能,进行知识的类比、迁移、重组,全面细致地思考才能正确做答。探究性实验题以其创新、灵活的特点逐渐成为高考命题的热点题型。
二、探究性实验的一般思路

1.准确地把握实验目的
2.利用已学知识,分析如何实现这个目的——实验原理
3.结合实验材料,初步确定设计对策或思路——实验方案
三、探究性实验的类型
1.未知产物的探究
例1.某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况),由上述实验事实可知:

(1)固体M中一定有的物质是_________(填化学式),理由是_________。
(2)B装置的名称是_________。写出B装置中反应的离子方程式_________。
(3)C装置的作用是_________,如果实验中没有B装置,则C装置中产生的现象是_________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_ _________。
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
参考答案:(1)FeS、Fe B装置增重、量气管有气体;(2)洗气瓶2OH-+H2S=2H2O+S2-;(3)证明H2S已被B中NaOH溶液完全吸收,生成黑色沉淀;(4)硫,漏斗、玻璃棒;(5)b、c。
【方法指导】通过化学反应原理猜测可能生成哪些物质,对这些物质的检验来推测出究竟含有哪些物质。虽然探究性实验主要考察学生的探究能力,但在问题的设置上常常包含了对实验基础知识的考察,如:常见物质分离提纯方法:结晶法、蒸馏法、过滤法、升华法、萃取、渗析法等;常见气体的制备、净化、干燥、收集方法;熟悉重点操作:气密性检查;量气操作;防倒吸、防污染操作;蒸发、灼烧操作……
2.物质性质的探究
例2.某学生按图示方向将A装置与下面所示装置相连,设计如下实验,请帮助完成实验报告。
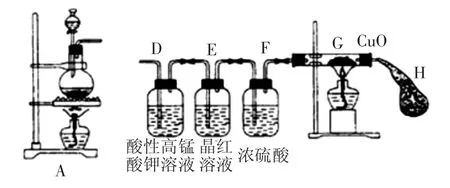
(1)实验目的:研究铁与浓硫酸的反应
(2)实验药品:铁钉、浓硫酸、酸性高锰酸钾溶液、品红溶液、氧化铜、硫酸铜溶液
(3)实验步骤:
实验内容和步骤实验现象_________________结论
①连接好装置并检查气密性
②将铁钉加入到烧瓶中,在向其中滴加浓硫酸
未见明显现象
③先点燃A再点燃G处酒精灯片刻后烧瓶中溶液有颜色变化,并有气泡产生
(4)问题探究
该学生在实验过程中,观察到D装置中溶液颜色逐渐变浅,E装置中溶液颜色未见明显变化,再过一段时间后,G装置中氧化铜粉末由黑色转变为红色,气球H逐渐鼓起,此时E装置中溶液颜色仍未明显变化。
①G装置中氧化铜由黑变红,请结合化学方程式说明原因是______________________。
②为证明铁钉与浓硫酸在不加热时是否发生反应,可采用的方法是_______________。
参考答案:(三)铁遇冷的浓硫酸发生钝化,铁表面的氧化物被破坏并发生反应,溶液有Fe3+生成,并伴随有SO2气体产生。(四) (1)A装置中浓硫酸在加热条件下与铁反应逐渐变成稀硫酸;生成的H2经过G装置发生反应:CuO+H2=Cu+H2O(加热条件)(2)对比实验:取两根无锈铁钉,一根放置在冷的浓硫酸浸泡一段时间后,一根不做任何处理;然后将两根铁钉分别置于等浓度的硫酸铜溶液中,观察铁钉表面是否有红色物质析出:若在冷的浓硫酸中浸泡过的铁钉上没有红色物质析出,则表明在不加热时,铁钉与浓硫酸发生反应,否则铁钉与浓硫酸不发生反应。
【方法指导】
第一,在探究过程中往往可以通过对比实验,即设置几组平行实验来对照比较,从而研究和揭示某种规律,解释某种现象形成的原因或证明某种反应机理。第二,无论是无机物、还是有机物性质的探究,都必须在牢牢掌握元素化合物知识的基础上,大胆猜想,细心论证,脱离了元素化合物知识孤立地看实验问题是不科学的。只有灵活运用已有的元素化合物知识,就能变探究性实验为验证性实验,使复杂问题简单化。
3.化学反应原理的探究
例3.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
(1)将镁粉投入冷水中,未见任何现象;
(2)将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
(3)将镁粉放入液溴中,未观察到任何明显现象;
(4)向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是()
A.镁粉只能直接与溴水中的溴反应
B.水是镁粉与溴发生反应的催化剂
C.(2)中产生的极少量气泡是由于镁粉与水反应得到
D.镁粉与溴水中的H+发生反应,导致平衡移动使溴水褪色
此题正确答案为B。多数学生选择了D答案。究其根源,主要是受到用平衡移动原理解释氯水变质这一问题的影响。学生只注意到了镁与溶液中H+的反应,而忽略了镁可以和溴反应这一事实,更没有注意到(2)中所述,“镁粉与溴水反应时,只是开始时产生极少量气泡,而溴水的颜色逐渐褪去”这一实验事实。这充分说明了学生没有深入地审题,受到了已有知识的干扰。能够举一反三固然是好事,但用类推方法得出的结论并不是任何时候都正确的。
【方法指导】
重大的发现可能就来自于平时的生活中,只要你勤于发现,勇于探究;在对所研究事物或现象的原因未知情况下,根据已有的认识,在观察和实验的基础上,通过对化学事实和现象的归纳、类比,作出判断性解释或说明,这就是化学中的假说;事实上,在化学发展史上,化学理论的形成和发展就是化学假说不断被提出、证实和证伪的过程。
四、探究性实验试题解题策略
探究性实验习题,充分体现了新课程理念,考查了学生通过化学实验获取化学知识的能力。在探究过程中要力求做到:
综上所述,在解决探究性试题的过程中,首先要明确实验目的和要求,然后结合问题运用有关化学知识和实验技能对实验的仪器、步骤、方法进行逐步分析研究。其中,有关方案的设计要特别明确:首先原理要具有科学性,不能凭空捏造。其次要有对照性,往往为了更能够说明问题,一定要有正反两个方面的实验,考虑到各种因素可能对实验有影响所以要控制变量,只能有一个因素是变量,其余几个是一样的,即遵循“定多变一”。最后实验装置要简易,操作必须安全可行,效果要明显。
(作者单位:河南省三门峡市第一高级中学472000)
G633.8
A
1992-7711(2016)11-0122
