双受体激动剂CI-1206拮抗Aβ1-42所致小鼠空间学习记忆损伤的作用*
2016-06-05杨菊张军原丽曲雪松祁金顺
杨菊,张军,原丽,曲雪松,祁金顺
双受体激动剂CI-1206拮抗Aβ1-42所致小鼠空间学习记忆损伤的作用*
杨菊,张军,原丽,曲雪松,祁金顺△
(山西医科大学生理学系,细胞生理学省部共建教育部重点实验室,太原030001)
目的:探讨葡萄糖依赖性促胰岛素释放激素(GIP)和胰高血糖素样肽1(GLP-1)双受体激动剂CI-1206拮抗淀粉样β蛋白(Aβ)所致小鼠空间工作记忆及长时程记忆损伤的作用。方法:C57小鼠经侧脑室注射Aβ1-42寡聚体建立AD动物模型,经腹腔注射CI-1206进行药物干预,随机分为对照组(saline+D-PBS)、Aβ1-42+saline、CI-1206+D-PBS、Aβ1-42+CI-1206组(n=12),而后联合应用Y-迷宫和Morris水迷宫行为学手段检测小鼠空间学习记忆。结果:①Aβ1-42+saline组小鼠在Y迷宫自发交替实验中进臂正确百分比明显低于对照组(P<0.05);Aβ1-42+CI-1206组则明显高于单独给予Aβ1-42组(P<0.05);②Morris水迷宫结果显示,与对照组相比,Aβ1-42+saline组的小鼠逃避潜伏期明显延长,目标象限游泳时间百分比降低(P<0.05),经CI-1206处理可明显改善(P<0.05);③Aβ1-42和CI-1206均不影响小鼠的运动能力和视力。结论:脑室注射Aβ影响小鼠短期工作记忆及长期空间学习记忆能力;腹腔注射CI-1206可拮抗Aβ1-42所致的短期和长期记忆损伤。
CI-1206;淀粉样β蛋白;Y迷宫;Morris水迷宫;空间学习记忆;小鼠
阿尔茨海默病(Alzheimer’s disease,AD)即老年性痴呆,是一种中枢神经系统的退行性疾病,其发病率随着人口老龄化的加速而逐年升高,严重影响老年人的寿命和生活质量。然而,目前仍缺乏有效的预防和治疗AD的方法或药物。在AD漫长的发病过程中,从轻度认知障碍(MCI),到晚期严重智力下降和痴呆[1],Aβ和磷酸化Tau蛋白都扮演着重要的角色,两者还可以引起其他病理表现如炎症、大脑基底树突减少、胆碱能神经元丢失和突触数量减少等[2,3]。流行病学调查显示,AD的发病与2型糖尿病之间有着密切关系[4,5]。研究发现,胰岛素和胰岛素受体(IR)广泛表达于大脑皮层、海马、下丘脑等中枢神经系统;胰岛素和IR异常不仅与糖尿病发病机制相关,也参与AD的诸多病理过程[6]。然而,胰岛素治疗AD并不是一种理想的选择。
近年来,治疗T2DM新药研究热点聚焦于肠促胰岛素(incretin)。肠促胰岛素是人体内的肠源性激素,主要包括胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)和葡萄糖依赖性促胰岛素释放激素(glucose-dependent insulinotropic,GIP)。GLP-1及其类似物具有诱导神经突生长、减轻Aβ导致的突触可塑性和认知行为损伤、减轻脑出血模型鼠的氧化应激和细胞凋亡等神经保护作用[7,8]。同样,GIP在改善海马突触可塑性、减轻脑内小胶质细胞的炎症反应、减轻小鼠空间参考记忆损伤等方面亦有着明显的保护效应[9,10]。CI-1206是一种新型的单分子双受体激动剂,其在体内可同时激活GLP-1和GIP受体,发挥良好的降血糖及促进胰岛素释放功能。CI-1206这种新型双受体激动剂的外周效应已被报道明显优于单受体激动剂的作用[11],但其是否能够拮抗Aβ的神经毒性作用,发挥中枢性的神经保护效应还不清楚。因此,本研究在制备侧脑室注射Aβ所致的小鼠学习记忆损伤动物模型基础上,通过外周慢性持续给予CI-1206,观察了CI-1206的神经保护效应。
1 材料与方法
1.1材料
1.1.1实验试剂Aβ1-42(Abcam,英国)依说明书分装,使用前经DMSO重悬后加入D-PBS到终浓度(2.25 mg/ml),37℃孵育36 h以形成Aβ1-42寡聚体。CI-1206由上海强耀生物科技有限公司合成,使用前用生理盐水溶解,终浓度为0.017 mg/ml。
1.1.2实验动物与分组实验选用健康雄性C57小鼠(军事医学科学院,北京),体重为(25±5)g。48只小鼠在温度为20℃~24℃、湿度为55%~60%、光照周期为12 h∶2 h和自由饮食的饲养环境下适应7 d后,随机分为四组:(1)对照组(saline+ D-PBS);(2)Aβ1-42+saline组;(3)CI-1206+DPBS组;(4)Aβ1-42+CI-1206组(n=12)。
1.2方法
1.2.1动物手术及侧脑室注射将小鼠用5%水合氯醛(0.007~0.008 ml/g,i.p.)麻醉后,固定于脑立体定位仪(Neurostar,德国)上。根据小鼠脑图谱(Paxinos and Waton)给予侧脑室(前囟后0.5 mm,旁开1.1 mm,深度1.5 mm)注射Aβ1-42(Abcam,2 nmol/4μl,1μl/min)或等体积的vehicle(DPBS)。术后第2天,腹腔注射CI-1206(25 nmol/kg/ day)或等体积saline 21 d直至行为学实验结束。
1.2.2 Y迷宫实验腹腔给药21 d后,首先进行Y迷宫行为学自发交替实验。Y迷宫由三个完全相同的臂组成,三臂互为120度角,呈三等分辐射状。Y迷宫自发交替实验是一种常用的检测啮齿类动物短时程空间工作记忆的测试手段。实验时,将小鼠放在三个臂的交汇点,让小鼠自由进出三个臂,主要记录指标包括:8 min内小鼠进入各臂的顺序和进入各臂的总次数。小鼠四肢全部进入一臂后记为进入该臂,否则视为未进臂。以连续进入三个不同的臂为一次正确交替反应,记录为正确交替次数,进臂正确率(=正确交替次数/(进臂总次数-2)×100%)反应小鼠的工作记忆能力。在每一只鼠实验结束后下一只鼠放入迷宫之前,用75%酒精棉球擦拭装置,减少气味对实验的干扰。所有小鼠的自发活动由宫体上方的摄像头及记录软件(SMART,Panlab Harward Apparatus,Bioscience Company,Holliston,MA,USA)记录。
1.2.3 Morris水迷宫实验Morris水迷宫实验是用于检测大小鼠长时程空间参考记忆的一种经典手段。水迷宫由直径为110 cm、深度为60 cm的不锈钢水池作为宫体,内壁涂成白色。实验前将水池充满自来水,实验时,加入钛白粉使得直径约15 cm的水下平台(水面下1.5 cm)不可见,水温维持在25℃±2℃。所有小鼠活动由宫体上方摄像头及记录软件(Ethovision 3.0,Noldus Information Technology,Wageningen,荷兰)记录。Morris水迷宫实验测试分3部分进行:定位航行实验、空间探索实验和可视平台实验。主要观察指标为:小鼠逃避潜伏期和游泳距离、小鼠在目标象限(即平台所在象限)内游泳的时间和距离占总时间和总距离的百分比、小鼠游泳速度以及小鼠寻找可视平台的潜伏期。实验共6 d,前5天为空间定位航行实验,检测小鼠在60 s内找到水下隐藏平台的学习能力,记录找到平台所需的逃避潜伏期。定位航行实验结束后第2天,即第6天,进行撤去水下平台后的空间探索实验,检测小鼠在目标象限(即原平台所在象限)游泳时间占全部游泳时间(60 s)的百分比,反映小鼠空间记忆能力。为了排除小鼠运动能力及视力障碍对实验结果造成的影响,空间探索实验6 h后进行可视平台实验。观察各组小鼠找到可视平台所需时间及小鼠平均游泳速度。
1.3统计学处理
所有数据以均数±标准差(珋x±s)表示,采用SPSS13.0软件统计分析及GraphPad Prism软件作图,结果进行析因分析。
2 结果
2.1慢性腹腔注射CI-1206逆转了Aβ1-42所致的小鼠空间工作记忆损伤
单独给予Aβ1-42(Aβ1-42+saline)的小鼠在Y-迷宫自发交替实验中的进臂正确率(60.25± 2.31)%明显低于对照组小鼠(saline+D-PBS)(70.75±2.17)%(P<0.01),;而Aβ1-42联合腹腔慢性持续注射CI-1206组小鼠(Aβ1-42+CI-1206)的进臂正确率(68.75±1.90)%明显高于单独给予Aβ1-42组小鼠(60.25±2.31)%(P<0.01,图1A)。此外四组小鼠总进臂次数无明显统计学差异(图1B)。
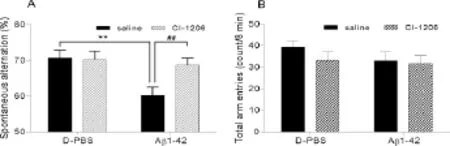
Fig.1 Effects of Aβ1-42 and CI-1206 on spatial working memory of mice in Y maze(珋x±s,n=12)
2.2慢性腹腔注射CI-1206逆转Aβ1-42所致的小鼠空间参考记忆损伤
Y迷宫测试后第2天,对同一批小鼠进行Morris水迷宫实验。在连续5 d的定位航行实验中,各组小鼠找到水下平台的逃避潜伏期均逐渐缩短,但Aβ1-42单独处理组小鼠逃避潜伏期明显高于其他组小鼠,在训练的第2~5天与对照组比较,具有明显统计学差异(P<0.01)。经CI-1206慢性治疗后,小鼠逃避潜伏期明显缩短(P<0.01,图2A)。第6天空间探索实验中,水下平台被撤除,Aβ1-42单独处理组小鼠与对照组小鼠在目标象限中游泳时间占总时间的百分比有明显统计学差异,分别为33.81%±2.07%和24.39%±2.67%(P<0.01);同时,CI-1206慢性给药治疗组在目标象限游泳的时间百分比则明显高于单独给予Aβ1-42组,由24.39% ±2.67%增加到33.60%±2.85%(P<0.01,图2 B)。Aβ1-42处理的小鼠在原来的目标象限(第I象限)中游泳距离明显较对照组减少;而经CI-1206处理后的小鼠(Aβ1-42+CI-1206)游泳距离明显较单独Aβ1-42组增加(图2C)。
2.3Aβ1-42和CI-1206不影响小鼠在水迷宫中的运动能力和视力
四组小鼠的平均游泳速度(图3A)以及找到可视平台所需时间(图3 B)均无明显统计学差异。
3 讨论

Fig.2 CI-1206 antagonized Aβ1-42-induced impairment of spatial reference memory in MWM test(珋x±s,n=12)
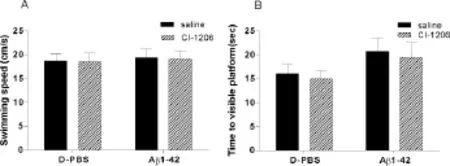
Fig.3 CI-1206 and Aβ1-42 did not affect the motor ability and vision of mice
海马是脑内与学习记忆密切相关的脑区,其功能正常与否不仅影响短时程的工作记忆,也伤害长时程学习记忆[12]。AD患者脑内出现病理特征最明显的部位之一正是在海马,其海马内突触数量减少、神经元丢失所致的海马萎缩已有报道。海马结构和功能改变的原因,除了细胞内过度磷酸化Tau蛋白外,海马存在的大量淀粉样β蛋白(Aβ)的沉积也是重要的因素[13]。目前,AD发病机制的Aβ学说已被广泛认可。Aβ是由淀粉样蛋白前体蛋白(APP)经分泌酶剪切后形成的片段,由36~43个氨基酸组成,主要片段为Aβ1-40和Aβ1-42[14]。Aβ各种片段均具有明显的神经毒性作用,包括Aβ1-40、Aβ1-42、Aβ25-35甚至更小片段的Aβ31-35[15,16],而Aβ1-42特别是其寡聚体形式被认为神经毒性最强。
本研究在证实脑内注射Aβ1-42寡聚体可以损伤小鼠空间工作记忆以及空间参考记忆的基础上,发现这些损伤效应可被双受体激动剂CI-1206所拮抗。经慢性持续21 d的腹腔注射CI-1206治疗后,Aβ1-42所致的两种学习记忆损伤指标均有改善。这一结果,为AD临床治疗特别是患有糖尿病或血糖增高的AD患者提供了一种可能的预防和治疗策略。近年来,糖尿病与AD的紧密联系已受到广泛关注,2型糖尿病被认为是AD的危险因素之一,将治疗2型糖尿病的药物用于AD治疗或将成为一个研究热点。CI-1206是一种新型的单分子双受体激动剂,在体内可同时激活GLP-1及GIP受体,且其在发挥降糖及促进胰岛素释放等代谢性功能时明显效力优于GLP-1或GIP单受体激动剂。与此同时,CI-1206还可降低单次给药剂量,从而改善GLP-1导致的恶心等副作用。除此之外,CI-1206经过合理改造,克服了GLP-1或GIP一经释放即被体内DDPIV降解的作用,从而大大延长了药物半衰期[11],在C57小鼠体内,4 h达到血药浓度峰值,半衰期长达12 h,远大于GLP-1或GIP的几分钟[17]。并且,已有不少报道指出,经过改造后的CI-1206,脂溶性增强,更容易通过血脑屏障[18,19]。这些研究结果为本实验外周给药发挥中枢保护效应提供了良好的理论基础,我们的结果也间接证实了这一观点。目前,还未见有关CI-1206用于AD患者或AD转基因小鼠的研究报道,本研究在Aβ1-42所致AD样损伤的基础上观察到的CI-1206神经保护效应还应当深入研究。至于CI-1206对Aβ1-42损伤小鼠学习的保护作用机制,除了激动脑内神经元细胞膜上的GLP-1及GIP受体外,还有哪些细胞内信号转导通路参与,尚有待进一步研究。
[1]Talbot K,Wang HY.The nature,significance,and glucagon-like peptide-1 analog treatment of brain insulin resistance in Alzheimer's disease[J].Alzheimers Dement,2014,10(1 Suppl):S12-25.
[2]Heppner FL,Ransohoff RM,Becher B.Immune attack: the role of inflammation in Alzheimer disease[J].Nat Rev Neurosci,2015,16(6):358-372.
[3]Fraller DB.State of the science:use of biomarkers and imaging in diagnosis and management of Alzheimer disease[J].J Neurosci Nurs,2013,45(2):63-70.
[4]Janson J,Laedtke T,Parisi JE,et al.Increased risk of type 2 diabetes in Alzheimer disease[J].Diabetes,2004,53(2):474-481.
[5]Haan MN.Therapy insight:type 2 diabetes mellitus and the risk of late-onset Alzheimer's disease[J].Nat Clin Pract Neurol,2006,2(3):159-166.
[6]Gault VA,Porter WD,Flatt PR,et al.Actions of exendin-4 therapy on cognitive function and hippocampal synaptic plasticity in mice fed a high-fat diet.[J].Int J Obes(Lond),2010,34(8):1341-1344.
[7]Mc Clean PL,Gault VA,Harriott P,et al.Glucagonlike peptide-1 analogues enhance synaptic plasticity in the brain:a link between diabetes and Alzheimer's disease[J].Eur J Pharmacol,2010,630(1-3):158-162.
[8]Calsolaro V,Edison P.Novel GLP-1(Glucagon-Like Peptide-1)analogues and insulin in the treatment for Alzheimer's disease and other neurodegenerative diseases[J].CNS Drugs,2015,29(12):1023-1039.
[9]Duffy AM,Hlscher C.The incretin analogue D-Ala2GIP reduces plaque load,astrogliosis and oxidative stress in an APP/PS1 mouse model of Alzheimer's disease[J].Neuroscience,2013,228:294-300.
[10]Yu YW,Hsieh TH,Chen KY,et al.Glucose-dependent insulinotropic polypeptide ameliorates mild traumatic brain injury-induced cognitive and sensorimotor deficits and neuroinflammation in rats[J].J Neurotrauma,2016.
[11]Finan B,Ma T,Ottaway N,et al.Unimolecular dual incretins maximize metabolic benefits in rodents,monkeys,and humans.[J].Sci Transl Med,2013,5(209): 209ra151.
[12]李清山,杨威,潘艳芳,等.脑源性神经营养因子拮抗β淀粉样蛋白所致大鼠在体海马长时程增强的伤害[J].中国应用生理学杂志,2012,28(5):425-429.
[13]郝明,仝嘉庆,张军,等.雷帕霉素对淀粉样β蛋白所致大鼠工作记忆和突触可塑性损伤的作用观察[J].中国应用生理学杂志,2016,32(1):18-21.
[14]Obregon D,Hou H,Deng J,et al.Soluble amyloid precursor protein-alpha modulates beta-secretase activity and amyloid-beta generation[J].Nat Commun,2012,3: 777.
[15]Wang XH,Li L,Holscher C,et al.Val8-glucagon-like peptide-1 protects against Abeta1-40-induced impairment of hippocampal late-phase long-term potentiation and spatial learning in rats[J].Neuroscience,2010,170(4): 1239-1248.
[16]Tong JQ,Zhang J,Hao M,et al.Leptin attenuates the detrimental effects of beta-amyloid on spatial memory and hippocampal later-phase long term potentiation in rats[J].Horm Behav,2015,73:125-130.
[17]Finan B,Yang B,Ottaway N,et al.A rationally designed monomeric peptide triagonist corrects obesity and diabetes in rodents[J].Nat Med,2015,21(1):27-36.
[18]Kastin A,Akerstrom V.Entry of exendin-4 into brain is rapid but may be limited at high doses[J].Int J Obes Relat Metab Disord,2003,27(3):313-318.
[19]McClean PL,Hlscher C.Lixisenatide,a drug developed to treat type 2 diabetes,shows neuroprotective effects in a mouse model of Alzheimer's disease[J].Neuropharmacology,2014,86:241-258.
Dual co-agonist CI-1206 antagonizes Aβ1-42-induced impairments in spatial learning and memory in mice
YANG Ju,ZHANG Jun,YUAN Li,QU Xue-song,QI Jin-shun△
(Department of Physiology,Shanxi Medical University,Taiyuan 030001,China)
Objective:To study the neuroprotective effects of a novel GIP/GLP-1 receptor dual agonist CI-1206 against Aβ1-42-induced impairments in spatial working memory and long term memory in mice.Methods:C57 mice,after receiving intracerebralventricular(i.c.v.)injection of Aβ1-42 and intraperitoneal injection of CI-1206,were divided into the following groups:saline+D-PBS,Aβ1-42+saline,CI-1206+D-PBS and Aβ1-42+CI-1206 group(n=12).Y maze spontaneous alternation of mice was tested to assess short term working memory,and Morris water maze task was used to assess long term reference memory.Results:①The percentage of right alternation of mice in Aβ1-42+saline group was significantly decreased,while the percentage in Aβ1-42+CI-1206 group was significantly larger than that in Aβ1-42 alone group(P<0.05).②In Morris water maze test,the escape latency of mice in Aβ1-42+saline group showed a significant increase,with a significant decline in swimming time in target quadrant.Treatment with CI-1206 significantly antagonized these detrimental effects induced by Aβ1-42.③Aβ1-42 and CI-1206 did not affect the motor ability and vision of mice.Conclusion:I.C.V.administration of Aβ1-42 impaired the short term and long term spatial memory of mice,while CI-1206 could effectively antagonize the detrimental effects.
CI-1206;Amyloidβprotein;Y-maze;Morris water maze;spatial learning and memory;mouse
R338
A
1000-6834(2016)06-567-04
10.13459/j.cnki.cjap.2016.06.018
2016-01-27
2016-07-14
△【通讯作者】Tel:0351-4135091;E-mail:jinshunqi2009@163.com
猜你喜欢
杂志排行
中国应用生理学杂志的其它文章
- 当归黄芪提取物对慢性腹膜功能衰竭大鼠腹膜功能、结构及TGF-β1表达的影响*
- 阿霉素损伤心肌细胞miRNA378与网腔钙结合蛋白、内质网应激的关系*
- 5-HT1B受体亚型对小脑顶核介导的运动行为的影响*
- Changes of microcirculation in healthy volunteers and patients with septic shock in Xining
- Effect of creatine phosphate sodium on miRNA378, miRNA378* and calumenin mRNA in adriamycin-injured cardiomyocytes
- The infl uence of heterogeneity on the analysis of sleep-wake architecture in the single-prolonged stress rats
