秦川牛SIRT3基因SNPs检测及其与体尺和肉质性状的关联分析
2016-06-03邓冠群昝林森王洪宝桂林生
邓冠群,昝林森,2,王洪宝,桂林生
(1 西北农林科技大学 动物科技学院,陕西 杨凌 712100;2 国家肉牛改良中心,陕西 杨凌 712100)
秦川牛SIRT3基因SNPs检测及其与体尺和肉质性状的关联分析
邓冠群1,昝林森1,2,王洪宝1,桂林生1
(1 西北农林科技大学 动物科技学院,陕西 杨凌 712100;2 国家肉牛改良中心,陕西 杨凌 712100)
[摘要]【目的】 研究秦川牛SIRT3基因的多态性及其对秦川牛体尺、肉用性状的影响,以探索改善秦川牛体尺、肉用性状的分子育种方法。【方法】 随机选择相近饲喂条件下468头18~24月龄健康秦川母牛,采用DNA直接测序技术进行SIRT3基因全区域遗传变异检测。运用SPSS16.0软件中最小二乘法拟合线性模型,对SIRT3基因不同基因型与秦川牛体尺(体斜长、体高、腰高、尻长、腰角宽、胸深、胸围和坐骨端宽)和肉质性状(背膘厚、眼肌面积和肌肉脂肪含量)进行关联分析。【结果】 经DNA测序发现,秦川牛SIRT3基因在第4内含子上存在2个突变位点,分别为C22522T突变和C22680G突变,均存在3种基因型。χ2检验表明,C22522T和C22680G位点均处于Hardy-Weinberg极度不平衡状态(P<0.01)。关联性分析表明,秦川牛SIRT3基因2个突变位点的不同基因型与体斜长、体高、尻长、腰角宽、胸深、胸围和背膘厚、眼肌面积、肌肉脂肪含量有显著或极显著相关关系。【结论】 SIRT3基因对秦川牛部分体尺、肉质性状有显著的影响,可以尝试作为秦川肉牛新品系培育的主要候选基因。
[关键词]秦川牛;SIRT3基因;SNPs;体尺性状;肉质性状
Sirtuins是一类高度保守的烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD+)依赖的去乙酰化酶,可调节如寿命和代谢等生物学功能[1]。研究表明,Sirtuins在进化过程中高度保守,自细菌到人类的生物机体内均存在其同源体,其家族包含7个细胞定位和靶蛋白各不相同的成员(SIRT1~SIRT7),其中,SIRT1和SIRT2定位于细胞质和细胞核中,SIRT3、SIRT6和SIRT7定位于线粒体基质中,而SIRT4和SIRT5则定位于线粒体中,该基因家族各成员参与基因沉默、DNA双链断裂修复、组蛋白去乙酰化、细胞周期调节和抗衰老等生理生化过程[2]。
众所周知,线粒体是细胞能量代谢最重要的细胞器,在细胞代谢、能量产生、细胞凋亡和胞内信号转导等生理过程中发挥着重要的作用。作为Sirtuins家族重要的成员之一,SIRT3定位于线粒体基质中,通对多种细胞因子去乙酰化作用,进而调控机体的能量代谢[3]。敲除SIRT3基因会导致机体的线粒体过度乙酰化,造成细胞能量代谢及有丝分裂过程发生异常。乙酰辅酶A合成酶2 (AceCS2)是SIRT3基因的重要底物,对其去乙酰化作用后,机体的三羧酸循环产能进程受到影响[4],这说明SIRT3在ATP的生成中发挥着重要的调控作用。此外,SIRT3基因通过作用于过氧化物酶体增殖子激活受体(PGC1-α),能间接促进线粒体生物合成和脂肪酸氧化代谢[5]。白藜芦醇作为一种有效的抗氧化剂,可以调控线粒体活性并上调SIRT3基因的表达量,而SIRT3被证实能够抑制3T3-L1脂肪细胞的脂肪形成并且能改变脂肪量[6]。以上研究表明,SIRT3通过在线粒体中发挥一系列作用,可调控机体的能量和脂质代谢。
但目前有关SIRT3基因多态性的研究尚未见报道。鉴于SIRT3基因在机体能量代谢过程中的重要调控机制,本研究将该基因作为影响秦川牛肉用性状的一个候选基因,研究其多态性与秦川牛生长及肉质性状间的多态性效应,为加快秦川牛肉用性状的改善提供理论依据。
1材料与方法
1.1材料
1.1.1血样的采集从陕西省秦川肉牛良种繁育中心、陕西省农牧良种场和西北农林科技大学国家肉牛改良中心良种繁育场随机选择饲喂条件相近的18~24月龄健康秦川母牛468头,颈静脉采血10 mL/头,ACD抗凝(V(ACD)∶V(血液)=1∶6),轻微振荡混匀后-80 ℃保存备用。
1.1.2主要试剂和仪器蛋白酶K购自德国默克公司;EDTA、Tris饱和酚、Tris、N,N’-亚甲基双丙烯酰胺(Bis)、硼酸、二甲基亚砜(DMSO)、N,N,N,N’-四甲基乙二胺(TEMED)、含染料Reaction MIX、DNA Marker、甲醛、琼脂糖等,均购自天根生化科技(北京)有限公司;十二烷基磺酸钠(SDS)、去离子甲酰胺,均购自北京鼎国昌盛生物科技有限公司。
凝胶成像系统(Bio-Rad公司,美国),PCR仪(Bio-Rad公司,美国),冷冻高速离心机(CENTURION,英国),电泳槽、稳流稳压电泳仪(北京市六一仪器厂,北京),恒温培养箱(上海精宏实验设备有限公司,上海)。
1.2秦川牛体尺指标及肉质指标的测定
实地测量秦川牛体斜长、体高、腰高、尻长、腰角宽、胸深、胸围和坐骨端宽等体尺指标,并使用兽用B超仪活体测定相应个体的背膘厚、眼肌面积和肌间脂肪含量等肉质指标。
1.3秦川牛基因组DNA的制备
采用传统的酚氯仿抽取法提取牛的血样基因组DNA[7],用TE缓冲液溶解后,用0.5%琼脂糖凝胶电泳检测其纯度,同时用紫外分光光度计测定其质量浓度并调整到50 ng/μL,-80 ℃保存备用。
1.4秦川牛SIRT3基因的序列分析
1.4.1引物的设计与合成参考GenBank中提供的牛SIRT3基因序列(GenBank登录号:NM_001206669.1),利用 Primer 5.0 软件设计编码区引物,引物由上海生工生物工程技术服务有限公司合成,其相关信息见表1。

表 1 秦川牛SIRT3基因突变区域引物信息
1.4.2SIRT3基因的PCR扩增PCR反应体系为15 μL:0.5 UTaqDNA聚合酶(含0.20 mg dNTPs),2.5 mmol/L MgCl2的Mix 7.5 μL,DNA(50 ng/μL)1.0 μL,5 μmol/L混合引物(上、下游引物浓度均为10 pmol/μL)0.6 μL,ddH2O 5.9 μL。PCR反应程序:95 ℃预变性5 min;94 ℃ 30 s,60.9 ℃ 退火30 s,72 ℃ 35 s,37个循环;72 ℃延伸10 min,4 ℃保存。PCR扩增产物用1.5%琼脂糖凝胶以5 V/cm电泳20 min检测。引物序列、扩增产物长度、退火温度和位置见表1。
1.4.3PCR产物纯化与测序随机选取8个DNA样本构建DNA池进行PCR扩增,PCR产物使用凝胶回收试剂盒回收纯化,并送上海生工生物工程技术服务有限公司进行测序。使用SeqMan (5.2) 软件对测序结果进行比对以寻找突变位点,结果显示,第4内含子上存在2个突变位点,分别是22 522位核苷酸C→T的突变和22 680位核苷酸C→G的突变,由于在这2个突变位点上未发现合适的酶切位点,且SSCP方法复杂等原因,本试验468个样本采用直接测序法分析,测序公司为上海生工生物工程技术服务有限公司。
1.5数据统计分析

Yij=μ+Gi+Fj+eij。
式中:Yij为个体表型值,μ为群体均值,Gi为标记基因型效应,Fj为牧场种群效应,eij为随机误差。
2结果与分析
2.1秦川牛SIRT3基因的PCR扩增结果
图1显示,PCR扩增获得了307 bp的片段,长度与预期结果一致,且条带清晰、特异性好,可直接用于后期的DNA直接测序。

图 1 秦川牛SIRT3基因的PCR扩增部分结果
2.2秦川牛SIRT3基因的测序及序列分析
通过使用SeqMan(5.2)软件,对比分析秦川牛SIRT3基因的测序结果,发现了2个多态位点,均处于第4内含子,分别命名为C22522T(B1)和C22680G (B2)。分析发现,B1位点存在CC、CT和TT 3种基因型,B2位点存在CC、CG和GG 3种基因型(图2)。
2.3秦川牛SIRT3基因突变区域遗传多态性分析
从群体遗传学角度分析秦川牛SIRT3基因各突变位点的基因型频率、等位基因频率、遗传纯合度、遗传杂合度、有效等位基因数和多肽信息含量等遗传指标,结果(表2)显示,B1位点TT是优势基因型,T为优势等位基因,位点处于低度多态状态;B2位点CC是优势基因型,C为优势基因,位点处于中度多态状态。χ2检验表明,B1、B2处于Hardy-Weinberg极度不平衡状态(P<0.01)。

图 2 秦川牛SIRT3基因突变区域基因型突变序列比对
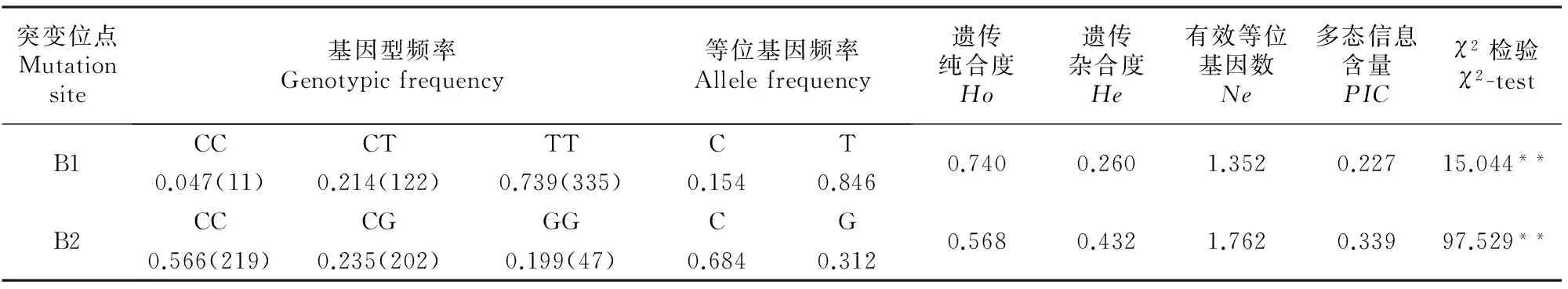
表 2 秦川牛SIRT3基因B1和B2位点突变的遗传多样性

2.4秦川牛SIRT3基因各突变位点不同基因型与体尺和肉质性状的关联分析
2.4.1秦川牛SIRT3基因各突变位点不同基因型与体尺性状的相关性由表3可知,B1位点不同基因型在体斜长、体高、尻长、腰角宽和胸深方面差异显著(P<0.05),胸围方面差异极显著(P<0.01),CC基因型个体均值显著高于TT基因型个体均值;而在其他体尺性状方面基本遵循CC基因型个体均值略高于TT基因型个体均值的趋势,但无统计学差异(P>0.05)。B2位点不同基因型在体高、尻长、腰角宽、胸深和胸围方面差异显著(P<0.05),体斜长方面差异极显著,CC基因型个体均值显著高于CG基因型个体均值;而在其他体尺性状方面遵循CC基因型个体均值略高于CG基因型个体均值的趋势,但无统计学差异(P>0.05)。关联性分析表明:秦川牛SIRT3基因不同突变位点的不同基因型个体与体斜长、体高、尻长、腰角宽、胸深和胸围显著相关(P<0.05)或极显著相关(P<0.01)。
2.4.2秦川牛SIRT3基因各突变位点不同基因型与肉质性状的相关性由表4可知,B1位点的TT基因型个体在背膘厚方面显著高于CC基因型个体(P<0.05),在肌间脂肪含量方面显著高于CT基因型个体(P<0.05),而在眼肌面积方面CC基因型个体均值略高于CT和TT基因型个体均值,但无统计学差异(P>0.05)。B2位点不同基因型在眼肌面积方面差异极显著(P<0.01),CC基因型个体平均值显著高于GG基因型个体平均值;而在背膘厚和肌间脂肪含量CC基因型个体均值略高于CG和GG基因型个体均值,但无统计学差异(P>0.05)。关联性分析表明:秦川牛SIRT3基因不同突变位点的不同基因型与背膘厚、眼肌面积和肌间脂肪含量显著相关(P<0.05)或极显著相关(P<0.01)。

表 3 秦川牛SIRT3基因各突变位点不同基因型与体尺性状的关联性分析
注:同列不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下同。
Note:Different lowercase letters mean significant difference (P<0.05);while different uppercase letters mean extremely significant difference(P<0.01).The same below.

表 4 秦川牛SIRT3基因各突变位点不同基因型与肉质性状的关联性分析
3讨论与结论
蛋白质组学研究显示,乙酰化在线粒体中是一种常见的翻译后修饰,大概有三分之一以上的蛋白质出现乙酰化,且参与代谢的蛋白质优先发生乙酰化[8-9]。作为最主要的一种NAD+依赖性的去乙酰化酶[10],SIRT3被证实可以与诸多底物结合,如LCAD、SOD2,GDH及OTC等[11-14],并调节其乙酰化水平,进而在动物主要的代谢途径(包括糖酵解、三羧酸循环、尿素循环、脂肪酸代谢以及糖原代谢)中发挥关键的调控作用[13]。基于此,笔者预测SIRT3基因可能在牛糖脂代谢过程中发挥重要的作用,进而影响其生长发育和肉质性状。作为本试验的研究对象,秦川牛以屠宰率高、肉用潜力较大、遗传稳定、耐粗饲和抗逆性强而著称,为我国五大黄牛品种之一。然而,相对于国外商业品种(如日本和牛)而言,秦川牛同样存在后躯不充实、载肉率和肌间脂肪含量低等缺陷[15]。因此,运用标记辅助选择(Marker assisted selection,MAS)方法对秦川牛育种效率进行改良和提高意义重大。
目前,针对SIRT3基因的研究主要集中在老鼠和人,尚未发现关于牛SIRT3基因多态分析的相关报道。本研究利用DNA直接测序技术,对秦川牛SIRT3基因全区域进行SNPs筛查,结果在第4内含子上发现2个突变位点,分别为C22522T和C22680G,关联性分析结果显示这2个突变均能够影响秦川牛生长发育和肉质性状。尽管这2个位点位于内含子区域,均不编码蛋白质序列,然而随着现在研究的不断深入,到目前为止,内含子的传统观念已被打破,越来越多的试验结果表明内含子可能在基因表达调控中发挥着重要的作用。研究发现,内含子突变够能影响附近的剪切供体和调节原件[16],进而导致基因编码蛋白发生改变[17]。目前诸多研究验证了这一结论。Mohr等[18]研究发现,牛的CSN1S1第4内含子剪切供体末端(+6)的一个碱基突变引起了前体mRNA加工过程中上游外显子的跳读,导致了奶牛αs1-casein A蛋白表达量的下降。高建斌等[19]发现,秦川牛DKK1基因的G523A位于第1内含子上,该位点突变对体高和尻长有显著的影响。本研究中,基于SIRT3基因检测到的2个突变位点对秦川牛部分生长及肉质形状的分析结果,推测可能是由于这2个突变导致了某些基因的表达水平或者调控机制发生了变化,具体作用机制有待进一步研究分析。
本试验研究结果表明,秦川牛SIRT3基因B1和B2位点均处于Hardy-Weinberg极度不平衡状态(P<0.01),可能是由于这2个突变基因型的个体在自然选择和人工选育过程中容易被淘汰,也可能是本试验样本量不足,导致杂合子过少所致。秦川牛虽然经过长期肉用选育,效果显著,但是其群体生长和生产性能还有待进一步提高。因此,加大选择强度是提高秦川牛生长和生产性能的必要手段。本研究秦川牛SIRT3基因各突变位点不同基因型与体尺和肉质性状的关联性分析结果表明,不同位点的不同基因型与体斜长、体高、腰角宽、尻长、胸深、胸围、背膘厚、眼肌面积和肌间脂肪含量显著 (P<0.05)或极显著相关(P<0.01)。由此推测,C22522T位点的等位基因T、C22680G位点的等位基因G都可能影响秦川牛的体尺和肉质性状指标,因此SIRT3基因可能是影响体斜长、体高、尻长、腰角宽、胸深和胸围等体尺性状,以及背膘厚、眼肌面积和肌间脂肪含量等肉质性状的主效QTL或与之紧密连锁。因此,SIRT3可考虑用于选育秦川肉牛新品种(系)标记辅助选择的主效候选基因。
秦川牛SIRT3基因2个SNPs对秦川牛体斜长、体高、尻长、腰角宽、胸深和胸围的体尺性状以及背膘厚、眼肌面积和肌肉脂肪含量的肉质性状均有不同程度的影响,可以尝试将其作为秦川肉牛新品系培育的主效候选基因或与主基因紧密连锁的分子标记。由于本试验样本量较少,且仅限于对秦川牛体尺和肉质性状的关联性分析,未与其他品种的牛进行比较,所以本研究结果还需要进一步验证分析,以便有效地提高选择准确性,更好地为秦川肉牛新品种的培育提供理论依据和技术支撑。
[参考文献]
[1]Shi T,Wang F,Stieren E,et al.SIRT3,a mitochondrialSIRT-uin deacetylase,regulates mitochondrial function and thermogenesis in brown adipocytes [J].Journal of Biological Chemistry,2005,280(14):13560-13567.
[2]Michan S,Sinclair D.Sirtuins in mammals:Insights into their biological function [J].Biochemical Journal,2007,404(1):1-13.
[3]Lombard D B,Alt F W,Cheng H L,et al.Mammalian Sir2 homologSIRT3 regulates global mitochondrial lysine acetylation [J].Molecular and Cellular Biology,2007,27(24):8807-8814.
[4]Jin L,Wei W,Jiang Y,et al.Crystal structures of humanSIRT3 displaying substrate-induced conformational changes [J].Journal of Biological Chemistry,2009,284(36):24394-24405.
[5]Sauve,Anthony A.Pharmaceutical strategies for activating sirtuins [J].Current Pharmaceutical Design,2009,15(1):45-56.
[6]Rayalam S,Yang J Y,Ambati S,et al.Resveratrol induces apoptosis and inhibits adipogenesis in 3T3-L1 adipocytes [J].Phytotherapy Research,2008,22(10):1367-1371.
[7]萨姆布鲁克J,拉塞尔 D W.分子克隆实验指南:上、下册 [M].黄培堂,译.北京:科学出版社,2002.
Sambrook J,Russell D W.Molecular cloning a laboratory manual:Upper and lower volumes [M].Huang P T,translated.Beijing:Science Press,2002.(in Chinese)
[8]Zhao S,Xu W,Jiang W,et al.Regulation of cellular metabolism by protein lysine acetylation [J].Science,2010,327(5968):1000-1004.
[9]Anderson K A,Hirschey M D.Mitochondrial protein acetylation regulates metabolism [J].Essays in Biochemistry,2012,52(1):23-35.
[10]Haigis M C,Guarente L P.Mammalian sirtuins-emerging roles in physiology,aging,and calorie restriction [J].Genes & Development,2006,20(21):2913-2921.
[11]Hirschey M D,Shimazu T,Goetzman E,et al.SIRT3 regulates mitochondrial fatty-acid oxidation by reversible enzyme deacetylation [J].Nature,2010,464(7285):121-125.
[12]Qiu X,Brown K,Hirschey M D,et al.Calorie restriction reduces oxidative stress bySIRT3-mediatedSOD2 activation [J].Cell Metabolism,2010,12(6):662-667.
[13]Rardin M J,Newman J C,Held J M,et al.Label-free quantitative proteomics of the lysine acetylome in mitochondria identifies substrates of SIRT3 in metabolic pathways [J].Proceedings of the National Academy of Sciences,2013,110(16):6601-6606.
[14]Hallows W C,Yu W,Smith B C,et al.Sirt3 promotes the urea cycle and fatty acid oxidation during dietary restriction [J].Molecular Cell,2011,41(2):139-149.
[15]王国庆.秦川牛SIX1和SIX4基因SNPs检测及其与体尺和肉质性状的关联分析 [D].陕西杨凌:西北农林科技大学,2014.
Wang G Q.The polymorphisms ofSIX1 andSIX4 and their association analysis with body measurements and meat quality traits of qinchuan cattle [D].Yangling,Shaanxi:Northwest A&F University,2014.(in Chinese)
[16]Barbosa-Morais N L,Irimia M,Pan Q,et al.The evolutionary landscape of alternative splicing in vertebrate species [J].Science,2012,338(6114):1587-1593.
[17]Xiong H Y,Alipanahi B,Lee L J,et al.The human splicing code reveals new insights into the genetic determinants of disease [J].Science,2015,347(6218):1254806.
[18]Mohr U,Koczan D,Linder D,et al.A single point mutation results in a allele-specific exon skipping in the bovine α s1-casein mRNA [J].Gene,1994,143(2):187-192.
[19]高建斌,昝林森,杨宁,等.秦川牛DKK1基因SNPs检测及其与体尺、肉质性状的关联分析 [J].畜牧兽医学报,2013,44(3):81-82.
Gao J B,Zan L S,Yang N,et al.Polymorphisms ofDKK1 gene and its association with body measurement and meat quality traits in Qinchuan cattle [J].Animal Husbandry and Veterinary Science,2013,44(3):81-82.(in Chinese)
Association ofSIRT3 gene polymorphism with body measurements and meat traits of Qinchuan cattle
DENG Guan-qun1,ZAN Lin-sen1,2,WANG Hong-bao1,GUI Lin-sheng1
(1CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2NationalBeefCattleImprovementCenterinChina,Yangling,Shaanxi712100,China)
Abstract:【Objective】 The study investigated the polymorphism of SIRT3 gene and the association with body measurements and meat traits of Qinchuan cattle to find molecular breeding methods for improving body measurements and meat traits of Qinchuan cattle.【Method】 In this study,468 Qinchuan heifers with the age of 18 to 24 months under similar feeding conditions were randomly selected.Direct DNA sequencing methods were used to detect the polymorphisms in SIRT3 gene.Least squares fitting linear model incorporated in SPSS16.0 program was used to analyze the relationship of genotype with body measurements and meat traits.【Result】 Two SNPs,C22522T and C22680G,were detected in SIRT3 gene.PCR-RFLP analysis showed that three genotypes were found in C22522T and C22680G,respectively.χ2 test showed C22522T and C22680G were in Hardy-Weinberg disequilibrium (P<0.01).The genotypes of different mutations in SIRT3 gene were found to be significantly related to body length,withers height,hip height,rump length,pin bone width and back-fat thickness,lion muscle area,and intramuscular fatty content.【Conclusion】 SNPs of the SIRT3 gene had significant effects on body measurements and meat traits of Qinchuan cattle.Thus,it could be used as a major candidate gene for new strain breeding of Qinchuan cattle.
Key words:Qinchuan cattle;SIRT3 gene;polymorphism;body measurement;meat trait
[文章编号]1671-9387(2016)01-0001-06
[中图分类号]S823.8+12
[文献标志码]A
[作者简介]邓冠群(1991-),男,湖南娄底人,硕士,主要从事动物生物技术研究。E-mail:dengguanqun.789@163.com[通信作者]昝林森(1963-),男,陕西扶风人,教授,博士,博士生导师,主要从事肉牛遗传改良与种质创新研究。E-mail:zanlinsen@163.com
[基金项目]“十二五”国家“863”计划项目(2013AA102505,2011AA100307-02);国家科技支撑计划项目(2011BAD2804-03);国家自然科学基金项目(31272411);国家转基因育种专项(2011ZX08007-002);国家肉牛牦牛产业技术体系项目(CARS-38);陕西省科技统筹创新工程计划项目(2011KTCL02-07)
[收稿日期]2014-05-09
DOI:网络出版时间:2015-12-0214:2510.13207/j.cnki.jnwafu.2016.01.001
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151202.1425.002.html
