家蚕肠道感染细菌后6种抗菌肽基因表达的变化
2016-06-03王延稳吕志强
王延稳,吕志强
(西北农林科技大学 植物保护学院,陕西 杨凌 712100)
家蚕肠道感染细菌后6种抗菌肽基因表达的变化
王延稳,吕志强
(西北农林科技大学 植物保护学院,陕西 杨凌 712100)
[摘要]【目的】 研究感染绿脓杆菌(Pseudomonas aeruginosa)和金黄色葡萄球菌(Staphyloccocus aureus)后,家蚕中肠和脂肪体中6种抗菌肽基因表达的变化,为家蚕肠道免疫研究提供一定的理论依据。【方法】 给家蚕喂食感染绿脓杆菌和金黄色葡萄球菌,以喂生理盐水为对照,利用半定量RT-PCR方法,检测感染不同时间(1,2,4,8,16,24 h)后中肠和脂肪体中6种抗菌肽基因表达的变化。【结果】 喂食绿脓杆菌1,2 h后,中肠中抗菌肽Gloverin2、Lebocin、CecropinB6、CecropinD和Moricin的相对表达量显著上调;喂食金黄色葡萄球菌1,2,4 h后,中肠中6种抗菌肽的相对表达量均显著上调。在脂肪体中,感染两种细菌后,仅抗菌肽CecropinD、Moricin和Attacin2相对表达量的变化较为显著。【结论】 家蚕在感染不同细菌后所诱导的免疫机制不同。细菌经由口器进入家蚕肠道,可同时引起上皮免疫反应和体液免疫反应。
[关键词]家蚕;细菌;抗菌肽基因;半定量RT-PCR
昆虫缺乏获得性免疫,主要依靠先天性免疫(Innate immunity)来抵御病原菌的入侵[1-2]。昆虫先天性免疫反应的效应机制与哺乳动物相似,都能刺激细胞产生吞噬作用,诱导抗菌肽基因的表达[3]。昆虫的先天性免疫反应包括:上表皮(角质层、气管、肠道)的阻碍和凝血,体液免疫——脂肪体中抗菌肽的产生,细胞免疫(血细胞吞噬微生物和包囊较大病原物)。此外,昆虫的防御机制还包括黑化作用及附带产生的凝固、伤口愈合和包囊[4-7]等现象。无脊椎动物的上皮细胞是构成先天性免疫的第一道防线,其主要免疫反应是产生抗菌肽[8-9]。有关昆虫上皮免疫的研究主要集中于肠道上皮细胞免疫方面,昆虫的肠道分为:前肠、中肠和后肠。中肠由内胚层发育而来,没有角质层覆盖,由上皮层及紧邻的围食膜构成,围食膜将中肠上皮层细胞和中肠腔隔开[10]。人们对昆虫肠道的解剖结构有较为细致的了解,但对其在免疫中的作用所知有限,由于中肠结构的特殊性,针对昆虫肠道免疫反应的研究主要集中于中肠免疫反应方面[9,11-14]。
昆虫肠道中可诱导的防御机制包括两个方面:一是局部抗菌肽(AMP)的产生;二是活性氧(Reactive Oxygen Species,ROS)的产生[15]。其中抗菌肽的产生发挥着举足轻重的作用,昆虫被感染后,其体内能快速产生抗菌肽以抵御微生物的侵染[5]。昆虫抗菌肽具有分子质量小、水溶性好、热稳定性强、抗菌谱广、强碱性和无免疫原性等特点,其对各种病原物如细菌、真菌、病毒及病原虫均具有杀伤作用,且作用机制独特,不会损害和破坏高等动物的正常细胞[16]。目前已知的家蚕抗菌肽基因有40个,按照它们之间序列的相似性可以分为Cecropin、Moricin、Gloverin、Attacin、Enbocin、Lebocin和Defensin 7个家族[17-23]。
昆虫昆虫取食时,微生物会与食物一起经由口器进入肠道中,导致肠道上皮细胞接触到大量的微生物,从而引发感染。家蚕作为鳞翅目的模式昆虫,研究感染后家蚕体内抗菌肽的表达规律具有重要意义。本试验通过给家蚕喂食绿脓杆菌(Pseudomonasaeruginosa)和金黄色葡萄球菌(Staphyloccocusaureus),来检测感染不同时间后家蚕中肠和脂肪体中抗菌肽基因相对表达量的变化,以期初步了解蚕的肠道免疫机制,为鳞翅目昆虫的肠道免疫研究提供一定的理论基础。
1材料与方法
1.1供试昆虫
供试家蚕为Nastari品系,蚕卵由中国科学院上海植物生理与生态研究所的凌尔军教授提供。在人工气候箱中孵育,饲养条件为:温度26 ℃,光照周期12L/12D,相对湿度85%,孵化后开始喂食新鲜桑叶至4龄末期,幼虫进入5龄改喂人工饲料。
1.2细菌菌株
革兰氏阴性菌:绿脓杆菌(Pseudomonasaeruginosa),革兰氏阳性菌:金黄色葡萄球菌(Staphyloccocusaureus)。
1.3主要仪器和试剂
主要仪器:人工气候箱RXZ型(宁波江南仪器厂)、UNIQUE-E20 Unique多功能超纯水仪(Reserch公司)、Hitachi CF16RXⅡ离心机(日立公司)、Bioer Life Pro PCR仪(Harlow Scientific公司)、电泳槽(天能公司)、UVP凝胶成像系统(UVP公司)。
主要试剂:RNase Zap (Ambion公司)、Direct-zolTMRNA Mini Prep试剂盒(ZYMO RESEARCH公司)、M-MLV Reverse Transcriptase试剂盒(Invitrogen公司)、Platinum®Taq DNA Polymerase(Invitrogen公司)。
1.4方法
1.4.1家蚕喂食感染及组织提取选取5龄第2天的家蚕饥饿处理24 h,然后每头喂食添加50 μg四环素(Tetracycline)的5 mm3人工饲料,以去除家蚕体内的细菌。喂食抗生素24 h后,分别将灭菌的生理盐水(对照)、绿脓杆菌和金黄色葡萄球菌添加到5 mm3人工饲料中,每个时间点每处理各喂食10头家蚕。在家蚕取食1,2,4,8,16,24 h后,分别将3个处理家蚕置于冰上冷冻20 min。用体积分数70%的酒精擦拭解剖工具、清洁虫体表面,将家蚕表皮剪开,去除围食膜及食物后取其中肠,并用经DEPC处理的无菌水清洗,保存于3 mL Trizol中,然后用镊子刮取脂肪体,保存于2 mL Trizol中,均置于-80 ℃保存备用。
试验采用活菌感染,试验操作过程中需带手套,试验前后及时用酒精消毒,必要时在超净工作台操作,试验结束后将剩余活菌用84消毒液灭活,防止其对环境造成污染。
1.4.2总RNA提取及cDNA合成将保存在Trizol中的中肠和脂肪体组织分别通过匀浆器研磨均匀,使用Trizol提取总RNA。将得到的总RNA用Direct-zolTMRNA Mini Prep试剂盒纯化。取1 μL纯化好的RNA,用M-MLV Reverse Transcriptase试剂盒合成cDNA,并稀释至10 ng/μL备用。
1.4.3半定量RT-PCR检测本试验用于扩增6种抗菌肽基因Gloverin2、Lebocin、CecropinB6、CecropinD、Moricin和Attacin2的引物如表1所示,以RP49作为内参基因。半定量RT-PCR反应体系为:10×PCR buffer 5 μL,10 mmol/L dNTPmix 1 μL,50 mmol/L MgCl25 μL,F-Primer 1 μL,R-Primer 1 μL,Platinum®Taq DNA聚合酶 0.2 μL,ddH2O 31.8 μL,cDNA 5 μL。反应条件为:94 ℃预变性3 min;94 ℃变性30 s,52 ℃退火45 s,72 ℃延伸1 min,进行35个循环;72 ℃补偿延伸5 min。PCR产物用1.5%琼脂糖凝胶电泳进行检测。

表 1 本试验所用的半定量RT-PCR引物
1.4.4数据处理用Launch VisionWorksLS软件分析半定量RT-PCR的结果,得出6种抗菌肽基因的相对表达量,然后用GraphPad Prism 5软件分析其随感染时间的变化趋势,通过t检验分析各组间的差异显著性。
2结果与分析
2.1喂食细菌对家蚕Gloverin2相对表达量的影响
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕中肠中Gloverin2相对表达量的变化如图1-A所示。从图1-A可以看出,与对照相比,喂食绿脓杆菌和金黄色葡萄球菌1,2,4 h后,Gloverin2相对表达量均显著上调,且喂食金黄色葡萄球菌后Gloverin2相对表达量均较高,感染细菌1 h后Gloverin2相对表达量均达到最高。与对照相比,喂食绿脓杆菌24 h后Gloverin2相对表达量显著下调。
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕脂肪体中Gloverin2相对表达量的变化如 图1-B 所示。从图1-B可以看出,与对照相比,喂食绿脓杆菌和金黄色葡萄球菌后Gloverin2相对表达量没有显著变化。

图 1 喂食不同细菌后家蚕中肠(A)和脂肪体(B)中Gloverin2基因的相对表达量
2.2喂食细菌对家蚕Lebocin相对表达量的影响
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕中肠中Lebocin相对表达量的变化如图2-A所示。从图2-A可以看出,与对照相比,喂食绿脓杆菌和金黄色葡萄球菌1,2,4 h后Lebocin相对表达量均显著上调,且喂食金黄色葡萄球菌后Lebocin相对表达量均较高,感染细菌2 h后Lebocin相对表达量均达到最高,喂食绿脓杆菌24 h后Lebocin相对表达量显著下调。
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕脂肪体中Lebocin相对表达量的变化如图2-B所示。从图2-B可以看出,与对照相比,喂食绿脓杆菌和金黄色葡萄球菌后Lebocin相对表达量没有显著变化。

图 2 喂食不同细菌后家蚕中肠(A)和脂肪体(B)中Lebocin基因的相对表达量
2.3喂食细菌对家蚕CecropinB6相对表达量的影响
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕中肠中CecropinB6相对表达量的变化如 图3-A 所示。从图3-A可以看出,与对照相比,喂食绿脓杆菌1,2,16 h后CecropinB6相对表达量显著上调,且2 h后相对表达量最高;喂食金黄色葡萄球菌1,2,4 h后CecropinB6相对表达量显著上调,且4 h后相对表达量最高。与感染绿脓杆菌相比,感染金黄色葡萄球菌1,2,4 h后CecropinB6相对表达量均较高。
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕脂肪体中CecropinB6相对表达量的变化如图3-B所示。从图3-B可以看出,喂食绿脓杆菌和金黄色葡萄球菌后CecropinB6相对表达量没有显著变化。

图 3 喂食不同细菌后家蚕中肠(A)和脂肪体(B)中CecropinB6基因的相对表达量
2.4喂食细菌对家蚕CecropinD相对表达量的影响
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕中肠中CecropinD相对表达量的变化如图4-A所示。从图4-A可以看出,与对照相比,喂食绿脓杆菌1,2 h后CecropinD相对表达量显著上调;喂食金黄色葡萄球菌1,2,4 h后CecropinD相对表达量显著上调,且4 h后CecropinD相对表达量最高。与感染绿脓杆菌相比,感染金黄色葡萄球菌1,2,4 h后CecropinD相对表达量均较高。
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕脂肪体中CecropinD相对表达量的变化如图4-B所示。从图4-B可以看出,与对照相比,喂食绿脓杆菌2,4,24 h后CecropinD相对表达量显著上调,8 h后CecropinD相对表达量显著下调;喂食金黄色葡萄球菌2,4,16,24 h后CecropinD相对表达量显著上调,8 h后CecropinD相对表达量显著下调。
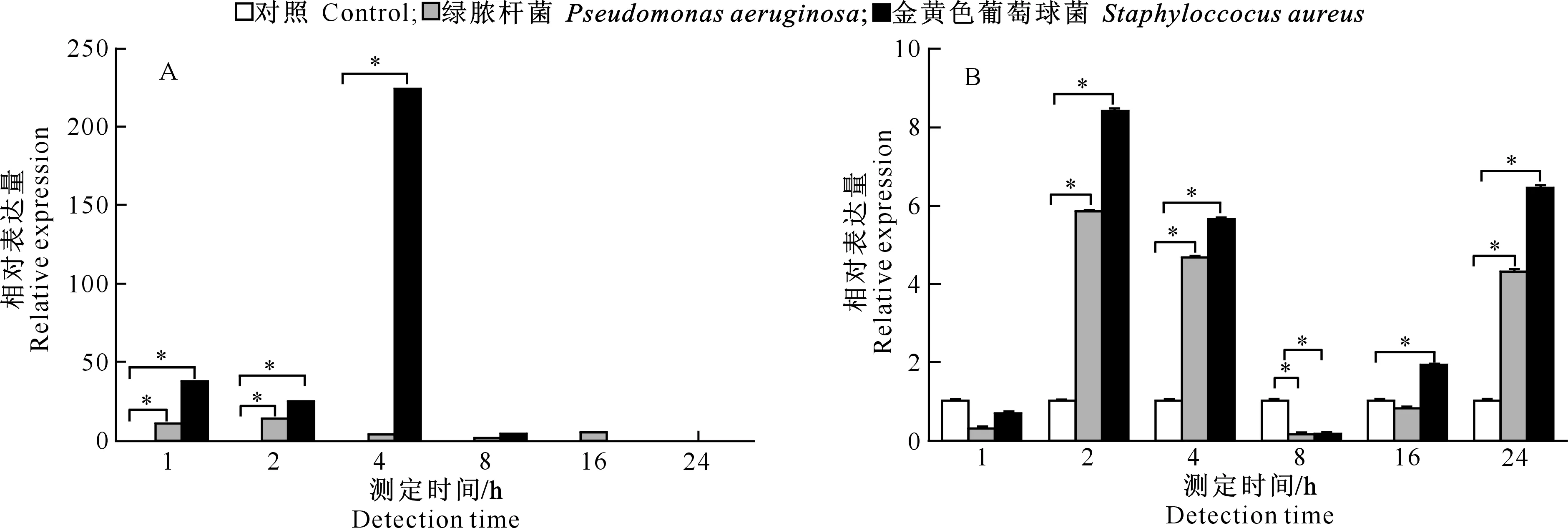
图 4 喂食不同细菌后家蚕中肠(A)和脂肪体(B)中CecropinD基因的相对表达量
2.5喂食细菌对家蚕Moricin相对表达量的影响
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕中肠中Moricin相对表达量的变化如图5-A所示。从图5-A可以看出,与对照相比,喂食绿脓杆菌1,2 h后Moricin相对表达量显著上调,且1 h后Moricin相对表达量最高;喂食金黄色葡萄球菌1,2,4 h后Moricin相对表达量显著上调,且1 h后Moricin相对表达量最高。与感染绿脓杆菌相比,感染金黄色葡萄球菌1,4 h后Moricin相对表达量均较高。喂食绿脓杆菌24 h后Moricin相对表达量显著下调,喂食食金黄色葡萄球菌8,16,24 h后Moricin相对表达量显著下调。
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕脂肪体中Moricin相对表达量的变化如图5-B所示。从图5-B可以看出,与对照相比,喂食绿脓杆菌和金黄色葡萄球菌4,24 h后Moricin相对表达量显著上调,8 h后Moricin相对表达量显著下调。
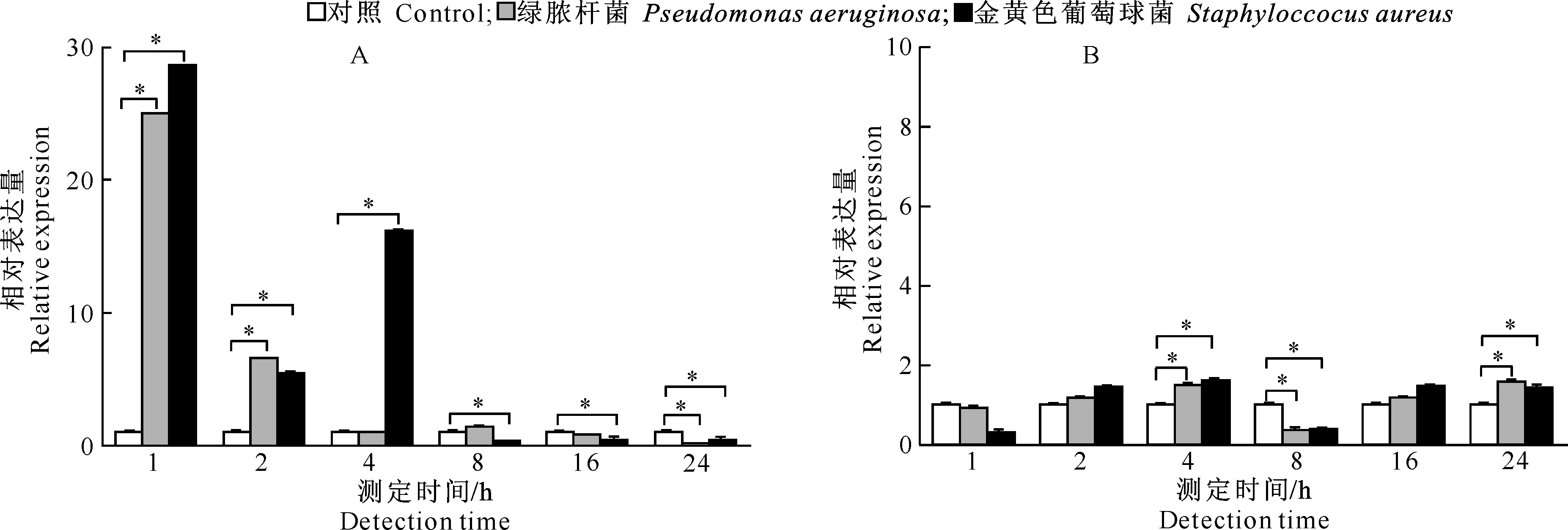
图 5 喂食不同细菌后家蚕中肠(A)和脂肪体(B)中Moricin基因的相对表达量
2.6喂食细菌对家蚕Attacin2相对表达量的影响
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕中肠中Attacin2相对表达量的变化如图6-A所示。从图6-A可以看出,喂食绿脓杆菌后Attacin2相对表达量没有显著变化;与对照相比,喂食金黄色葡萄球菌后2,4,8 h后Attacin2相对表达量显著上调,且4 h后Attacin2相对表达量最高。
喂食生理盐水、绿脓杆菌和金黄色葡萄球菌后,家蚕脂肪体中Attacin2相对表达量的变化如图6-B所示。从图6-B可以看出,与对照相比,喂食绿脓杆菌和金黄色葡萄球菌4,24 h后Attacin2相对表达量显著上调。

图 6 喂食不同细菌后家蚕中肠(A)和脂肪体(B)中Attacin2基因的相对表达量
3讨论
本试验选用绿脓杆菌和金黄色葡萄球菌喂食感染家蚕幼虫,然后在不同时间点分别提取中肠和脂肪体两种组织,利用半定量RT-PCR方法检测了家蚕中6种抗菌肽基因的转录情况。结果表明,感染两种细菌后家蚕中肠中抗菌肽基因相对表达量的变化随时间变化有所不同。家蚕喂食绿脓杆菌1,2 h后,中肠中抗菌肽Gloverin2、Lebcion、CecropinB6、CecropinD和Moricin的相对表达量显著上调,且感染1 h后抗菌肽Gloverin2、Moricin的相对表达量达到最高,感染2 h后抗菌肽Lebcion、CecropinB6的相对表达量达到最高,但24 h后Gloverin2、Lebcion和Moricin的相对表达量显著下调,也许是由于一些抑制因子[24]的表达造成的,以防止家蚕过度免疫对自身造成伤害。有研究表明,喂食金黄色葡萄球菌后抗菌肽Gloverin2、CecropinD和Moricin的相对表达量会上调[24],这与本研究结果一致,同时本研究还发现,感染金黄色葡萄球菌后抗菌肽CecropinB6、Lebcion和Attacin2的相对表达量也会上调。同喂食绿脓杆菌相比,喂食金黄色葡萄球菌1,2,4 h后中肠中6种抗菌肽的相对表达量均较高,说明家蚕对不同细菌的敏感度不同。在脂肪体中,抗菌肽CecropinD、Moricin和Attacin2的相对表达量随时间变化最显著,其他3种抗菌肽相对表达量与对照相比变化不明显,说明给家蚕喂食细菌可诱导脂肪体中部分抗菌肽的表达。
家蚕肠道感染细菌后,不同细菌所诱导的抗菌肽相对表达量随时间变化不同,表明家蚕对不同类型的细菌有不同的防御机制;家蚕肠道是相对封闭的管道,而且肠道细胞和脂肪体细胞属于不同的免疫组织,虽然细菌经由口器进入肠道,但仍然能够诱导脂肪体中抗菌肽的表达,这可能是由于一些信号因子穿过肠壁细胞进入血腔中,或是因为细菌穿过肠壁细胞进入血腔中,也可能是这两种因素同时导致的。
总体来看,在家蚕的肠道免疫中,感染不同细菌所诱导的抗菌肽种类有所不同,且肠道感染细菌后既能引起肠道免疫反应,影响中肠中抗菌肽基因的表达,又能引起体液免疫反应,影响脂肪体中抗菌肽基因的表达。
[参考文献]
[1]Rizki R M,Rizki T M.Selective destruction of a host blood cell type by a parasitoid wasp [J].Proceedings of the National Academy of Science of the United States of America,1984,81:6154-6158.
[2]Braun A,Hoffmann J A,Meister M.Analysis of theDrosophilahost defense in domino mutant larvae,which are devoid of hemocytes [J].Proceedings of the National Academy of Sciences of the United States of America,1998,95:14337-14342.
[3]Hoffmann J A,Kafatos F C,Janeway C A,et al.Phylogenetic perspectives in innate immunity [J].Science,1999,284:1313-1318.
[4]Hultmark D.Drosophilaimmunity:Paths and patterns [J].Cu-rrent Opinion in Immunology,2003,15:12-19.
[5]Hoffmann J A.The immune response ofDrosophila[J].Nature,2003,426:33-38.
[6]Brennan C A,Anderson K V.Drosophila:The genetics of innate immune recognition and response [J].Annual Review of Immunology,2004,22:457-483.
[7]Imler J L,Bulet P.Antimicrobial peptides inDrosophila:Structures,activities and gene regulation [J].Chemical Immunology and Allergy,2005,86:1-21.
[8]Tzou P,Reichhart J M,Lemaitre B.Constitutive expression of a single antimi-crobial peptide can restore wild-type resistance to infection in immunodeficientDrosophilamutants [J].Proceedings of the National Academy of Sciences of the United States of America,2002,99:2152-2157.
[9]Boulanger N,Munks R J,Hamilton J V,et al.Epithelial innate immunity:A novel antimicrobial peptide with antiparasitic activity in the blood-sucking insectStomoxyscalcitrans[J].The Journal of Biological Chemistry,2002,277:49921-49926.
[10]Vallet-Gely I,Lemaitre B,Boccard F.Bacterial strategies to overcome insect defences [J].Nature Reviews Microbiology,2008,6:302-313.
[11]Crampton A,Luckhart S.The role of As60A,a TGF-beta homolog,inAnophelesstephensiinnate immunity and defense againstPlasmodiuminfection [J].Infection,Genetics and Evolution,2001,1:131-141.
[12]Freitak D,Wheat C W,Heckel D G,et al.Immune system responses and fitness costs associated with consumption of bacteria in larvae ofTrichoplusiani[J].BMC Biology,2007,5:56.
[13]Herrera-Ortíz A,Lanz-Mendoza H,Martínez-Barnetche J,et al.Plasmodiumbergheiookinetes induce nitric oxide production inAnophelespseudopunctipennismidguts cultured in vitro [J].Insect Biochemistry and Molecular Biology,2004,34:893-901.
[14]Wu S,Zhang X F,He Y Q,et al.Expression of antimicrobial peptide genes inBombyxmorigut modulated by oral bacterial infection and development [J].Developmental and Comparative Immunology,2010,34:1191-1198.
[15]Lemaitre B,Hoffmann J.The host defense ofDrosophilamelanogaster[J].The Annual Review of Immunology,2007,25:697-743.
[16]Cruciani R A,Barker J I,Zasloff M.Antibiotic magainins exert cytolytic activity against transformed cell lines through channel formation [J].Proceedings of the National Academy of Sciences of the United States of America,1991,88:3792-3796.
[17]孙伟,沈以红,向仲怀,等. 家蚕抗菌肽基因研究进展 [J].蚕业科学,2009,35(1):196-203.
Sun W,Shen Y H,Xiang Z H,et al.Advances in antimicrobial peptide genes in the silkworm,Bombyxmori[J].Science of Sericulture,2009,35(1):196-203.(in Chinese)
[18]韩冬,邓小娟,杨婉莹,等.家蚕拟抗微生物肽Gloverins基因(Bmglv)的原核表达及抗菌活性鉴定 [J].昆虫学报,2008,51(6):561-568.
Han D,Deng X J,Yang W Y,et al.Prokaryotic expression and activity detection of the gloverin-like genes (Bmglv) ofBornbyxmori[J].Acta Entomologica Sinica,2008,51(6):561-568.(in Chinese)
[19]Tanaka H,Sagisaka A,Fujita K,et al.BmEtsupregulates pro-moter activity of lebocin inBombyxmori[J].Insect Biochemistry and Molecular Biology,2012,42:474-481.
[20]杨莹,王成林,徐家萍,等.家蚕和果蝇的抗菌肽cecropinB基因的原核表达及抑菌活性分析 [J].蚕业科学,2011,37(2):246-253.
Yang Y,Wang C L,Xu J P,et al.Prokaryotic expression and bacteriostatic activity analysis of antibacterial peptideCecropinBgenes fromBombyxmoriandDrosophilamelanogaster[J].Science of Sericulture,2011,37(2):246-253.(in Chinese)
[21]陈维春,宋杰,庞义.斜纹夜蛾两个天蚕素D基因的克隆及序列分析 [J].昆虫学报,2007,50(7):745-749.
Chen W C,Song J,Pang Y.Cloning and sequence analysis of twoCecropinDgenes from the common cutworm,Spodopteralitura(Lepidoptera:Noctuidae) [J].Acta Entomologica Sinica,2007,50(7):745-749.(in Chinese)
[22]赵岩龙,沈兴家,郭锡杰.家蚕抗菌肽moricin在大肠杆菌中的融合表达及抗菌活性测定 [J].蚕业科学,2008,34(2):232- 236.
Zhao Y L,Shen X J,Guo X J.Fusion expression and test of antibacterial activity of the antibacterial peptide moricin ofBombyxmoriinEscherichiacoli[J].Science of Sericulture,2008,34(2):232-236.(in Chinese)
[23]党颖慧,杨金宏,孔卫青.家蚕抗菌肽Attacin基因植物表达载体的构建 [J].中国农学通报,2010,26(10):52-54.
Dang Y H,Yang J H,Kong W Q.Construction of plant expression vector withAttacininBombyxmori[J].Chinese Agricultural Science Bulletin,2010,26(10):52-54.(in Chinese)
[24]Welchman D P,Aksoy S,Jiggins F,et al.Insect immunity:Fr-om pattern recognition to symbiont-mediated host defense [J].Cell Host Microbe,2009,6:107-114.
Expression of 6 antimicrobial peptide genes in silkworm,Bombyxmoriafter oral bacterial infection
WANG Yan-wen,LÜ Zhi-qiang
(CollegeofPlantProtection,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:【Objective】 The expression of 6 antimicrobial peptide genes after oral infection with Pseudomonas aeruginosa and Staphylococcus aureus was studied to provide theoretical basis for gut immune of silkworm.【Method】 Using physiological saline as control check,the expression of 6 antimicrobial peptide genes in midgut and fat body of silkworm after 1,2,4,8,16,and 24 h Pseudomonas aeruginosa and Staphylococcus aureus infection was studied by semi-quantitative RT-PCR.【Result】 Silkworm significantly up-regulated the relative expression of Gloverin2,Lebocin,CecropinB6,CecropinD and Moricin after infection 1,2 h with P.aeruginosa and the relative expression of all 6 antimicrobial peptides increased after infection 1,2,and 4 h with S.aureus in midgut.After oral infection with two bacteria,the relative expression of CecropinD,Moricin and Attacin2 was significant different in fat body.【Conclusion】 The immune mechanisms of silkworm against different bacteria were different.Bacteria in intestine via mouthparts could induce both epithelial immune response and humoral immune response.
Key words:silkworm;bacteria;antibacterial peptides gene;semi-quantitative RT-PCR
[文章编号]1671-9387(2016)01-0185-07
[中图分类号]S186;Q966
[文献标志码]A
[作者简介]王延稳(1987-),女,山东济宁人,硕士,主要从事家蚕免疫研究。E-mail:wangyanwen4366@163.com[通信作者]吕志强(1971-),男,陕西汉中人,教授,博士生导师,主要从事昆虫生理生化和昆虫免疫研究。
[基金项目]国家重大基础研究发展计划(973计划)子课题(2012CB114604);教育部基本科研业务费专项(CX200908)
[收稿日期]2014-05-06
DOI:网络出版时间:2015-12-0214:2510.13207/j.cnki.jnwafu.2016.01.027
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151202.1425.054.html
E-mail:zhiqianglu@gmail.com
