转氨酶的固定化及酶学性质研究
2016-06-02董正伟朱芳莹朱文渊田宋奎柳志强浙江工业大学生物工程学院浙江省生物有机合成技术研究重点实验室浙江杭州310014生物转化与生物净化教育部工程研究中心浙江杭州310014
董正伟,朱芳莹,朱文渊,田宋奎,柳志强(1.浙江工业大学生物工程学院浙江省生物有机合成技术研究重点实验室,浙江杭州310014;2.生物转化与生物净化教育部工程研究中心,浙江杭州310014)
转氨酶的固定化及酶学性质研究
董正伟1,2,朱芳莹1,2,朱文渊1,2,田宋奎1,2,柳志强1,2
(1.浙江工业大学生物工程学院浙江省生物有机合成技术研究重点实验室,浙江杭州310014;
2.生物转化与生物净化教育部工程研究中心,浙江杭州310014)
摘要:利用环氧树脂载体进行固定化转氨酶的研究,通过单因素优化确定了较优的酶固定化条件:ES-103b树脂载体、转氨酶和辅酶磷酸吡哆醛最佳质量比为50:6:5,在pH为7.0的1 mol/L磷酸钾缓冲液介质中吸附25 h。将得到的固定化颗粒重新置于pH为9.0的100 mmol/L磷酸钾缓冲液中,30℃保温30 h。取出后置于pH为8.5的3 mol/L甘氨酸-NaOH缓冲液中,25℃保温12 h,制得固定化转氨酶,其比活力为52.7 U/g(湿载体),酶活回收率达到49.3%。酶学性质研究表明:固定化转氨酶催化反应最适pH、温度分别为7.0、50℃;固定化酶热稳定性及pH稳定性明显提高,50℃条件下的半衰期为20.2 d;在pH 8.0的三乙醇胺缓冲液中(4℃),10 d后酶活仍保持初始酶活的82.3%。
关键词:转氨酶;固定化;磷酸吡哆醛;比酶活;酶学性质
转氨酶(Aminotransferases,ATs)是一类磷酸吡哆醛依赖性酶,普遍存在于自然界中,在生物体内催化氨基由氨基供体向氨基受体的转移反应。转氨酶具有较高的立体选择性、区域选择性,较高的反应速率与稳定性[1],广泛应用于合成天然及非天然氨基酸、手性胺、氨基醇等重要医药及农药中间体。其中,手性胺在制药工业中需求不断增长[2],而转氨酶的出现则为手性胺的合成提供了一种新方法。
抗糖尿病新药Januvia的主要成分西他列汀是一种R-型手性胺。转氨酶参与西他列汀合成中关键步骤,即催化西他列汀前体酮不对称合成西他列汀。默克公司利用一种改造的转氨酶在200 g/L底物质量浓度下,24 h内转化率达到92%,e.e.值大于99.5%[3]。
酶固定化技术发展于上世纪50年代,常用的固定化酶方法主要包括物理吸附、共价结合、交联法和包埋法[4]。固定化酶实现催化剂重复利用,反应体系与催化剂易于分离,简化了生产工艺。Truppo等[5]成功地将西他列汀转氨酶固定在一种多孔疏水树脂SEPABEAD EXE120表面。固定化酶以乙酸异丙酯作为反应介质,在200 g/L底物质量浓度下,重复使用10批,转化率始终保持在90%以上。
本文采用高孔容、高比表面积的ES-103b环氧基树脂载体对本实验室获得的转氨酶进行固定化工艺研究,考察了酶浓度、pH、磷酸盐浓度、温度、时间、辅酶浓度对固定化效果影响,并对固定化酶部分酶学性质进行考察。
1 材料与方法
1.1主要材料及试剂
ES-103b树脂,天津南开和成科技有限公司;产转氨酶的大肠杆菌由本实验室构建并保藏;BCA蛋白测定试剂盒,北京康为世纪生物科技有限公司;西他列汀前体酮、西他列汀均由浙江永太科技股份有限公司提供;磷酸吡哆醛购自西格玛公司。
1.2实验方法
1.2.1固定化参数测定
取10 mL反应液(如表1所示)于50 mL摇瓶中,并加入1 mmol/L的PLP,在45℃恒温摇床中预热4~5 min,准确称取0.5 g固定化酶或者500 μL固定化酶液于摇瓶中。45℃,150 r/min振荡反应2 h,取样700 μL,通过HPLC检测产物西他列汀含量,计算酶活。比酶活定义如下:在45℃,pH 8.5条件下,1 g转氨酶冻干粉/固定化酶每小时生成西他列汀的物质的量(μmol)。
酶活回收率(%)=固定化酶活/初始酶液总酶活×100
蛋白吸附率(%)=(初始蛋白浓度-残余蛋白浓度)/初始蛋白浓度×100,蛋白浓度采用BCA试剂盒测定
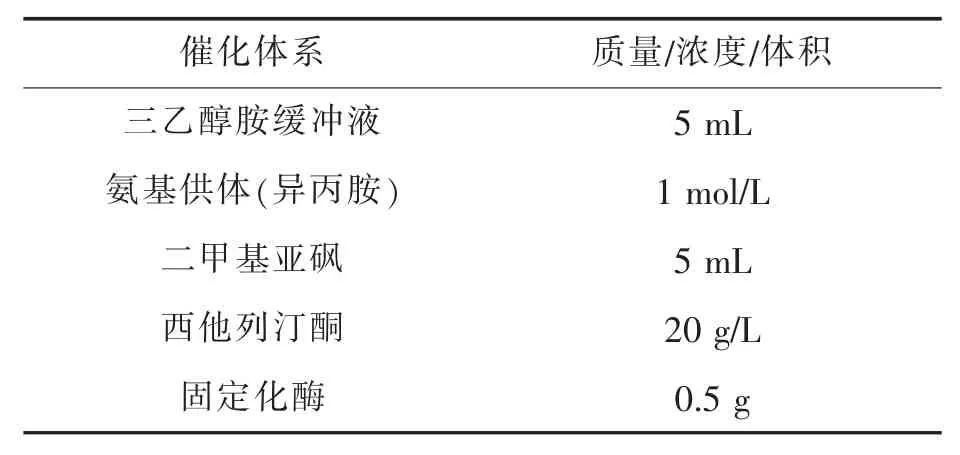
表1 酶活测定反应体系
1.2.2酶源[3]
实验室自制转氨酶冻干粉作为固定化酶源。
1.2.3固定化载体筛选
以实验室现有的8种环氧树脂ES-103b、ES-105(pore size,300~450 μm)、ES-105(pore size,150~300 μm)、LX -1000、ES -1、MC150EP、MC300EP、ES-1制作的固定化酶连续进行4批次催化实验,筛选较为理想的载体。固定化酶制备方法如下:称量0.02 g转氨酶冻干粉溶解于10 mL pH 7.0的100 mmol/L三乙醇胺缓冲液中,加入1 g环氧载体及1 mmol/L辅酶PLP,置于25℃水浴摇床中,150 r/min孵育过夜,抽滤并用蒸馏水清洗两遍得固定化酶。在10 mL催化体系(表1)中称量加入1 g固定化酶,置于45℃,150 r/min水浴摇床中开始反应,24 h取样测定产物浓度并计算底物转化率。
1.2.4固定化工艺参数优化
1)酶浓度对固定化酶活的影响
配制pH为7.0的100 mmol/L磷酸盐缓冲液,分别加入一定量转氨酶冻干粉分别配制成质量浓度为1、3、6、9、12、15 g/L的均一酶液(含有浓度为2 mmol/L的PLP)。取10 mL酶液加入50 mL摇瓶中,并准确称量加入0.5 g ES-103b树脂,置于25℃水浴摇床中,150 r/min振荡孵育10 h后取上清残余酶液测定蛋白浓度,抽滤得固定化酶,用蒸馏水洗涤两遍,进行酶活测定。计算蛋白吸附率、酶活回收率。
2)盐离子浓度对固定化酶活的影响
配制pH 7.0,浓度分别为250、500、1 000、1 500、2 000 mmol/L的磷酸盐缓冲液,取10 mL缓冲液(含有浓度为2 mmol/L的PLP)加入0.06 g转氨酶冻干粉及0.5 g ES-103b树脂载体,置于25℃水浴摇床中,150 r/min振荡孵育10 h,抽滤得固定化酶,并用蒸馏水洗涤两遍,进行酶活测定。
3)pH对固定化酶活的影响
配制浓度为1 mol/L,pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0的磷酸盐缓冲液。在10 mL缓冲液(含有浓度为2 mmol/L PLP)中加入0.06 g转氨酶冻干粉及0.5 g ES-103b树脂载体,置于25℃水浴摇床中,150 r/min振荡孵育10 h,抽滤得固定化酶,并用蒸馏水洗涤两遍,进行酶活测定。
4)温度对固定化酶活的影响
配制pH为7.0的1 mol/L磷酸盐缓冲液,在10 mL缓冲液(含有浓度为2 mmol/L PLP)中加入0.06 g转氨酶冻干粉及0.5 g ES-103b树脂载体,分别置于20、25、30、35、40℃温度条件下,150 r/ min震荡孵育10 h,抽滤得固定化酶,并用蒸馏水洗涤两遍,进行酶活测定。
5)固定化时间对固定化酶活的影响
配制pH为7.0的1 mol/L磷酸盐缓冲液,在10 mL缓冲液(2 mmol/L PLP)中加入0.06 g转氨酶冻干粉及0.5 g ES-103b树脂载体,置于25℃水浴摇床中,150 r/min振荡孵育2、5、10、15、20、25 h后取出,抽滤得固定化酶,并用蒸馏水洗涤两遍,进行酶活测定。
6)辅酶浓度对固定化酶活的影响
本实验将固定化酶体系中辅酶浓度分别设定为0、1、2、4、6 mmol/L,考察辅酶浓度对固定化效果影响。在10 mL pH为7.0的1 mol/L磷酸盐缓冲液中加入0.06 g转氨酶冻干粉及0.5 g树脂载体,置于25℃水浴摇床中,150 r/min孵育25 h,抽滤得固定化酶,并用蒸馏水洗涤两遍,进行酶活测定。
根据文献报道的环氧树脂固定化酶成熟工艺流程,本文将第一阶段得到的固定化酶加入pH 为9.0的100 mmol/L磷酸盐缓冲液(20%甘油)中,30℃保温处理30 h,在此阶段酶蛋白与树脂表面的环氧基形成多个共价键。之后将保温处理后得到的固定化酶加入pH为8.5的3 mol/L甘氨酸-NaOH缓冲液中,在25℃条件下保温12 h,除去未反应的环氧基。本实验利用得到的固定化酶进行以下部分的酶学性质研究。
1.2.5固定化酶学性质
1)固定化酶催化反应最适pH确定
配制底物质量浓度为10 g/L的反应液(参照表1所示),用浓盐酸调节反应液pH分别为6.0、7.0、8.0、8.5、9.0、9.5、10.0、10.5,并将反应体系定容至20 mL。取10 mL反应液加入50 mL磁力搅拌反应釜中,准确称量0.25 g固定化酶加入其中,利用4 mol/L异丙胺溶液控制反应体系pH,在45℃,300 r/min条件下,催化反应2 h后取样700 μL,测定产物浓度。每个pH条件重复三次,并做不加固定化酶的空白对照实验。
2)固定化酶催化反应最适温度确定
配制pH为8.0,底物质量浓度为10 g/L的反应液10 mL,加入50 mL磁力搅拌反应釜中,精确称量0.25 g固定化酶加入其中,分别设置反应温度为30、40、45、50、55、60、70、80℃,其他反应条件如1.3.5第1部分所述,每个温度条件重复三次,并做空白对照。
3)固定化酶pH稳定性研究
配制100 mmol/L,pH分别为7.0、8.0、9.0的TEA缓冲液,称量一定固定化酶分别加入相应的缓冲液中,均置于4℃冰箱储存。每隔24 h取出,准确称量0.5 g固定化酶,进行酶活检测。酶活检测方法如1.3.1所示。
4)固定化酶热稳定性研究
配制三份pH 8.0的TEA缓冲液,称量一定量的固定化酶加入三份缓冲液中,并分别置于40、50、60℃水浴保温。每隔24 h取出,准确称量0.5 g固定化酶,进行酶活检测。酶活检测方法如1.3.1所述。
2 结果及讨论
2.1固定化载体筛选
环氧树脂载体由于孔径、粒径、环氧值等材料参数存在差异,固定化效果受到影响。本文从实验室已有的环氧树脂中筛选适合转氨酶固定化的载体,结果如图1所示。

图1 固定化酶载体筛选
由图1可以看出:以ES-105(300~450 μm),ES-103b,Sepabeads EC-EP作为载体得到的固定化酶活性及操作稳定性较好;其中Sepabeads ECEP固定化酶稳定性最好,但酶活较差,原因可能是树脂表面环氧基密度较小,因此固定在表面的酶蛋白较少[6];ES-105(300~400 μm)树脂载体虽然孔径与其他两种树脂相同,但粒径较大,因此比表面积较小,可能会存在较强的扩散限制等问题[7],不利于后期的催化反应。综上考虑,后续实验中选择ES-103b作为固定化酶载体,其在未优化前固定化酶活为28 U/g,酶活测定方法如1.3.1所示。
2.2固定化体系酶浓度确定
在固定化酶的研究中,载体的投放量必须与所固定化的酶液中蛋白含量一致才能达到理想的效果,否则会造成酶蛋白或载体的浪费,增加固定化成本[8]。
本实验通过改变固定化体系加酶量,考察酶液浓度对固定化影响,结果如图2所示。由图2可以看出:随着酶浓度增加,固定化酶活增加,速度减缓,但酶活回收率及蛋白吸附率却在不断减小,可能是因为固定化载体表面可利用的环氧基逐渐达到饱和;在图中也可以看出蛋白吸附率始终高于酶活回收率,原因是在固定化过程中酶蛋白发生了构象改变或者是活性位点被遮盖,导致固定化酶活性降低[6];当固定化酶质量浓度为12 g/L时,固定化酶活达到峰值63 U/g,之后又出现小幅下降,可能是因为过量的固定化酶在孔道内部形成了一定空间位阻效应,影响底物及产物内扩散[9]。考虑到催化剂及载体成本,本实验选择6 g/L作为后续实验固定化体系酶浓度,此时固定化酶活为48 U/g。

图2 酶浓度对固定化影响
2.3固定化体系盐离子浓度确定
在环氧树脂固定化第一阶段,增加溶液中盐离子浓度在一定程度上可以促进酶蛋白吸附在树脂疏水表面,增加环氧基团与酶蛋白氨基形成共价键的几率。本实验以磷酸钾盐考察盐离子浓度对固定化效果影响,结果如图3所示:固定化酶活回收率及比酶活均随磷酸盐浓度先升高再下降,在磷酸盐浓度1 mol/L时,酶活回收率与固定化酶活达到最高87 U/g;而在磷酸盐浓度较高的情况下,游离酶蛋白可能出现盐析、凝聚等现象,从而堵塞载体孔径通道,或是仅仅简单吸附在树脂颗粒的外表面,从而影响固定化效果。综上考虑,本实验选择1 mol/L作为后续实验固定化酶体系磷酸盐浓度。

图3 磷酸盐浓度对固定化影响
2.4固定化酶体系pH确定
酶液pH会影响到酶蛋白侧链氨基的解离形式,进而影响到其与环氧基团的反应效率。本实验配制了不同pH的固定化酶液,考察pH对固定化影响,结果如图4所示。由图4可以看出:固定化酶活回收率与固定化酶活均呈现随pH升高先上升然后下降的趋势,在pH 5.0时达到最大值57U/g。固定化酶体系在强酸及强碱性环境下,游离酶发生不同程度的变性失活,并出现蛋白沉淀析出,从而使得固定化酶活较低。

图4 pH对固定化影响
我们通过软件BioXM分析得知,本课题所用的转氨酶等电点为5.0左右。在pH 5.0环境中,酶蛋白可能出现凝聚并沉积在树脂表面,导致固定化酶活较高,而此时酶蛋白可能只是附着在载体颗粒的外表面,容易脱落进入溶液中,最终得到的固定化酶稳定性可能较差。为了避免这些问题,本部分补加了对pH 5.0、6.0、7.0条件下得到的固定化酶操作稳定性实验,每个批次反应2 h,结果如图5所示。由图5可以看出:当固定化体系pH 5.0时,固定化酶在第二批反应时活力迅速下降,可能是由于酶蛋白简单吸附在树脂外表面,没有进入颗粒内部,在反应时被洗脱下来;而在中性环境中酶蛋白分子以可溶的形式存在,活力较为稳定[6],可以自由地与载体表面的环氧基结合。综上考虑,本文选择在pH 7.0条件下进行酶固定化。

图5 固定化pH对固定化酶操作稳定性考察
2.5固定化温度对固定化影响
酶蛋白氨基酸残基与环氧基团形成共价键过程也属于一种化学反应,高温有利于加快反应速度,但催化剂属于生物大分子,在高温下可能会出现变性失活。因此选择一个合适的固定化温度对固定化影响较大。本实验分别在20、25、30、35、40℃条件下考察温度对固定化效果影响。结果如图6所示:固定化酶活随温度先升高后降低,在25℃时取得最大值80.39 U/g;当温度超过30℃时固定酶活性逐渐降低,可能是溶液中游离酶蛋白在吸附到固定化载体表面前便出现变性失活。综上本文确定25℃作为固定化温度。
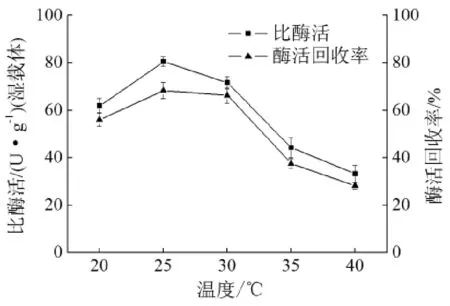
图6 固定化温度对固定化影响
2.6固定化时间的确定
固定化时间长短影响固定化效果,固定化时间太短,酶蛋白不能进入树脂内部而吸附在树脂表面。本部分实验探究了固定化酶活随时间变化趋势,实验结果如图7所示。由图7可以看出:当固定化反应进行到5 h时固定化酶活即达到峰值,说明酶蛋白第一阶段吸附作用比较迅速;在10 h时固定化酶活稍有下降,可能是吸附的酶蛋白又重新溶解到溶液中;如果再延长固定化时间,酶活基本保持不变。考虑到第二阶段固定化过程中酶蛋白可能大量脱离载体表面,为了确保最终的固定化酶活,本实验将固定化时间延长至25 h。

图7 固定化时间对固定化影响
2.7固定化辅酶浓度的确定
转氨酶为PLP依赖型酶,在游离细胞或酶催化反应中需要额外添加辅酶,而辅酶回收困难较大,因此造成极大浪费。本课题将转氨酶与辅酶共固定化,转氨酶与辅酶可以在反应结束后同时从反应液中分离,实现重复利用,从而进一步降低了催化成本。本节对固定化时辅酶浓度进行考察,实验结果如图8所示。由图8可知:当辅酶浓度大于2 mmol/L时固定化酶活趋于稳定。为了避免辅酶的浪费,本文确定固定化时辅酶浓度为2 mmol/L,此时固定化比酶活为77.23 U/g。

图8 固定化辅酶浓度对固定化酶稳定性影响
将第一阶段得到的固定化酶进行第二、三阶段处理,最终得到的固定化酶活为52.7 U/g。与未优化前相比,酶活提高了88.5%,酶活回收率提高至49.3%。
2.8固定化酶催化反应最适pH确定
酶固定化载体携带的部分电荷可能会改变固定化酶周围微环境pH,进而导致固定化酶pH—活性曲线发生一定的迁移。图9为固定化酶的pH—活性曲线。由图可知:固定化酶活在中性及弱碱性条件下变化不大,在pH 8.5~9.0范围内固定化酶活最高,当pH超过9.0时酶活迅速下降。与游离酶相比,固定化酶的最适pH基本不变。由于环氧树脂载体表面呈中性,因此酶的固定化不会对其所处的微环境pH构成影响。
随着转氨反应的进行,异丙胺不断消耗、挥发,导致反应体系pH持续降低。而在中性及弱碱性条件下,固定化酶对pH变化不敏感,活力较为稳定,在工业中可以减少对酸碱控制的依赖。综上考虑,本实验确定pH 8.0作为后续催化反应最适pH。

图9 pH对固定化酶催化反应影响
2.9固定化酶催化反应最适温度确定
与游离酶相比,固定化酶热稳定性增加的同时,催化反应最适温度也会发生改变。图10为固定化转氨酶的温度—活性曲线。由图可知:固定化酶最适反应温度为65℃,当超过65℃时酶活迅速下降。与游离酶相比固定化酶最适反应温度提高了10℃,可能是由于酶蛋白在载体表面形成多个共价键,分子刚性增加,或者酶活中心被载体遮挡,亦或是酶蛋白在树脂孔道内形成一定空间位阻,底物及产物扩散阻力较大,综合因素导致催化反应需要更多能量摄入。而底物西他列汀前体酮当温度超过50℃时会出现自发分解,因此本实验将固定化酶催化反应温度设定为50℃。

图10 温度对固定化酶催化反应影响
2.10固定化酶pH稳定性的考察
本部分实验考察了固定化转氨酶在不同pH条件下的稳定性,结果如图11所示:固定化酶在pH 8.0条件下较为稳定,10 d后酶活仍保持有初始酶活的82.3%,具有较好的pH稳定性。

图11 固定化酶pH稳定性
2.11固定化酶温度稳定性的考察
温度稳定性是固定化酶最重要的一个属性。本实验考察固定化转氨酶在40、50、60℃条件下的温度稳定性,结果如图12所示。

图12 固定化酶温度稳定性
由图12可以看出:在各种温度条件下,随着时间延长,固定化酶活均缓慢降低。本文以初始酶活为100%,计算不同时间点相对酶活,并与时间进行线性拟合及计算分析。固定化酶在40、50、60℃条件下的失活常数分别为0.020 9,0.034 3,0.083 5 d-1,半衰期分别为33.1、20.2、8.3 d,40℃条件下酶活较为稳定,10 d后固定化酶活还保持有初始酶活的77.2%。
3 结论
本文首先通过对几种环氧树脂载体进行筛选,确定ES-103b作为本课题所用的固定化酶载体。其次优化了固定化过程中重要参数,如酶浓度、pH、磷酸盐浓度、温度、辅酶浓度、时间。并根据成熟的环氧树脂固定化方法对转氨酶进行固定化,最终的固定化工艺如下:ES-103b树脂载体、转氨酶和辅酶磷酸吡哆醛以质量比为50:6:5,加入pH为7.0的1 mol/L磷酸钾缓冲液中,室温振荡吸附25 h。将得到的固定化颗粒重新置于pH 为9.0的100 mmol/L磷酸钾缓冲液中,30℃保温30 h。取出再置于pH为8.5的3 mol/L甘氨酸-NaOH缓冲液中,25℃保温12 h,制得固定化转氨酶,其比活力为52.7 U/g,酶活回收率达到49.3%,与未优化前相比,酶活提高了88%。之后,我们对获得的固定化转氨酶的酶学特性进行了研究。固定化酶催化反应最适温度为50℃,最适pH 为8.0,在中性及弱碱性条件下固定化酶催化活力变化不大,pH高于9.0时酶活降低迅速。固定化酶在40、50、60℃条件下半衰期分别为33.1、20.2、8.3 d。在pH 8.0条件下固定化酶稳定性较好,10 d后酶活还保持有初始酶活的82.3%左右,热稳定性及pH稳定性优良,具有良好的工业化应用前景。
参考文献:
[1]TAYLOR P P,PANTALEONE D P,SENKPEIL R F,et al. Novel biosynthetic approaches to the production of unnatural amino acids using transaminases[J]. Trends in biotechnology,1998,16 (10):412-418.
[2]王潇莹,刘冰滢,游松.转氨酶在手性化合物合成中的研究进展[J].沈阳药科大学学报,2014,31(4):313-324.
[3]SAVILE C K,JANEY J M,MUNDORFF E C,et al. Biocatalytic asymmetric synthesis of chiral amines from ketones applied to sitagliptin manufacture[J]. Science,2010,329(5989):305-309.
[4]BRENA B M,BATISTA-VIERA F. Immobilization of enzymes and cells[M]. Totowa,NJ:Humana Press,2006:15-30.
[5]TRUPPO M D,STROTMAN H,HUGHES G. Development of an immobilized transaminase capable of operating in organic solvent[J]. ChemCatChem,2012,4(8):1071-1074.
[6]TORRES P,BATISTA-VIERA F. Immobilization of β-galactosidase from Bacillus circulans onto epoxy-activated acrylic supports[J]. Journal of molecular catalysis B:Enzymatic,2012,74 (3):230-235.
[7]CAO L. Immobilised enzymes:science or art?[J]. Current opinion in chemical biology,2005,9(2):217-226.
[8]崔培梧,黎继烈,肖作为,等.环氧基树脂固定化青霉菌柚苷酶的工艺条件[J].食品与发酵工业,2014,40(5):87-92.
[9]丁成勇,徐晓滢,马,等. Eupergit C250L固定化D-海因酶及其催化性质[J].生物加工过程,2007,4(4):41-45.
(责任编辑:朱小惠)
Immobilization of transam inase and characterization of its enzymatic properties
DONG Zhengwei1,2,ZHU Fangying1,2,ZHU Wenyuan1,2,TIAN Songkui1,2,LIU Zhiqiang1,2
(1. Key Laboratory of Bioorganic Synthesis of Zhejiang Province,College of Biotechnology and Bioengineering,Zhejiang
University of Technology,Hangzhou 310014,China;
2. Engineering Research Center of Bioconversion and Biopurification of the Ministry of Education,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract:This study focused on the transaminase immobilization using epoxy-activated resin as support. Optimal conditions for immobilization were as follows:Resin ES-103b,lyophilized enzyme and PLP were added into 1 mol/L potassium phosphate solution(pH 7.0)at the ratio of 50:6:5 and incubated at room temperature for 25 h. The obtained immobilized enzyme was placed into 100 mmol/L potassium phosphate buffer(pH 9.0)for 30 h at 30℃,followed by its incubation in 3 mol/ L Glycine-NaOH buffer(pH 8.5)at 25℃for 12 h. The activity of immobilized enzyme was determined as 52.7 U/g(wet support)with activity recovery of 49.3%. The enzymatic characteristics of the immobilized transaminase were investigated. The optimal reaction temperature and pH were 50 ℃and 8.0,respectively. The immobilized transaminase possessed an improved pH and thermal stability. The half-time of the immobilized enzyme at 50℃was 20.2 d. The immobilized transaminase remained 82.3%of the original activity after 10 d of storage in TEA buffer(pH 8.0)at 4℃. Keywords:transaminase;immobilization;PLP;specific activity;enzymatic properties
作者简介:董正伟(1989—),男,山东泰安人,硕士,主要从事发酵及生物催化方面研究,E-mail:937143668@qq.com.通信作者:柳志强教授,E-mail:microliu@zjut.edu.cn.
收稿日期:2015-05-25
中图分类号:Q814
文献标志码:A
文章编号:1674-2214(2016)02-0081-07
