肠道黏膜免疫功能异常与IgA肾病
2016-06-01杨楠楠综述王金泉审校
杨楠楠 综述 王金泉 审校
·肾脏病临床·
肠道黏膜免疫功能异常与IgA肾病
杨楠楠 综述 王金泉 审校
IgA肾病(IgAN)是我国发病率最高的原发性肾小球肾炎,其确切的病因及发病机制迄今尚不明确,但越来越多的证据表明肠道黏膜免疫功能异常与IgAN的发生和发展密切相关。研究表明,食物成分、肠道微生态及肠道疾病等多种因素导致的肠道黏膜免疫功能异常,产生大量的分泌型IgA(sIgA),最终沉积于肾小球系膜区,导致IgAN。本文就此作一综述。
IgA肾病 肠道黏膜免疫 食物成分 肠道微生态 肠道疾病
IgA肾病(IgAN)也称系膜增生性IgAN,其主要特征为IgA或以IgA为主的免疫球蛋白在肾小球系膜区弥漫沉积[1]。IgAN是我国最常见的肾小球疾病,约占原发性肾小球肾炎的36.9%~45.3%[2],约30%~50%的IgAN患者在明确诊断后20年内进展至终末期肾病(ESRD)[3]。目前为止,IgAN的发病机制尚不完全明确,越来越多的证据表明,肠道黏膜免疫异常在IgAN发生和发展中具有重要作用。有学者提出“肠-肾关联”学说[4],肠道黏膜免疫功能失调时,机体对肠道菌群及食物抗原等出现免疫耐受缺陷,肠道黏膜屏障功能下降,毒素吸收入血,激活黏膜相关淋巴组织(MALT),使机体处于亚临床炎症状态,产生大量异常糖基化IgA1,形成循环免疫复合物,最终沉积于肾小球系膜区,导致IgAN。食物成分如麦胶蛋白、肠道菌群异常及肠道疾病是引起肠黏膜免疫功能异常的重要因素,基因学研究表明这些因素的部分易感基因位点与IgAN的易感基因位点相同,而这些因素也可以随着饮食及环境因素的改变而改变。因此,了解肠道黏膜免疫功能异常与IgAN的关系对研究IgAN的发病机制及寻找更有效的治疗方法具有重要意义。
食物抗原与IgAN
越来越多的证据表明食物抗原在IgAN的发病中起到重要作用。早在1989年,Coppo等[5]发现,富含麦胶蛋白的食物能够诱导IgA在BALB/c小鼠肾小球系膜区沉积,升高循环抗麦胶蛋白IgA抗体(AGA)与IgA水平,提示麦胶蛋白作为食物抗原与IgAN密切相关。也有研究显示IgAN患者食用鸡蛋后循环免疫复合物(CICs)水平升高[6]。
麦胶蛋白作为一种重要的食物抗原在IgAN发病机制的作用中被逐渐重视,小麦加工的面粉、麦芽等食物富含麦胶蛋白。有研究表明,通过测定直肠黏膜产生的一氧化氮(NO)、髓过氧化物酶(MPO)及嗜酸细胞阳离子蛋白(ECP)发现,约有1/3的IgAN患者直肠黏膜对麦胶蛋白具有高反应性[7]。Coppo等[8]发现,限制麦胶蛋白饮食摄入6个月后,29例IgAN患者的CIC及AGA水平明显下降,血尿和蛋白尿均有所下降。最近的一项研究发现,用不含麦胶蛋白食物喂养双重转基因α1KI-CD89Tg小鼠三代后,小鼠肾小球系膜区IgA1沉积、转铁蛋白受体1(TfR1)及谷氨酰胺转移酶2(TGase2)的表达及血尿均减少,之后再用富含麦胶蛋白食物喂养,小鼠肠道炎症加重,肠黏膜表面绒毛萎缩,血清中抗麦胶蛋白IgA1抗体及IgA1-sCD89免疫复合体增加,肾小球系膜区免疫复合物沉积增多[9]。
现有的研究结果表明,食物成分在IgAN的发生和发展中占有重要地位,IgAN患者对麦胶蛋白、鸡蛋、牛奶等食物蛋白的敏感性及反应性均升高,减少这些食物的摄入可能会延缓IgAN的进展,甚至能够预防IgAN的发生,但这还需要大量的实验与临床研究加以证实。
肠道微生态与IgAN
肠道微生态组成 人体胃肠道中约有200~500种细菌定居,数量可达100万亿,构成胃肠道微生态。健康人群的肠道菌群>90%为拟杆菌门和硬壁菌门,且多为厌氧菌,从胃到结肠,随着含氧量的减少,肠道细菌密度逐渐增大,结肠中细菌数量最多。这些肠道菌群不仅包括有益菌,如乳酸杆菌和双歧杆菌等,也包含潜在致病菌,如大肠杆菌、变形杆菌等,与人体形成一种成熟稳定的有益的动态平衡共生状态,对维持人体免疫稳态和抵御外来病原体入侵起到重要作用[10-11]。正常状态下,肠道共生菌群能够促进肠道黏膜上皮细胞的紧密连接和黏蛋白的表达,并且分泌一些抗菌肽物质,从而加强肠道黏膜的屏障作用。同时,这些共生菌群能够诱导肠道淋巴滤泡上皮细胞高度表达核苷酸结合寡聚化结构域蛋白1(NOD-1)及肠黏膜表面的Toll样受体(TLRs),由此促进肠相关淋巴组织(GALT)的产生和成熟,调节先天性和适应性免疫应答[12]。有研究表明,肠道菌群与T细胞的增殖分化有密切联系,共生菌能够通过下调T辅助细胞(TH)2的表达,维持TH1/TH2平衡,从而影响GALT功能[13]。另一项动物实验显示,不同的特定菌群可以诱导小鼠产生不同的免疫反应,特定梭菌属厌氧菌小鼠能够诱导FoxP3+调节性T细胞,而丝状细菌小鼠则能够促进TH17的增殖分化[14]。
如上所述,肠道微生态能够促进免疫系统发育,维持人体正常免疫功能。当正常肠道微生态和人体共生平衡状态被破坏,黏膜免疫就会被激活,从而引起一系列疾病。
肠道微生态异常与IgAN 肠道菌群与饮食、环境、宿主基因等因素直接相关,异常变化可导致肠道微生态与人体的共生状态被破坏,使有益菌数量及种类减少,致病菌数量及种类增加,破坏肠道黏膜屏障,最终导致疾病的产生,如空肠弯曲菌[15]、大肠杆菌[16]等致病菌数量增加均会导致IgAN的发生。一项动物实验证实,B细胞刺激因子(BAFF)转基因小鼠血清中含有较高水平的异常糖基化多聚体IgA(pIgA)和针对共生菌的特异IgA抗体,而这些异常糖基化pIgA最终可在肾小球系膜区沉积,导致IgAN[17]。
由于肠道微生态与人体是共生关系,IgAN亦会影响肠道菌群的变化。De Angelis等[18]发现与健康人群相比,IgAN患者粪便中共生菌的数量较对照组明显减少,如拟杆菌、乳杆菌、双歧杆菌等,而有害菌的数量增加,如大肠杆菌、放线菌等。有研究显示,慢性肾脏病(CKD)患者肠道菌群的种类、数量明显改变,循环中LPS水平明显升高,进一步证明肠道菌群在IgAN致病机制中占有重要地位。有研究表明,干酪乳杆菌治疗CKD患者后,虽然血肌酐水平无明显变化,但尿素氮水平明显降低(P=0.031),提示益生菌能够减少尿素氮及肠源性毒素,改善CKD患者的临床表现,但具体机制尚不明确[19]。目前,尚无临床研究证实益生菌在治疗IgAN患者中的作用,因此,需要进一步的实验研究。
肠道疾病与IgAN
除了食物成分和肠道微生态,肠道疾病与IgAN的关系也逐渐被人们重视。克罗恩病和溃疡性结肠炎等炎症性肠病患者常合并存在肾脏疾病,对83名炎症性肠病患者进行肾活检,发现24%的患者合并IgAN[20]。其他消化系统疾病如乳糜泻、肝脏疾病等也可导致继发性IgAN。乳糜泻患者继发IgAN的风险已经被证实,27 160例经小肠活检证实的乳糜泻患者跟踪随访39年发现,约0.026%的患者继发IgAN,虽然发病率较低,但经过校正后与对照组具有显著的统计学差异(P=0.02)[21]。这些继发性IgAN是否与原发性IgAN的发病机制一致,及这些肠道疾病是否加快IgAN进展,目前尚存在争议。
也有学者认为IgAN患者存在亚临床的炎症反应。在IgAN患者的十二指肠中观察到γδT细胞和αβT细胞、CD13+淋巴细胞、CD45RO+记忆性T细胞、CD15+HLA-DR(主要为Ⅱ型)、人类GroEL应激蛋白显著增多[22],而在其他腹部疾病中这些细胞也可增多。目前普遍认为,鱼油能够缓解炎症性肠病的症状、改善组织病变,有学者用鱼油治疗IgAN患者2年后,这些患者的三酰甘油及蛋白尿水平降低[23]。Smerud等[24]在此基础上应用主要在回盲部释放药物的一种新型肠道糖皮质激素——布地奈德(Nefecon®)治疗IgAN,6个月后,IgAN患者尿蛋白下降了40%。目前,他们对此进行了更大规模的临床研究。
肠道黏膜免疫异常导致IgAN的机制假说
IgAN患者的血液循环内及沉积于肾小球系膜区的IgA1是一种异常糖基化的IgA1[25],其在IgAN发病机制中的作用被广泛认同,但其来源仍存在争议。目前有不少学者倾向于来自黏膜。在健康成人中,黏膜免疫系统约占免疫系统的80%,且绝大部分为肠道黏膜,其产生的分泌型sIgA是黏膜参与体液免疫的最主要功能执行者。在抗原刺激下, GALT中具有免疫活性的原始B细胞迁移至黏膜固有层,从而分泌二聚体IgA1(dIgA1)或二聚体IgA2(dIgA2),这些二聚体再聚合形成多聚体IgA(pIgA),pIgA与多聚免疫球蛋白受体(pIgR)结合后被转运至肠上皮表面顶端,之后dIgA与pIgR中的分泌成分从结合物中分离,形成sIgA。同时,肠道黏膜上皮能够分泌其他小分子物质协同sIgA参与黏膜免疫反应,如α防御素和其他抗菌肽[26]。在一项对176例IgAN患者的研究中,31.25%的患者肾小球系膜区合并沉积sIgA,与非合并sIgA沉积的相比,肾小球系膜细胞增生显著,系膜细胞分泌白细胞介素6(IL-6)、IL-8、MCP-1、转化生长因子β1(TGF-β1)等炎性因子显著多,但与肾小球系膜区合并存在pIgA的患者相比,肾小球系膜细胞增生及炎性因子分泌作用均较弱[27]。由此可见,sIgA在IgAN发病机制中占有重要地位。
异常糖基化IgA1,可与IgG抗体和IgA1抗体形成包含异常糖基化IgA1的免疫复合物。同时,由于肝细胞或网状内皮细胞功能障碍,免疫复合物清除减少[28],且与肾小球系膜细胞结合能力较强,能够刺激细胞增生和产生细胞因子(如IL-6,TGF-β等)[29],导致系膜细胞过度增生,加重IgAN患者的肾脏损害。麦胶蛋白致肠道黏膜损伤时,异常糖基化的IgA1可以与骨髓源性IgA受体FcαRI或CD89结合形成循环免疫复合物沉积于肾小球系膜区,sCD89直接与肾小球系膜的TfR1结合,刺激系膜细胞表达TGase2,使TfR1表达上调,导致血尿、蛋白尿[30]。正常状态下,肠道黏膜表面表达的TLRs结合革兰阴性菌外膜的磷脂(LPS),有助于肠道黏膜损伤的修复,但肠道菌群失调时,肠道黏膜屏障损伤不易修复,LPS被大量吸收进入血液循环。有学者将IgAN患者外周血B淋巴细胞在体外培养发现,细菌LPS能够激活淋巴细胞表面TRL4,诱导Cosmc分子伴侣甲基化,降低半乳糖转移酶活性,导致IgA1的异常糖基化。由此可以推测,肠道菌群失调时LPS和半乳糖缺陷IgA存在一定的相关性[31]。肠道炎症时,LIGHT(Lymphotoxin-like,exhibits inducible expression,and competes with HSV glycoprotein D for HVEM,a receptor expressed by T lymphocytes)作为一种新型肿瘤坏死因子超家族成员,能够刺激肠道黏膜大量分泌IgA,同时使有缺陷的IgA进入肠腔中,引起血液循环中异常糖基化的IgA1增多,最终导致IgAN[32]。
以上假说虽进一步阐释了“肠-肾关联”学说,但多数IgAN患者的肠道表现并不明显,且多以呼吸道感染诱发,另外,目前主流观点仍是认为肾组织中的异常糖基化IgA1来自于骨髓,此假说与之不符。此假说有待于进一步的实验及临床研究验证。
基因学证据
许多研究发现,IgAN的发生与基因异常密切相关。迄今为止,已有三项全基因组关联研究(GWAS)发现了IgAN易感基因位点[33]。近期的GWAS研究发现,HLA-DQ/DR、CARD9和HORMAD2基因位点是炎症性肠病和IgAN共同的易感位点,DEFA、TNFSF13、VAV3、ITGAM-ITGAX和PSMB8基因位点与维持正常肠道黏膜免疫有关,同时也是IgAN的易感基因位点[34]。从基因学角度可以推测,这些易感基因的异常表达会导致肠道黏膜免疫异常,同时使IgAN的患病概率增加,但这项研究结果并未进行体内外实验证实。虽然如此,但基于现有的GWAS研究结果已经可以合理地提出一种新的假设,即肠道黏膜免疫功能异常在IgAN的发病机制中占有重要位置。
小结:越来越多的组织免疫学、基因学证据表明,肠道黏膜免疫功能异常参与IgAN的发生发展。食物抗原刺激、肠道菌群失调及肠道疾病都能够损伤肠道黏膜屏障,使肠道通透作用增强,毒素吸收入血,促进B细胞迁移至黏膜固有层分泌sIgA,继而导致异常糖基化IgA1形成的循环免疫复合物增加并沉积于肾小球系膜区,诱发IgAN(图1)。但目前争议较多的是两者是否具有相同的发病机制,或是肠道黏膜免疫功能异常促进了原本存在的IgAN的进展,但无论哪种假说都表明肠道黏膜免疫功能异常与IgAN是紧密联系的。通过调节肠道黏膜免疫功能来预防或改善IgAN预后,可能成为一种新的治疗方法,但这仍需要长期大量的基础实验和临床研究加以证实。
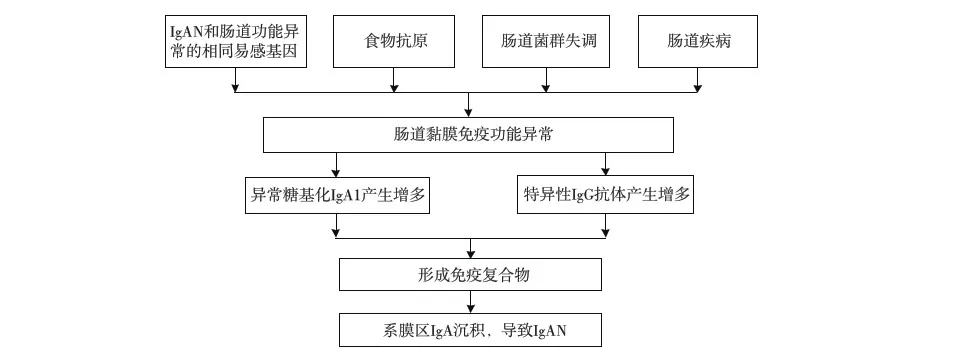
图1 肠道黏膜免疫异常致IgA肾病(IgAN)的机制
1 黎磊石,刘志红,张馨.IgA肾病∥黎磊石,刘志红.中国肾脏病学.北京:人民军医出版社,2008:442-464.
2 Li LS,Liu ZH.Epidemiologic data of renal diseases from a single unit in China:analysis based on 13 519 renal biopsies.Kidney Int,2004,66(3):920-923.
3 Roberts IS.Pathology of IgA nephropathy.Nat Rev Nephrol,2014,10(8):445-454.
4 Coppo R.The intestine-renal connection in IgA nephropathy.Nephrol Dial Transplant,2015,30(3):360-366.
5 Coppo R,Mazzucco G,Martina G,et al.Gluten-induced experimental IgA glomerulopathy.Lab Invest.1989 Apr;60(4):499-506.
6 Feehally J,Beattie TJ,Brenchley PE,et al.Response of circulating immune complexes to food challenge in relapsing IgA nephropathy.Pediatr Nephrol,1987,1(4):581-586.
7 Smerud HK,Fellström B,Hällgren R,et al.Gluten sensitivity in patients with IgA nephropathy.Nephrol Dial Transplant,2009,24(8):2476-2481.
8 Coppo R,Roccatello D,Amore A,et al.Effects of a gluten-free diet in primary IgA nephropathy.Clin Nephrol,1990,33(2):72-86.
9 Papista C,Lechner S,Ben Mkaddem S,et al.Gluten exacerbates IgA nephropathy in humanized mice through gliadin-CD89 interaction.Kidney Int,2015,88(2):276-285.
10 Hooper LV,Gordon JI.Commensal host-bacterial relationships in the gut.Science,2001,292(5519):1115-1118.
11 Anders HJ,Andersen K,Stecher B.The intestinal microbiota,a leaky gut,and abnormal immunity in kidney disease.Kidney Int,2013,83(6):1010-1016.
12 Bouskra D,Brézillon C,Bérard M,et al.Lymphoid tissue genesis induced by commensals through NOD1 regulates intestinal homeostasis.Nature,2008,456(7221):507-510.
13 Bouskra D,Brézillon C,Bérard M,et al.Lymphoid tissue genesis induced by commensals through NOD1 regulates intestinal homeostasis.Nature,2008,456(7221):507-510.
14 Ivanov II,Atarashi K,Manel N,et al.Induction of intestinal Th17 cells by segmented filamentous bacteria.Cell,2009,139(3):485-498.
15 聂镜江,刘志红,黎磊石.空肠弯曲杆菌诱发大鼠IgA肾病——肠道感染诱发IgA肾病的作用探讨.医学研究生学报,1990(4):328-331.
16 韩庆烽,范敏华,邹万忠.大肠杆菌致IgA肾病的实验动物模型.北京医科大学学报,1998,30(1):85-85.
17 McCarthy DD,Kujawa J,Wilson C,et al.Mice overexpressing BAFF develop a commensal flora-dependent,IgA-associated nephropathy.J Clin Invest,2011,121(10):3991-4002.
18 De Angelis M,Montemurno E,Piccolo M,et al.Microbiota and metabolome associated with immunoglobulin A nephropathy (IgAN).PLoS One,2014,9(6):e99006.
19 Miranda Alatriste PV,Urbina Arronte R,Gómez Espinosa CO,et al.Effect of probiotics on human blood urea levels in patients with chronic renal failure.Nutr Hosp,2014,29(3):582-590.
20 Ambruzs JM,Walker PD,Larsen CP.The histopathologic spectrum of kidney biopsies in patients with inflammatory bowel disease.Clin J Am Soc Nephrol,2014,9(2):265-270.
21 Welander A,Sundelin B,Fored M,et al.Increased risk of IgA nephropathy among individuals with celiac disease.J Clin Gastroenterol,2013,47(8):678-683.
22 Rantala I1,Collin P,Holm K,Kainulainen H,et al.Small bowel T cells,HLA class II antigen DR,and GroEL stress protein in IgA nephropathy.Kidney Int.1999 Jun;55(6):2274-80.
23 Donadio JV,Grande JP.The role of fish oil/omega-3 fatty acids in the treatment of IgA nephropathy.Semin Nephrol,2004,24(3):225-243.
24 Smerud HK,Bárány P,Lindström K,et al.New treatment for IgA nephropathy:enteric budesonide targeted to the ileocecal region ameliorates proteinuria.Nephrol Dial Transplant,2011,26(10):3237-3242.
25 Tomana M,Novak J,Julian BA,et al.Circulating immune complexes in IgA nephropathy consist of IgA1 with galactose-deficient hinge region and antiglycan antibodies.J Clin Invest,1999,104(1):73-81.
26 Czerkinsky C,Anjuere F,McGhee JR,et al.Mucosal immunity and tolerance:relevance to vaccine development.Immunol Rev,1999,170:197-222.
27 Floege J,Feehally J.The mucosa-kidney axis in IgA nephropathy.Nat Rev Nephrol,2016,12(3):147-156.
28 Otani M,Nakata J,Kihara M,et al.O-glycosylated IgA rheumatoid factor induces IgA deposits and glomerulonephritis.J Am Soc Nephrol,2012,23(3):438-446.
29 Novak J,Julian BA,Tomana M,et al.IgA glycosylation and IgA immune complexes in the pathogenesis of IgA nephropathy.Semin Nephrol,2008,28(1):78-87.
30 Berthelot L,Papista C,Maciel TT,et al.Transglutaminase is essential for IgA nephropathy development acting through IgA receptors.J Exp Med,2012,209(4):793-806.
31 Qin W,Zhong X,Fan JM,et al.External suppression causes the low expression of the Cosmc gene in IgA nephropathy.Nephrol Dial Transplant,2008,23(5):1608-1614.
32 Wang J,Anders RA,Wu Q,et al.Dysregulated LIGHT expression on T cells mediates intestinal inflammation and contributes to IgA nephropathy.J Clin Invest,2004,113(6):826-835.
33 Kiryluk K,Novak J.The genetics and immunobiology of IgA nephropathy.J Clin Invest,2014,124(6):2325-2332.
34 Kiryluk K,Li Y1,Scolari F2,et al.Discovery of new risk loci for IgA nephropathy implicates genes involved in immunity against intestinal pathogens.Nat Genet,2014,46(11):1187-1196.
(本文编辑 律 舟)
The intestinal mucosal immune dysfunction and IgA nephropathy
YANGNannan,WANGJinquan
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
IgA nephropathy (IgAN) is the most common primary glomerulonephritis in China, but its exact etiology and pathogenesis are still unclear. However, more and more evidences show that the abnormality of intestinal mucosal immunity plays an important role in IgAN. Various studies imply that dysregulated intestinal mucosal immunity caused by dietary components, intestinal microbiota and intestinal diseases can promote the production of secretary IgA (sIgA), which is eventually deposited in the glomerular mesangium, and then cause IgAN. Therefore, we will discuss the pathogenic mechanism of intestinal mucosal immune dysfunction in IgA nephropathy.
IgA nephropathy intestinal mucosal dietary components intestinal microbiota intestinal disease
10.3969/cndt.j.issn.1006-298X.2016.05.015
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 硕士研究生(杨楠楠) 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2016-05-13
