Toll样受体9的功能及其致病机制
2016-06-01鲍文朵娜综述施少林审校
鲍文朵娜 综述 施少林 审校
·基础医学·
Toll样受体9的功能及其致病机制
鲍文朵娜 综述 施少林 审校
Toll样受体9(TLR9)是Toll样模式识别受体家族成员之一,表达于免疫细胞,通过与细菌DNA作用而诱导机体的固有免疫反应。近年来的研究发现,TLR9也表达于其他几种非免疫细胞,包括肾小球足细胞,并以线粒体DNA为配体,激活细胞的损伤信号通路,从而参与细胞损伤。本文就TLR9在免疫和非免疫细胞中的作用及其机制作一综述。
Toll样受体9 固有免疫 线粒体DNA 足细胞
机体固有免疫系统也被称为非特异性免疫系统或先天免疫系统[1],是经过长期进化形成的机体的防御机制之一,存在于多细胞生物并在病原体入侵时发挥非特异性免疫应答作用。固有免疫主要功能是通过感知微环境变化,生产细胞因子、激活补体级联、识别和除去存在于器官的外来物质、以及通过抗原呈递的方法活化适应性免疫系统[2]。
炎症过程中产生组胺、缓激肽、血清素、白三烯及前列腺素等,能引起局部血管扩张及吸引中性粒细胞等吞噬细胞,继而招募其他类型的免疫细胞。这些细胞吞噬病原体颗粒,并通过内体(endosomes)将它们与溶酶体融合,杀死和消化病原体或颗粒[3]。
固有免疫细胞可通过表面模式识别受体(PRR)对病原体进行识别并产生应答。PRR是指单核/巨噬细胞和树突状细胞等固有免疫细胞表面或胞内细胞器膜上能够识别病原体某些共有特定分子结构的受体。病原相关分子模式(PAMPs)即PRR的配体,是病原体及其产物所共有的高度保守的特定分子结构。PAMPs种类有限,但在病原微生物中广泛分布,主要包括G-菌的脂多糖、G+菌的肽聚糖和脂磷壁酸、细菌或病毒非甲基化胞嘧啶-磷酸-鸟嘌呤(CpG)DNA和病毒双股/单股RNA(dsRNA/ssRNA)等。病原相关分子模式对机体而言是外源性有害因子;而由各种原因导致体内组织细胞损伤所产生的,如高迁移率族蛋白1(HMGB1),热休克蛋白(HSP)、线粒体自身合成蛋白、DNA和RNA等,则为内源性有害因子。当机体损伤的时候,这些被称为损伤相关模式分子(DAMPs)的内源性有害因子能刺激免疫细胞产生应答。在固有免疫应答中,Toll样受体及其信号通路是介导免疫细胞产生固有免疫应答的极为重要的机制。
Toll样受体家族
Toll样受体 (TLR)家族是一类重要的表面模式识别受体,在先天免疫系统中发挥关键作用。人类TLR家族已发现10个成员(TLR 1-10),可分为两类,即表达于细胞膜上的TLR 1、2、4、5、6,以及表达于胞内细胞器(如内体/吞噬溶酶体)膜上的TLR 3、7、8、9。前者主要识别病原微生物表面某些共有的特定分子结构;后者主要识别胞质中病毒双/单链RNA(ds/ssRNA)和胞质中细菌或病毒非甲基化CpG DNA,进而触发髓样分化因子88(MyD88)依赖或非依赖的信号转导途径,诱导产生促炎症细胞因子和Ⅰ型干扰素活化[4]。TLR因其识别多种病原体而被证实为重要的模式识别受体。机体在受到细菌,病毒和真菌的侵袭时,TLRs可识别其PAMPs,从而有效地参与炎症反应[5]。
TLRs为Ⅰ型跨膜(TM)蛋白,胞外富含亮氨酸重复序列(LRR),负责识别并作用于相应配体[6]。通过LRR短链堆积平行排列,堆积的LRR形成重复结构单元的超级螺旋装置(称为螺线管的线圈)(图1)。跨膜(TM)区由一段疏水性氨基酸残基构成。在细胞质的区段则被称为Toll-白细胞介素1受体(TIR)结构域,因为该区段与IL-1受体家族成员的信号域具有同源性。当Toll样受体识别PAMPs后,两个TLR分子的TIR结构域形成二聚体(图1),再将信号传递至下游分子。
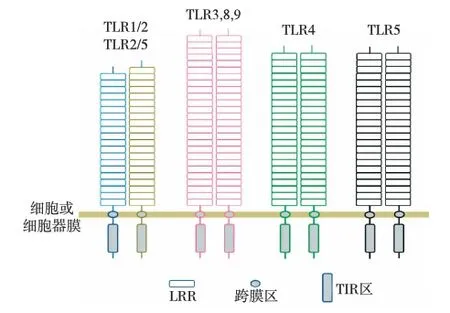
图1 TLR受体的分子结构及其二聚体形成TLR:Toll样受体;LRR:高含量氨酸重复序列;TIR:Toll-白细胞介素1受体结构域
TLR9及其配体在固有免疫中的作用
细菌DNA对哺乳动物具有免疫刺激作用,其主要活性区是非甲基化的CpG序列[7],但细菌CpG DNA刺激免疫细胞的分子机制一直未阐明。日本学者Hemmi等[8]在2000年通过BLAST搜索,发现一段表达序列标签(EST),该序列与已知的TLRs高度相似。他们利用该片段作为探针,从小鼠巨噬细胞中分离出全长互补DNA,发现该基因编码的蛋白与TLR家族其他成员一样,包含LRR,跨膜和TIR等保守的结构域,由此发现一个新的Tolls家族成员,即TLR9;同时发现TLR9正是识别细菌非甲基化的CpG DNA并介导其免疫刺激活性的受体。最近,非甲基化CpG DNA与TLR9识别和结合的分子基础通过结构生物学研究已经得到解析[9]。
作为TLR家族成员之一,TLR9也是Ⅰ型跨膜蛋白,由胞外区,跨膜区和胞内区组成。MyD88是TLR9和其他TLRs的衔接分子(图2)[10];当TLR9和其他TLRs被配体激活后,MyD88将TIR二聚体与IRAK蛋白激酶连接,后者磷酸化激活泛素连接酶(TRAF6),再经多步反应(图2)[10],导致转录因子核转,包括核因子κB(NF-κB)和激活蛋白1(AP-1),以及宿主对病原体的免疫应答。近年来的一些报道称TLR9在与配体结合后有诱导凋亡的潜力(见下文)。
除了以细菌/病毒等DNA的非甲基化CpG为配体外,近年来发现真核细胞线粒体DNA也能作为TLR9的配体,并在免疫细胞中诱导固有免疫应答。
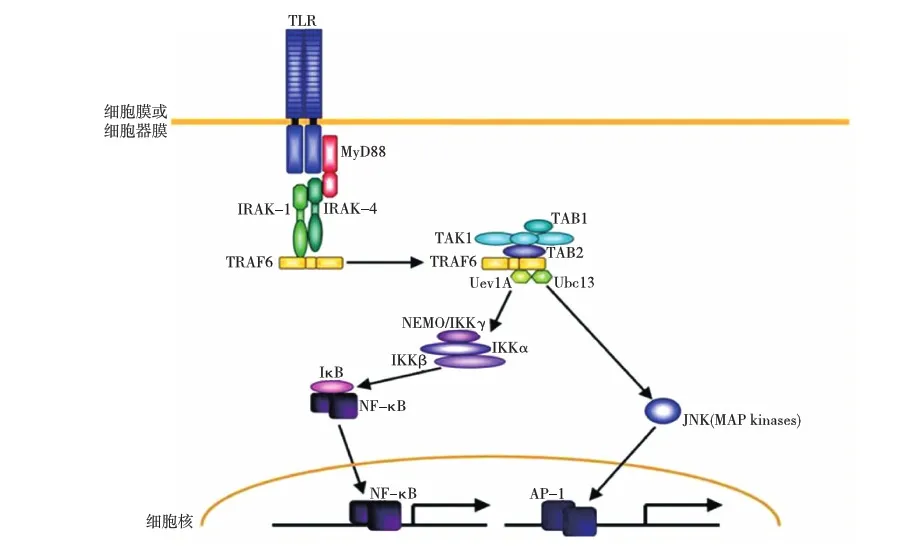
图2 TLR9及其他TLRs依赖MyD88的信号通路[10]TLR:Toll样受体;MyD88:髓样分化因子88;IRAK:蛋白酶;TRAF:泛素连接酶;TAK:β激活激酶;TAB:接头蛋白;Uev1A/Ubc13:RING型(E3)泛素连接酶与泛素缀合酶(E2)蛋白复合体;NEMO/IKK-γ:IκB激酶,包括IKKα、IKKβ;JNK(MAP kinases):促细胞分裂原活化蛋白酶;NF-κB:核因子κB;IκB:NF-κB抑制蛋白;AP-1:激活蛋白1
真核细胞的线粒体与原核细胞有诸多相似性。研究推测真核细胞的线粒体起源于大约15亿年前,由古生真核细胞内的共生生物古细菌进化而来,是哺乳动物除细胞核以外唯一包含自己DNA的细胞器。人类线粒体DNA(mtDNA)是由16 569个核苷酸组成的闭合环状分子,存在于线粒体内膜,携带蛋白编码基因,这些线粒体自己编码和合成的蛋白主要参与氧化磷酸化,产生ATP及活性氧(ROS)[11]。
mtDNA在化学组成上仍保留着原核细菌的特性,即胞嘧啶-磷酸-鸟嘌呤(CpG)序列不被甲基化修饰[12]。这一特性使mtDNA像细菌DNA一样,能作用于树突状细胞内TLR9,激活丝裂原活化蛋白激酶p38(p38 MAPK)和NF-κB信号通路,诱导细胞的固有免疫应答[13-14]。同样,在巨噬细胞也存在类似的机制,并参与肺部炎症的发生[15]。
有趣的是,在机体遭到创伤时,损伤细胞的线粒体DNA可以释放并进入循环[16],被认为可能参与创伤导致的全身炎症反应综合征[13]。
TLR9/mtDNA 的致病作用
系统性红斑狼疮(SLE) 近来,有研究提示mtDNA和TLR9在SLE发病机制中起着某种作用。嗜中性粒细胞的胞外诱捕网(NETs)在SLE发病起很重要的作用。NETs的DNA被认为是细胞核来源的,并且是抗DNA抗体生成的主要抗原。有趣的是有研究者发现NET-mtDNA与血清抗线粒体抗体以及Ⅰ型IFN应答的存在和疾病活性相关[17],有40%的SLE患者中检测到抗线粒体抗体存在,并与狼疮性肾炎(LN)活动性相关,提示 NET/mt DNA可能参与SLE的发生。SLE患者的抗线粒体抗体可能与经典的抗双链DNA抗体有相当的生物标记的价值[17]。
近年来还有研究发现SLE患者嗜中性粒细胞可导致Ⅰ型干扰素生成。而核解离的过程中当暴露SLE嗜中性粒细胞以及健康的IFN-致敏嗜中性粒细胞时可以以抗核糖蛋白的自身抗体抑制线粒体转录因子(TFAM)磷酸化,因此类核氧化(Ox)残基在线粒体内积累,并最终形成有效的干扰素基因复合物。线粒体保留类核Ox是SLE血嗜中性粒细胞的一个特点,并且针对自身抗体抗Ox mtDNA只有一小部分存在于患者。该途径为人类SLE提供了一种新的治疗靶标[18]。
高血压病 有研究利用妊娠高血压大鼠模型,发现mtDNA可能通过TLR9促进先兆子痫的发生。推测孕产妇因滋养层细胞的大量坏死,导致循环mtDNA水平显著升高,经由TLR9信号介导的免疫应答反应,造成全身母体炎症和血管功能障碍,导致高血压和宫内生长受限等先兆子痫症状[19]。
高血压可引起细胞缺氧,线粒体生存能力受损,细胞早期凋亡增加,循环中mtDNA含量升高,以及自噬和蛋白质降解减少。TLR9能活化环氧酶(COX)和p38蛋白,增加ROS生成,以及减少NO生物利用度;而从损伤的细胞释放mtDNA可能和局部缺血引起的事件前馈级联,与TLR9结合,促进血管反应功能的失调和动脉血压升高[20]。
心肌炎症和心肌细胞损伤 除了在树突状细胞等免疫细胞中表达的TLR9能利用mtDNA为配体产生固有免疫应答外[13],近来研究发现若干非免疫细胞同样表达TLR9,也同样能利用mtDNA为配体,激活TLR9信号通路并导致炎症和细胞损伤。在正常细胞中,衰老、损伤或功能失调的线粒体是通过自噬被清除。细胞自噬的过程包含自噬体对线粒体的吞噬,然后与溶酶体融合形成自溶酶体[21-22],而mtDNA则被溶酶体特异表达的DNA酶II(Dnase2)降解。
心肌炎症是心脏衰竭的重要特征和促进因素。然而,造成心肌炎症的机制一直不清楚。最近Oka等[23]根据心肌细胞表达TLR9,以及线粒体DNA能像细菌DNA一样作为TLR9的配体,从而猜测在疾病状态下心肌细胞内mtDNA可能激活TLR9信号通路,导致炎症反应。为证实这一假说,作者制作了血流动力压力性的心肌损伤小鼠模型,观察到mtDNA在心肌细胞自噬溶酶体的转移、积累以及与TLR9的共定位;而在正常小鼠中,由于基础水平的线粒体自噬作用,心肌细胞自噬-溶酶体中的DNA酶II能消化线粒体DNA,可防止TLR9激活和炎症反应的发生。当敲除小鼠心肌细胞DNA酶II基因后,该损伤模型中的小鼠死亡率增加,心肌炎加重,心肌细胞扩张更加显著,证明从自噬逃逸出的线粒体DNA可结合TLR9并诱导心肌炎症以及心肌细胞损伤。此外,TLR9基因敲除小鼠表现出显著的抵抗血流动力性压力诱导的心肌损伤,进一步证明了mtDNA/TLR9在心肌细胞的损伤作用。
急性肺挫伤 研究者利用建立的TLR9全基因敲除型(TLR-9-/-)小鼠模型,以野生型小鼠为对照组建立单侧闭合性胸挫伤模型,观察到TLR-9-/-小鼠与对照组相比,白蛋白水平,释放的促炎性细胞因子(IL-1β,IL-6,KC)的水平,巨噬细胞趋化蛋白5(MCP-5)的水平,招募的肺泡巨噬细胞以及中性粒细胞浸润均显著低于对照组。而免疫组织化学染色结果也显示对照组相比TLR-9-/-小鼠损伤较为严重。提示TLR9在肺挫伤后的肺损伤以及炎症发展中起着重要功能[24]。
肾小管损伤 关于TLR9在非免疫细胞中的作用,有研究者也对于TLR9在肾小管损伤中的作用进行了研究。在LN患者的肾小管间质中TLR9表达均较正常人群高。在LN小鼠模型中TLR9与蛋白尿及肾小管损伤程度相关,并发现与细胞周期蛋白依赖性激酶抑制剂相关。研究者通过TLR9组织化学染色发现,蛋白尿以及肾小管损伤程度降低的时候,可避免TLR9在该模型肾小管中表达。并且发现从SLE患者来源的表达TLR9的肾小管细胞中可以纯化得到DNA免疫复合物。这提示TLR9在肾小管细胞中被激活,与肾小管间质炎以及损伤具有相关性[25-26]。
肾小球足细胞损伤 在正常人的肾小球足细胞中不表达TLR9。但有研究证实LN时足细胞中存在TLR9表达,而且TLR9表达的变化与病情相关[27]。此外,TLR9表达与足细胞synaptopodin,nephrin,podocin等关键蛋白呈负相关,提示TLR9可能参与LN患者足细胞损伤[22]。在其他几种常见的肾小球疾病,如FSGS和IgAN等的部分患者中,也检测到TLR9的表达[28-30]。
我们对TLR9在足细胞损伤中的作用及其机制进行了系统研究,发现TLR9也能活化足细胞中的p38 MAPK和NFκB信号通路,而这两条信号通路被他人先前研究证明能介导足细胞凋亡。TLR9 干扰RNA(siRNA)能降低嘌呤霉素氨基核苷(PAN)诱导的NFκB p65和p38的活化及细胞凋亡。我们还观察到PAN可诱导线粒体DNA转移并积累于溶酶体,提示PAN诱导的足细胞损伤可能有mtDNA的参与。通过溶酶体特异的DNA酶Ⅱ的过表达或siRNA干扰,以操控溶酶体内线粒体DNA含量,证实了TLR9可通过识别内源性线粒体DNA,促进足细胞凋亡。我们的研究揭示了一种足细胞损伤的新机制,即在损伤因素的作用下,足细胞开始表达TLR9并伴随内源性线粒体DNA向溶酶体的转移,线粒体DNA作用于TLR9,导致促凋亡的p38和NF-κB通路的激活,从而促进足细胞凋亡[31]。
小结:TLR9的配体主要来源于细菌/病毒DNA和mtDNA。细菌/病毒DNA诱导的TLR9信号是机体的固有免疫机制之一,能帮助机体抵御感染等致病因素;而mtDNA配体诱导的TLR9信号似乎总是对机体有害,可导致组织炎症,或者直接促进细胞损伤。因此,mtDNA和TLR9有可能成为多种疾病潜在治疗靶点。
1 Deretic V,Levine B.Autophagy,immunity,and microbial adaptations.Cell Host Microbe,2009,5(6):527-549.
2 Alvarado AG,Lathia JD.Taking a Toll on Self-Renewal:TLR-Mediated Innate Immune Signaling in Stem Cells.Trends Neurosci,2016,39(7):463-471.
3 Duann P,Lianos EA,Ma J,et al.Autophagy,Innate Immunity and Tissue Repair in Acute Kidney Injury.Int J Mol Sci,2016,17(5).pii:E662.
4 Mahla RS,Reddy MC,Prasad DV,et al.Sweeten PAMPs:Role of Sugar Complexed PAMPs in Innate Immunity and Vaccine Biology.Front Immunol,2013,4:248.
5 Akira S,Takeda K.Toll-like receptor signalling.Nat Rev Immunol,2004,4(7):499-511.
6 Barton GM,Medzhitov R.Toll-like receptor signaling pathways.Science,2003,300(5625):1524-1525.
7 Hartmann G,Weiner GJ,Krieg AM.CpG DNA:a potent signal for growth,activation,and maturation of human dendritic cells.Proc Natl Acad Sci U S A,1999,96(16):9305-9310.
8 Hemmi H,Takeuchi O,Kawai T,et al.A Toll-like receptor recognizes bacterial DNA.Nature,2000,408(6813):740-745.
9 Ohto U,Shibata T,Tanji H,et al.Structural basis of CpG and inhibitory DNA recognition by Toll-like receptor 9.Nature,2015,520(7549):702-705.
10 Takeda K,Akira S.TLR signaling pathways.Semin Immunol,2004,16(1):3-9.
11 Henze K,Martin W.Evolutionary biology:essence of mitochondria.Nature,2003,426(6963):127-128.
12 Hochhauser D.Relevance of mitochondrial DNA in cancer.Lancet,2000,356(9225):181-182.
13 Zhang Q,Raoof M,Chen Y,et al.Circulating mitochondrial DAMPs cause inflammatory responses to injury.Nature,2010,464(7285):104-107.
14 Zhang Q,Itagaki K,Hauser CJ.Mitochondrial DNA is released by shock and activates neutrophils via p38 map kinase.Shock,2010,34(1):55-59.
15 Gu X,Wu G,Yao Y,et al.Intratracheal administration of mitochondrial DNA directly provokes lung inflammation through the TLR9-p38 MAPK pathway.Free Radic Biol Med,2015,83:149-158.
16 Lam NY,Rainer TH,Chiu RW,et al.Plasma mitochondrial DNA concentrations after trauma.Clin Chem,2004,50(1):213-216.
17 Wang H,Li T,Chen S,et al.Neutrophil Extracellular Trap Mitochondrial DNA and Its Autoantibody in Systemic Lupus Erythematosus and a Proof-of-Concept Trial of Metformin.Arthritis Rheumatol,2015,67(12):3190-3200.
18 Caielli S,Athale S,Domic B,et al.Oxidized mitochondrial nucleoids released by neutrophils drive type I interferon production in human lupus.J Exp Med,2016,213(5):697-713.
19 Goulopoulou S,Matsumoto T,Bomfim GF,et al.Toll-like receptor 9 activation:a novel mechanism linking placenta-derived mitochondrial DNA and vascular dysfunction in pre-eclampsia.Clin Sci (Lond),2012,123(7):429-435.
20 McCarthy CG,Wenceslau CF,Goulopoulou S,et al.Circulating mitochondrial DNA and Toll-like receptor 9 are associated with vascular dysfunction in spontaneously hypertensive rats.Cardiovasc Res,2015,107(1):119-130.
21 Yu L,McPhee CK,Zheng L,et al.Termination of autophagy and reformation of lysosomes regulated by mTOR.Nature,2010,465(7300):942-946.
22 Carchman EH,Whelan S,Loughran P,et al.Experimental sepsis-induced mitochondrial biogenesis is dependent on autophagy,TLR4,and TLR9 signaling in liver.FASEB J,2013,27(12):4703-4711.
23 Oka T,Hikoso S,Yamaguchi O,et al.Mitochondrial DNA that escapes from autophagy causes inflammation and heart failure.Nature,2012,485(7397):251-255.
24 Madathilparambil SV,Thomas B,Dolgachev VA,et al.Toll Like Receptor-9 (TLR9) is Requisite for Acute Inflammatory Response and Injury Following Lung Contusion.Shock,2016 Feb 29 [Epub ahead of print] .
25 Benigni A,Caroli C,Longaretti L,et al.Involvement of renal tubular Toll-like receptor 9 in the development of tubulointerstitial injury in systemic lupus.Arthritis Rheum,2007,56(5):1569-1578.
26 Anders HJ,Banas B,Schlöndorff D.Signaling danger:toll-like receptors and their potential roles in kidney disease.J Am Soc Nephrol,2004,15(4):854-867.
27 Machida H,Ito S,Hirose T,et al.Expression of Toll-like receptor 9 in renal podocytes in childhood-onset active and inactive lupus nephritis.Nephrol Dial Transplant,2010,25(8):2530-2537.
28 Papadimitraki ED,Tzardi M,Bertsias G,et al.Glomerular expression of toll-like receptor-9 in lupus nephritis but not in normal kidneys:implications for the amplification of the inflammatory response.Lupus,2009,18(9):831-835.
29 Batsford S,Duermueller U,Seemayer C,et al.Protein level expression of Toll-like receptors 2,4 and 9 in renal disease.Nephrol Dial Transplant,2011,26(4):1413-1416.
30 Frieri M,Samih MA,Dzhindzhikhashvili M,et al.Toll-like receptor 9 and vascular endothelial growth factor levels in human kidneys from lupus nephritis patients.J Nephrol,2012,25(6):1041-1046.
31 Bao W,Xia H,Liang Y,et al.Toll-like Receptor 9 Can be Activated by Endogenous Mitochondrial DNA to Induce Podocyte Apoptosis.Sci Rep,2016,6:22579.
(本文编辑 青 松 加 则)
Functions of toll-like receptor 9 and underlying mechanism
BAOWenduona,SHIShaolin
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Toll-like Receptor 9 (TLR9) is a member of Toll-like receptor family that use pathogen associated molecule patterns (PAMPs) as ligands. It is expressed in immune cells and senses bacterial DNA ligand to induce innate immune response. Recent studies have shown that TLR9 is also expressed in several non-immune cells,including glomerular podocyte, and uses mitochondrial DNA as ligand to activate signaling pathways that lead to cell injury. Here, we will review the roles of TLR9 in immune cells and non-immune cells and the underlying mechanisms.
TLR9 innate immunity mitochondrial DNA podocytes
10.3969/cndt.j.issn.1006-298X.2016.05.012
国家自然科学基金(81370827),江苏省自然科学基金(BK20131324)
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2016-05-20
