移植肾BK病毒肾病发病机制及治疗
2016-06-01谢轲楠综述陈劲松审校
谢轲楠 综述 陈劲松 审校
·肾脏移植·
移植肾BK病毒肾病发病机制及治疗
谢轲楠 综述 陈劲松 审校
BK病毒(BKV)可导致移植肾BKV相关性肾病,造成移植物的丢失。BKV潜伏在泌尿道中,可能通过移植由供肾传染给受者,并在受者体内激活,在肾小管上皮细胞的细胞核内复制。子代BKV逸出并感染其他肾小管上皮细胞,造成病毒播散。BKV感染的机制和动力学还有待阐明。BKV感染的治疗主要有两个途径:一是减少免疫抑制剂,其弊端是易引发排斥反应;二是使用抗病毒药物,但疗效尚有争议。了解早期病毒感染方式,有助于研发有效的抗病毒药物。本文着力于阐述BKV对人体靶细胞的入侵和细胞间传播途径,并基于BKV感染肾脏细胞的机制,探讨可能有效的治疗方法。
BK病毒 他汀 细胞受体 肾移植
BK病毒(BKV)概述
BKV是隶属于多瘤病毒科的双链DNA病毒。已知的多瘤病毒主要有3种:即BKV、 JC病毒(JCV)和类人猿空泡病毒(SV40)[1]。有文献报道,>80%的人群存在BKV感染,50%的正常人群肾脏潜伏有BKV[2]。病毒在体内最常见潜伏部位是肾脏和尿路上皮细胞,但正常免疫力人群并无临床表现。病毒的再激活首先表现为无症状病毒尿症,在肾移植受者,则可能表现为BKV肾病(BKVN)[3]。现有研究表明,在宿主免疫抑制状态下,病毒的再激活可导致尿路上皮细胞病变,从而导致尿路有更多的BKV脱落[4]。本文将讨论BKVN的临床表现和病毒感染肾脏细胞的机制,探讨可能有效的治疗。
BKVN的临床表现和诊疗现状
临床表现 BKVN常表现血清肌酐升高,可不伴随其他症状[5]。在出现血清肌酐升高之前,实验室检查可发现BKV在尿中和血中的复制增加,即BKV尿症和BKV血症,两者均与BKVN有一定的相关性,但10%~40%的非BKVN肾移植受者存在BKV复制。BKVN其他的临床表现包括尿路梗阻和出血性膀胱炎,有报道显示,来源于膀胱的上行感染可导致移植肾输尿管狭窄和尿路梗阻,大量病毒负荷可能导致出血性膀胱炎,并可能成为BKVN的首发表现[6]。
诊断 在BKVN患者尿液中可检出decoy细胞,decoy细胞实质上是指含有BKV包涵体脱落的肾小管上皮细胞。尿液中检测到decoy细胞,能够100%的反映泌尿系统有BKV复制,但仅据此还不能诊断BKVN。尿中检出decoy细胞对诊断BKVN仅有29%的阳性预测价值[7]。通过病毒DNA检测或病毒蛋白1(VP-1)mRNA定量检测,来检查血浆和尿液中的病毒载量,是诊断BKVN的一种无创性方法[7]。目前普遍认为,尿BKV定量>107拷贝/ml或血浆BKV定量>104拷贝/ml与移植肾活检证实的BKVN有很好的相关性[4]。移植肾活检是BKVN诊断的金标准,其病理改变包括:病毒感染导致的肾小管上皮细胞、肾小球、集合管细胞的细胞学改变,表现为间质炎症和不同程度的萎缩和纤维化[7]。这些组织学改变可能是局灶的,或仅局限于髓质,故如果移植肾活检仅取材1处,有1/3的病例可能被漏诊[8]。因此建议疑诊移植肾BKVN者,移植肾活检取材应至少两处,且包含髓质。如果病理中未见细胞毒性改变而临床又高度怀疑,可进一步进行SV40大T抗原免疫组化染色(BKV与其有交叉反应,能够显色)。免疫组化染色,也有助于将BKVN与急性排斥鉴别开来[8]。
现有治疗手段及预后 BKV感染的治疗目标是清除病毒、保护移植肾功能,同时防止急性或慢性排斥反应的发生[7]。调整免疫抑制剂的方式包括停药、减药、切换为其他种类的药物、急速减量等[7-8],但会增加排斥反应发生的风险。目前抗BKV药物的疗效报道颇不一致,常用的抗病毒药物包括来氟米特和西多福韦(表1)[7]。有研究显示,使用CD20单抗利妥昔单抗能起到良好的效果。尽管机制不明,但有研究报道静滴人免疫球蛋白(IVIG)联合免疫抑制剂减量能取得较好的治疗效果[7]。无论采用何种治疗方案,都需要严密监测BKV-DNA定量和移植肾功能[7]。BKV清除失败会导致移植肾功能恶化,预后不良。BKV的监测应持续至BKV PCR检查阴性[8]。病毒动力学模型和前瞻性研究表明,在有效治疗后7~20周,BKV尿症可消除,但在免疫抑制剂减量4~10周之后才会出现病毒量的减少[8]。
文献报道,肾移植受者BKV尿症、BKV血症和BKVN的大致患病率分别为30%、14%和8%,肾移植受者BKVN通常发生在肾移植后第一年,其发生率为1%~10%,平均发生率为4.91%。大约15%~50%的患者进展为移植肾失功[6]。近年来,随着检测技术的提高和治疗方案的发展,BKVN的预后较前有所改善。有单中心研究(n=58)报道,BKVN患者1年、3年、5年移植肾存活率分别为94.8%、68.4%和57.6%[9]。
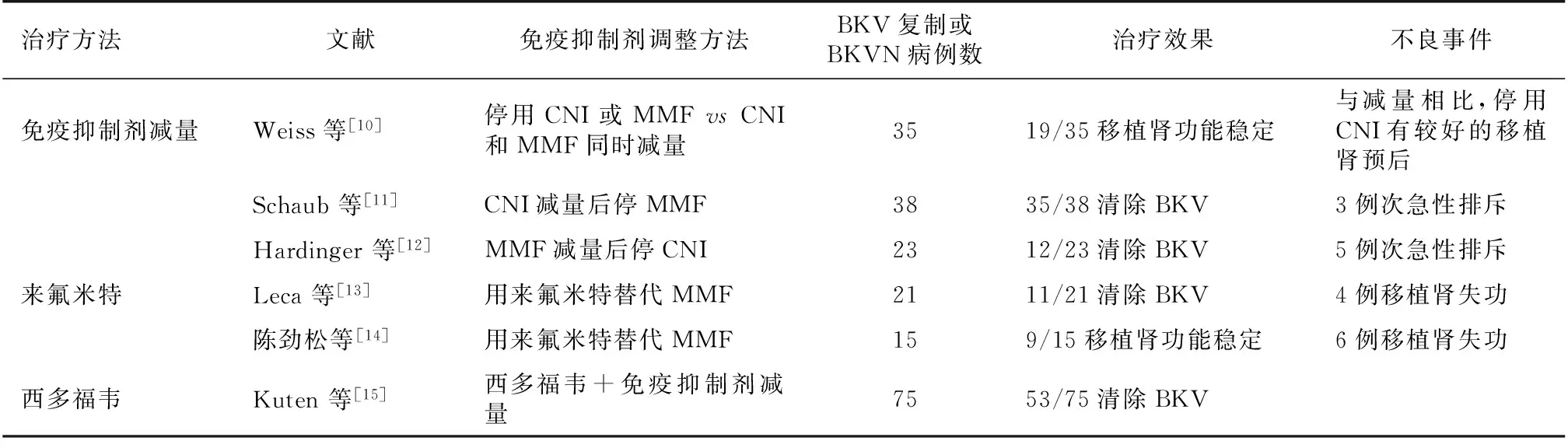
表1 BKV治疗方法和效果
BKV:BK病毒;BKVN:BK病毒肾病;MMF:吗替麦考酚酯;CNI:钙调神经蛋白抑制剂
BKV感染肾小管上皮细胞的机制及关键因素
对病毒感染靶细胞的初始机制的研究,有助于研发早期有效的治疗方法。探索BKV感染细胞的机制,需要的基本条件是获取人BKV和培养靶细胞。由于肾小管上皮细胞在自然状态下就是BKV感染的主要靶细胞,因此常用人近端肾小管上皮细胞(HRPTEC)作为病毒感染靶细胞[16-17]。
早期通过Vero细胞(非洲绿猴肾异倍体细胞)的研究发现,BKV通过细胞质膜微囊介导的内吞机制进入靶细胞[18]。利用Vero细胞的研究,可用于阐明BKV感染细胞的起始步骤[19],但是,多瘤病毒是高度种属特异性的,而Vero细胞不同于人类细胞,不是原代细胞,并且是人为建立的非整倍体细胞,所以,可能不同于BKV感染人肾小管上皮细胞的机制。众所周知,宿主细胞的性质可影响病毒感染的效率和结果。基于HRPTEC细胞进行的实验发现,胆固醇消耗和利用Cav-1 siRNA造成的Caveolin-1 (Cav-1)水平的下降,能够抑制BKV感染靶细胞[20]。通过电镜对BKVN患者感染细胞的超微结构进行观察发现,BKV是以无被膜的病毒颗粒的形式进入肾小管上皮细胞,这从形态学上支持了细胞质膜微囊介导的内吞机制[21]。细胞质膜微囊(含微囊蛋白的脂筏)是直径50~80 nm、富含鞘脂和胆固醇的烧瓶状质膜凹陷。含微囊蛋白的脂筏的细胞内吞过程,是有功能的网格蛋白小窝缺乏时发生的一个高度可控的过程[22]。HRPTEC转染网格蛋白siRNA不能抑制BKV感染。荧光显微镜和交叉相关光谱技术发现,标记的BKV颗粒与Cav-1有良好的共定位,但与网格蛋白没有,进一步支持了细胞质膜微囊的内吞是BKV感染人类肾小管上皮细胞的重要机制[20]。
BKV通过内质网(ER)进入细胞核内[23]。HRPTEC与BKV、微管破坏剂共培养能够抑制BKV感染[24],提示BKV经胞质膜微囊内吞进入细胞后是通过微管结构转运的。这个过程要求细胞微管结构的动力完整,但似乎与动力蛋白的功能无关。病毒感染6~8h后,HRPTEC内的ER中可发现BKV颗粒。尽管在BKVN患者的形态学研究发现,内体运载病毒颗粒似乎弥散于平滑囊泡和微管系统,并通过平滑囊泡和微管系统与粗面内质网和高尔基体(GA)相通[21],然而也有关于HRPTEC细胞内BKV颗粒更详细的转运机制的研究提出,BKV病毒颗粒在细胞内的转运完全绕过GA[24]。在感染后的最初8h内,BKV感染Vero细胞的过程对诺考达唑诱导的细胞微管系统的解离敏感[25]。BKV病毒颗粒进入细胞核内复制并产生子代病毒、转染其他细胞的途径与BKV进入细胞并在细胞内转运的途径相同。通过不断地复制和转染其他细胞,BKV进一步扩散,BKVN逐渐加重。BKV感染HRPTEC大约需要24~48h。
BKV感染的第一步是病毒颗粒和靶细胞之间的接触。多瘤病毒的病毒颗粒通过与细胞的某种受体建立连接。Atwood的实验室发现,含有α(2,3)-连接的唾液酸的N-连接糖蛋白是细胞BKV受体的重要组成部分[26]。伴随感染性测定的定点突变,可以产生一亚类的BKV突变体,它不能与Vero细胞结合,提示VP-1细胞表面存在低聚糖受体的结合囊[27]。不仅是BKV,还有JCV(另一种导致进行性多灶性白质脑病的人类多瘤病毒),进入宿主细胞都依赖于与唾液酸的相互作用[28]。BKV病毒受体(一种唾液酸化的糖蛋白)的具体本质还未被揭示。已知JCV通过5-羟色胺受体5HT2AR感染人胶质细胞[29],推测BKV可能通过某种G蛋白偶联受体进入肾脏上皮细胞。值得指出的是,多瘤病毒家族在宿主细胞的受体方面展现出非常多的多样性,并可能涉及既往未曾发现的分子,从而表现不同的病毒特性。鼠多瘤病毒(mPyV)的受体蛋白组成为α4β1整合素[28]。有实验室研究发现,唾液酸化的鞘糖脂神经节苷脂GD1b和GT1b是BKV的受体[23]。
针对发病机制的治疗新靶点
预防和治疗急性和慢性排斥反应的免疫抑制剂均有潜在的导致BKV感染进展成为BKVN的可能。BKVN导致移植肾失功后,也可以考虑再次肾移植,但由于供肾严重短缺,大量患者处于肾移植等待名单中,事实表明,即使能够再次肾移植,也需要等待数年之久。再加上,再次移植的花费(包括检查、透析等)要远高于首次肾移植。并且,再次肾移植后仍有较高的BKVN复发风险[30]。因此,全球各中心,BKVN的治疗在提高移植肾远期存活方面均处于重要地位。目前,BKVN的治疗主要局限于减量免疫抑制剂。各中心免疫抑制剂减量的具体方案不同,但总而言之,一般是停用或减量抗代谢药物骁悉或硫唑嘌呤,同时将神经钙调蛋白抑制剂减量。抗病毒药物使用的指征是当免疫抑制剂已减至低剂量,而移植肾功能仍继续恶化。即使BKVN得到良好的控制,治疗仍可能导致移植肾失功(整体风险比为1.69)。鉴于目前常规的抗病毒治疗仅有非常有限的成功率,并且抗病毒药物有肾毒性,今后BKVN治疗的方向将依靠于针对病毒进入细胞的初始步骤的干预。如前文所述,已知BKV是通过细胞质膜微囊介导的胞吞作用进入宿主细胞的,并且这是BKV感染HRPTEC的关键步骤[20,24]。同时已知,BKV很可能通过某种唾液酸化的糖蛋白作为进入靶细胞的受体,如能揭示这种糖蛋白的具体生物学本质和特性,将能开发出新的治疗途径来干扰BKV与其靶细胞膜受体的结合。我们相信,人多瘤病毒受体的研究,将能启发治疗疾病的新方法[31]。因此,关于BKV在肾小管上皮细胞的受体的研究很有科研潜力和临床价值。
另一个有前景的研究方向是干预BKV的靶细胞内吞过程。一些能够降低胆固醇的药物可抑制细胞质膜微囊的形成,从而减少BKV感染宿主细胞。常规用以治疗高胆固醇血症的药物——3-羟基-3-甲基戊二酰辅酶A还原酶抑制剂(他汀类降脂药),已经被证明能够抑制BKV进入HRPTEC[32]。在这项研究中,HRPTEC与BKV、普伐他汀共培养,发现BKV感染的细胞比例明显下降[33]。普伐他汀抑制BKV感染细胞的机制是由于普伐他汀通过抑制胆固醇的合成,降低了组成细胞质膜微囊的关键成分Cav-1的水平,从而在很大程度上阻碍了BKV的细胞内吞过程。尽管已经证实普伐他汀处理HRPTEC能降低Cav-1水平,但仍有研究提示,他汀类药物治疗BKV感染可能存在非胆固醇相关的作用机制[33]。他汀类药物能够抑制甲羟戊酸途径,从而影响包括Ras蛋白家族在内的很多信号通路中类异戊二烯前体异戊烯化[34]。他汀类药物抑制蛋白异戊烯化所需要的浓度要远高于其抑制胆固醇合成所需要的浓度,提示细胞以牺牲胆固醇合成为代价来维持甲羟戊酸途径[34]。无论机制如何,他汀类药物对进展期BKVN治疗效果有限。因此,在尿液或血液中一旦发现BKV,应尽早使用他丁类药物,活检证实BKVN后就已经存在BKV在细胞间的播散,此时再使用他汀就可能太晚了。
近期研究表明,病毒吸附蛋白包被的磁珠可用于筛查与唾液酸有相似的化学空间、能够连接病毒的化合物家族。如此高效的检查发现了许多小的含有没食子酸的化合物,它们能够降低BKV与Vero细胞的结合和感染[35]。这些研究,为病毒特异性的拮抗剂奠定了基础。
小结:BKVN是肾移植术后所面临的严峻问题。从目前非常有限的成功的抗病毒研究来看,今后抗病毒治疗发展的方向,将聚焦于对于BKV感染靶细胞早期步骤的干预。细胞质膜微囊介导的内吞是BKV进入人类肾小管上皮细胞的关键步骤。某种N-连接糖蛋白或含有α(2,3)-连接的唾液酸的神经节苷脂,是BKV靶细胞受体的组成部分。抗病毒治疗的新方向在于采用治疗措施干预BKV与肾小管上皮细胞受体的结合、BKV的内吞和细胞内的转运。进一步对于BKV受体的研究、基于他汀类药物的抗细胞质膜微囊介导的胞吞和小分子的病毒特异性拮抗剂将是BKV研究的新方向,具有较高的转化应用价值。
1 Randhawa P,Ramos E.BK viral nephropathy:an overview.Transplant Rev,2007,21(2):77-85.
2 Moriyama T,Sorokin A.BK virus (BKV):infection,propagation,quantitation,purification,labeling,and analysis of cell entry.Curr Protoc Cell Biol,2009,Chapter 26:Unit 26.2.
3 Costa C,Cavallo R.Polyomavirus-associated nephropathy.World J Transplant,2012,2 (6):84-94.
4 Ferreira-Gonzalez A,Sidiqui R.BK Virus in the transplant patient.Clin Microbiol Newslett,2007,29(16):121-128.
5 陈劲松,陈惠萍,文吉秋,等.多瘤病毒相关性肾病患者肾组织浸润细胞的变化及意义.肾脏病与透析肾移植杂志,2015,24(2):128-132.
6 Balba GP1,Javaid B,Timpone JG Jr.BK polyomavirus infection in the renal transplant recipient.Infect Dis Clin North Am,2013,27(2):271-283.
7 Dall A,Hariharan S.BK virus nephritis after renal transplantation,Clin J Am Soc Nephrol,2008,3 (Suppl 2):S68-S75.
8 Bohl DL,Brennan DC.BK virus nephropathy and kidney transplantation.Clin J Am Soc Nephrol,2007,2 (Suppl 1):S36-S46.
9 Medipalli R,Vasudev B,Zhu Y,et al.Improved outcomes of BKVN:Impact on BK virus surveillance protocol [Abstract].Am J Transplant,2007 ,7[Suppl 2]:150.
10 Weiss AS,Gralla J,Chan L,et al.Aggressive immunosuppression minimization reduces graft loss following diagnosis of BK virus-associated nephropathy:a comparison of two reduction strategies.Clin J Am Soc Nephrol,2008,3(6):1812-1819.
11 Schaub S,Hirsch HH,Dickenmann M,et al.Reducing immunosuppression preserves allograft function in presumptive and definitive polyomavirus associated nephropathy.Am J Transplant,2010,10(12):2615-2623.
12 Hardinger KL,Koch MJ,Bohl DJ,et al.BK virus and the impact of preemptive immunosuppression reduction:5 year results.Am J Transplant,2010,10(2):407-415.
13 Leca N,Muczynski KA,Jefferson JA,et al.Higher levels of leflunomide are associated with hemolysis and are not superior to lower levels for BK virus clearance in renal transplant patients.Clin J Am Soc Nephrol,2008,3(3):929-935.
14 陈劲松,季曙明,李雪,等.来氟米特替换霉酚酸酯抗排异方案对移植肾BK病毒相关性肾病预后的影响.医学研究生学报,2016,29(9):945-948.
15 Kuten SA,Patel SJ,Knight RJ,et al.Observations on the use of cidofovir for BK virus infection in renal transplantation.Transpl Infect Dis,2014,16(6):975-983.
16 Liptak P,Kemeny E,Ivanyi B.Primer:histopathology of polyomavirus-associated nephropathy in renal allografts.Nat Clin Pract Nephrol,2006,2 (11):631-636.
17 Low J,Humes HD,Szczypka M,et al.BKV and SV40 infection of human kidney tubular epithelial cells in vitro.Virology,2004,323 (2):182-188.
18 Eash S,Querbes W,Atwood WJ.Infection of vero cells by BK virus is dependent on caveolae.J Virol,2004,78 (21) :11583-11590.
19 Dugan AS,Eash S,Atwood WJ.Update on BK virus entry and intracellular trafficking.Transpl Infect Dis,2006,8 (2):62-67.
20 Moriyama T,Marquez JP,Wakatsuki T,et al.Caveolar endocytosis is critical for BK virus infection of human renal proximal tubular epithelial cells.J Virol,2007,81 (16) :8552-8562.
21 Drachenberg CB,Papadimitriou JC,Wali R,et al.BK polyoma virus allograft nephropathy:ultrastructural features from viral cell entry to lysis.Am J Transplant,2003,3 (11) :1383-1392.
22 Nichols B.Caveosomes and endocytosis of lipid rafts.J Cell Sci,2003,116(Pt 23):4707-4714.
23 Low JA,Magnuson B,Tsai B,et al.Identification of gangliosides GD1b and GT1b as receptors for BK virus,J Virol,2006,80 (3):1361-1366.
24 Moriyama T,Sorokin A.Intracellular trafficking pathway of BK Virus in human renal proximal tubular epithelial cells.Virology,2008,371 (2):336-349.
25 Eash S,Atwood WJ.Involvement of cytoskeletal components in BK virus infectious entry.J Virol,2005,79 (18):11734-11741.
26 Dugan AS,Eash S,Atwood WJ.An N-linked glycoprotein with alpha(2,3)-linked sialic acid is a receptor for BK virus.J Virol,2005,79 (22):14442-14445.
27 Dugan AS,Gasparovic ML,Tsomaia N,et al.Identification of amino acid residues in BK virus VP1 that are critical for viability and growth,J Virol,2007,81 (21):11798-11808.
28 Gee GV,Dugan AS,Tsomaia N,et al.The role of sialic acid in human polyomavirus infections.Glycoconj J,2006,23 (1-2):19-26.
29 Elphick GF,Querbes W,Jordan JA, et al.The human polyomavirus,JCV,uses serotonin receptors to infect cells.Science,2004,306 (5700):1380-1383.
30 Dharnidharka VR,Cherikh WS,Neff R,et al.Retransplantation after BK virus nephropathy in prior kidney transplant:an OPTN database analysis.Am J Transplant,2010,10 (5):1312-1315.
31 Trofe J,Gordon J,Roy-Chaudhury P,et al.Basic and clinical research in polyomavirus nephropathy.Exp Clin Transplant,2004,2 (1) :162-173.
32 Moriyama T,Sorokin A.Repression of BK virus infection of human renal proximal tubular epithelial cells by pravastatin.Transplantation,2008,85 (9) :1311-1317.
33 Garcia-Ruiz C,Morales A,Fernandez-Checa JC.Statins and protein prenylation in cancer cell biology and therapy.Anticancer Agents Med Chem,2012,12 (4):303-315.
34 Moon H,Hill MM,Roberts MJ,et al.Statins:protectors or pretenders in prostate cancer? Trends Endocrinol Metab,2014,25 (4):188-196.
35 O′Hara BA,Rupasinghe C,Yatawara A,et al.Gallic acid-based small-molecule inhibitors of JC and BK polyomaviral infection.Virus Res,2014,189:280-285.
(本文编辑 律 舟)
Mechanisms of BK virus infection in renal transplant and therapeutic implication
XIEKenan,CHENJinsong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
BK virus (BKV) can cause BKV nephritis in renal transplant patients and has become a significant reason for graft loss. BKV is latent in the urogenital tract, and most likely is transported from the donor kidney to recipent. BKV reactivates in recipents, virus DNA replicates in the nucleus of renal epithelial tubular cells, and daughter viruses are released and enter other renal epithelial cells to spread infection. A lot of factors about the mechanism and kinetics of BKV infection remain unclear. There are mainly two ways of treating BKV infection, one is to reduce immunosuppressive agents, but this may increase the risk of rejection; the other is to use anti-viral drugs, but these therapies have inconsistent results. This review will describe the BKV entry in target human cells, intracellular trafficking pathways of BKV particles and potential therapeutic implications based on understanding of mechanisms of BKV.
BK virus statins cellular receptor renal transplantation
10.3969/cndt.j.issn.1006-298X.2016.05.018
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 博士研究生(谢轲楠) 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2016-09-05
