卵巢癌SKOV3细胞系培养上清液处理巨噬细胞不同时间后对巨噬细胞分化的影响
2016-06-01宋玉霞赵涛张玮璨郭清王宏卫孟桐羽
宋玉霞 赵涛 张玮璨 郭清 王宏卫 孟桐羽
050011 河北省石家庄市第一医院妇产科(宋玉霞、赵涛、郭清、王宏卫、孟桐羽);河北医科大学(张玮璨)
·论著·
卵巢癌SKOV3细胞系培养上清液处理巨噬细胞不同时间后对巨噬细胞分化的影响
宋玉霞赵涛张玮璨郭清王宏卫孟桐羽
050011河北省石家庄市第一医院妇产科(宋玉霞、赵涛、郭清、王宏卫、孟桐羽);河北医科大学(张玮璨)
【摘要】目的探讨卵巢癌SKOV3细胞系培养上清液处理巨噬细胞不同时间后,巨噬细胞分化亚型的改变。方法Ficoll 密度梯度法分离健康成人外周血单个核细胞,GM-CSF诱导为巨噬细胞(M0)后,用对数生长期的SKOV3细胞培养上清液处理为实验组,用1640培养基处理为对照组,分别于培养第7天和第14天光学显微镜下观察巨噬细胞形态变化;流式细胞术检测实验组和对照组在不同时间后巨噬细胞表面细胞因子(CD64、CD163)表达情况。结果培养第7天时,实验组巨噬细胞形态改变明显,细胞突起增加,细胞变细长,对照组细胞形态无明显变化,实验组CD64-M1型巨噬细胞所占比例高于对照组,CD163-M2型巨噬细胞所占比例低于对照组(P<0.05);培养第14天时,实验组巨噬细胞形态逐渐恢复,对照组细胞形态仍无明显变化,实验组CD64-M1型巨噬细胞所占比例低于对照组,CD163-M2型巨噬细胞所占比例高于对照组(P<0.05)。实验组CD64-M1型巨噬细胞在第7天时M1/M0水平高于第14天,CD163-M2型巨噬细胞在第7天时M2/M0低于在第14天,差异均有统计学意义(P<0.05)。结论SKOV3细胞培养上清液可改变巨噬细胞形态,激活巨噬细胞免疫反应,随着时间的推移,细胞形态恢复,发生免疫抑制;同时,也可促进巨噬细胞分化,随着时间的推移,亚型也有不同,主要由CD64-M1型巨噬细胞向CD163-M2型巨噬细胞转变。
【关键词】卵巢肿瘤;SKOV3;巨噬细胞;细胞分化
上皮性卵巢癌(简称卵巢癌)是女性生殖系统常见的恶性肿瘤。由于缺乏早期特异性症状、无有效的疾病筛查手段,> 70%的病例确诊时已是FIGO Ⅲ/Ⅳ 期的晚期癌症患者,表现为腹腔内广泛播散和转移。慢性炎症能够促进肿瘤的发生发展,并诱发不同类型的癌症。炎症微环境还有利于肿瘤细胞穿过基底膜,进而发生侵袭和转移[1],因此近年来的一些研究集中于肿瘤相关巨噬细胞(tumor-associateed macrophages,TAMs)。肿瘤相关巨噬细胞作为侵入实体肿瘤中单核细胞群的主要细胞,大量存在于肿瘤血管周围和低氧区,是炎症进展成为癌症的主要桥梁[2]。卵巢癌中肿瘤相关巨噬细胞浸润数量和卵巢癌预后不良明显相关,逐渐开展了从免疫学角度研究卵巢癌转移和进展的机制。之前一些研究发现,不同分期的卵巢癌患者腹腔巨噬细胞不同亚型所占比例不同,早期卵巢癌患者腹腔冲洗液中以表达M1型巨噬细胞为主,而晚期患者腹水中主要以M2型巨噬细胞占优势[3]。根据“免疫编辑”学说,免疫系统对肿瘤的作用随肿瘤的进展不断变化,提示我们不同亚型的巨噬细胞在卵巢癌进展中发挥不同的作用,对卵巢癌恶性表型有重要意义。鉴于巨噬细胞在卵巢癌中的重要作用,本项目拟利用细胞培养及流式细胞学等实验技术,通过构建卵巢癌细胞系SKOV3培养上清与巨噬细胞共培养模型,明确经SKOV3培养上清培养后的巨噬细胞亚型的变化及巨噬细胞亚型改变与SKOV3培养上清培养时间的关系,探讨卵巢癌细胞系SKOV3上清对巨噬细胞亚型的影响,初步了解卵巢癌进展过程中巨噬细胞亚型的改变,初步筛选出肿瘤上清中的关键分子靶点,为解释卵巢癌的腹腔播散和转移提供新的线索,并为卵巢癌分子靶点的干预策略提供理论基础。
1材料与方法
1.1材料1640培养基,卵巢癌细胞系SKOV3。
1.2方法
1.2.1采集健康成人外周血,Ficoll 密度梯度法收集中间层单个核细胞(1 000 r/min, 20 min,23℃), PBS 重悬后再次离心(800 r/min, 7 min, 23℃)。用对数生长期的SKOV3细胞培养上清液处理为实验组,1640培养基处理为对照组。
1.2.2巨噬细胞培养:细胞以无血清RPMI1640重悬后种于100 mm细胞培养皿,细胞种植密度为1.0×106/ml,培养箱中静置 2 h 使细胞贴壁,用预热的PBS润洗3次,除去悬浮细胞。加入10%FBS-RPMI1640和GM-CSF,置入37 ℃,5%CO2培养箱培养,备用。
1.2.3用对数生长期的SKOV3细胞培养上清分别处理7、14 d:处理不同时间后,光学显微镜下观察巨噬细胞形态变化。
1.2.4腹腔巨噬细胞(M0)纯度鉴定:以免疫荧光的方式鉴定分离培养巨噬细胞纯度。细胞刮轻刮培养皿收集巨噬细胞,离心收集细胞沉淀1 200 r/min, 5 min,23℃。弃上清,以CD68抗体标记巨噬细胞,37℃,1 h。PBS洗涤3遍,标记荧光二抗,37℃,1 h。PBS洗涤3遍,Hocest染核5 min。PBS洗涤3遍,荧光显微镜观察,统计。
1.2.5SKOV3细胞培养上清培养巨噬细胞:用对数生长期的SKOV3细胞培养上清分别处理M0巨噬细胞7、14 d,同时用1640培养基设立对照组。
1.2.6巨噬细胞各亚型比例的检测:以CD68作为腹腔巨噬细胞(M0)的表面标记,以CD64作为M1型巨噬细胞的表面标记,以CD163作为M2型巨噬细胞的表面标记。将对照组和实验组不同处理时间的细胞分别收集,取1.0×106个细胞,分别标记上述荧光抗体,流式细胞学检测M1、M2所占百分比及M1/M0,M2/M0的比例。

2结果
2.1SKOV3细胞培养上清处理7 d的巨噬细胞形态改变明显,如细胞呈多边形或长梭形,形态饱满,胞质丰富,生长旺盛,细胞突起增加,细胞状态良好;处理14 d的巨噬细胞形态改变不明显,细胞呈圆形,散在排列。说明SKOV3细胞上清处理巨噬细胞7 d时可改变细胞形态;而处理14 d时对细胞形态改变不明显。见图1。
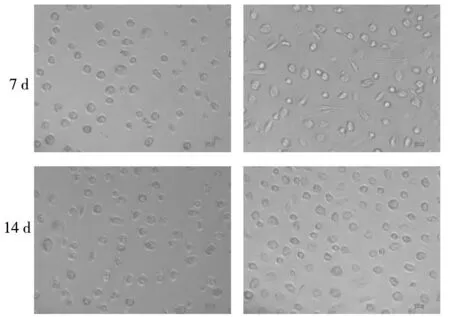

对照组实验组
图1用1640培养基和SKOV3细胞培养上清处理巨噬细胞7、14 d后,在光学显微镜下观察细胞形态的变化(100×免疫荧光)
2.2流式细胞术检测实验组、对照组不同巨噬细胞亚型所占比例。
2.2.12组不同巨噬细胞亚型所占比例比较:培养7 d时,对照组CD64-M1型巨噬细胞占(15.4±2.3)%,CD163-M2型巨噬细胞占(2.0±0.7)%;实验组CD64-M1型巨噬细胞占(24.2±2.9)%,CD163-M2型巨噬细胞占(1.4±0.5)%;培养14天时,对照组CD64-M1型巨噬细胞占(3.8±0.9)%,CD163-M2型巨噬细胞占(3.3±1.3)%;实验组CD64-M1型巨噬细胞占(1.9±0.9)%,CD163-M2型巨噬细胞占(11.5±1.4)%。2组比较,差异有统计学意义(P<0.05)。见表1,图2。
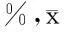
表1 2组不同巨噬细胞亚型所占比例比较 ±s
注:与对照组比较,*P<0.05
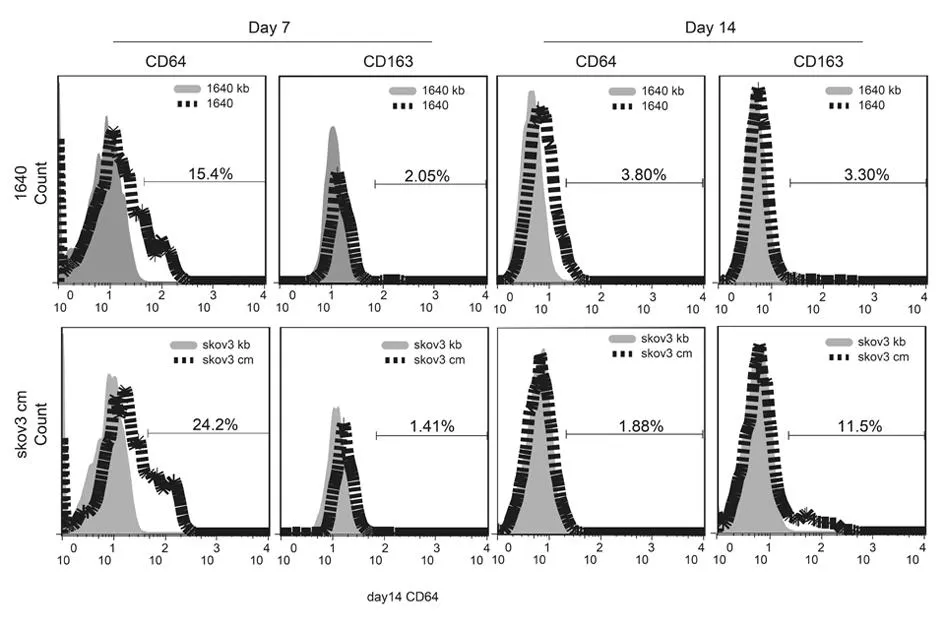
图2 2组不同巨噬细胞亚型所占比例
2.2.22组不同巨噬细胞亚型比值比较:CD64-M1型巨噬细胞在第7天时M1/M0=(1.61±0.29),在第14天时M1/M0=(0.52±0.13);CD163-M2型巨噬细胞在第7天时M2/M0=(0.73±0.19),在第14天时M2/M0=(3.56±1.10);差异均有统计学意义(P<0.05)。见表2,图3。
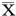
表2 2组的不同巨噬细胞亚型的比值比较 ±s
注:7 d时比较,*P<0.05
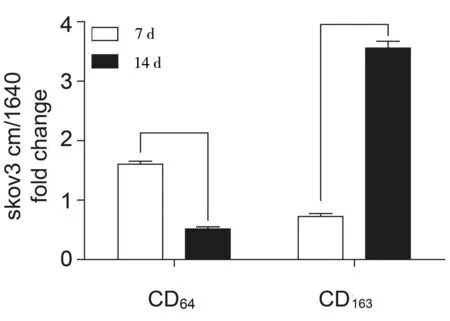
图3 2组的不同巨噬细胞亚型的比值
3讨论
卵巢癌是致命性最高的妇科恶性肿瘤[4]。我国卵巢癌发病虽位于女性肿瘤第三位,但病死率却居于首位,超过70%的患者确诊时已有腹膜转移,5年生存率不到30%[5,6]。近年来,卵巢癌与免疫微环境相互作用的研究与日俱增,尤其与巨噬细胞的关系成为研究热点,但是关于腹腔巨噬细胞的研究仍处于初级阶段。因此,阐明不同分期卵巢癌腹腔巨噬细胞的状态可能为卵巢癌恶性进展提供新的线索。
人正常腹腔微环境中存在大量免疫细胞尤其是巨噬细胞,巨噬细胞作为第一道免疫防线——固有免疫的主要细胞成分对维持腹腔正常免疫环境有非常重要的作用[7]。晚期卵巢癌以腹腔广泛种植播散和大量腹水为主要临床特征。在卵巢癌腹腔种植播散的过程中,巨噬细胞与肿瘤细胞存在一定的相互作用,从而影响肿瘤细胞的恶性表型和不良转归[8]。
不同学者对卵巢癌腹腔播散发生机制提出各自看法,但基本集中在原位卵巢癌肿瘤细胞发生上皮细胞间质型(EMT)自原位脱落,进入腹腔,抵抗失巢凋亡,到达大网膜、肠系膜、肠壁、腹壁等播散位置后,黏附种植,发生MET,局部浸润播散。大多数学者对其研究多偏重于卵巢癌细胞自身的DNA、RNA、蛋白水平为适应播散做出的一系列改变。但关于腹腔微环境尤其是免疫微环境对卵巢癌肿瘤细胞的改造报道较少,而这正是阐明卵巢癌腹腔播散的关键,是我们有待进一步研究的方向。
目前临床中,晚期卵巢癌的治疗仍然以手术加以紫杉醇加铂类为基础的联合化疗为主要手段。虽然大幅提高卵巢癌初始化疗的效果,但是对复发性卵巢癌的治疗尚无重大突破。近年来,对于恶性肿瘤的治疗出现了一些分子靶向治疗药物,如Herceptin,Gleevec,Sorafenib等。但是卵巢癌的分子靶向治疗药物仍未获得突破性进展。分子靶向药物在临床应用中暴露的一些问题使得人们逐渐把目光转移到生物免疫治疗上来。腹腔巨噬细胞与卵巢癌肿瘤细胞相互作用的研究,对揭示卵巢癌恶性表型有重要意义,同时还能对卵巢癌的免疫治疗提供理论基础。
外周血单核细胞是一种重要的非特异性免疫细胞。这些细胞能感知癌症入侵信号,移出毛细血管,并转化为未成熟型巨噬细胞M0[9],M0渗透到癌灶组织周围,并被激活,从而杀死肿瘤细胞,这些细胞即被称为肿瘤相关巨噬细胞(TAMs)。TAMs是构成实体肿瘤中单核细胞群的主要细胞,大量存在于肿瘤血管周围、无血管区和低氧区,是炎症发展成癌的主要桥梁[10]。然而,并非所有的TAMs均可发挥其杀伤肿瘤细胞的功能。TAMs分为两种功能截然相反的两组表型,经典激活型TAMs,即M1型TAMs,能够诱导干扰素和肿瘤坏死因子产生细胞毒素杀伤肿瘤细胞[3]。M2型TAMs可被转化生长因子-β(TGF-β)、白介素-4(IL-4)和(IL-13)激活,为肿瘤细胞提供 “营养支持”[11]。M1型和M2型关键区别在于它们分泌的细胞因子不同。M1型TAMs能够释放活性氧、炎性细胞因子,比如IL-6、IL-12、IL-23和肿瘤坏死因子(TNF),从而杀死肿瘤细胞,其主要由干扰素、脂多糖、肿瘤坏死因子、粒-巨噬细胞集落刺激因子活化。M2型TAMs则释放各种生长因子,如表皮生长因子(EGF)、成纤维细胞生长因子(FGF)、血管内皮生长因子(VEGF),从而促进血管的形成和肿瘤的生长[12]。而癌细胞也分泌一些“M2型”细胞因子,比如IL-10、VEGF、血小板衍生生长因子等来诱导M0型向M2型分化[13],因此,癌组织中常见的即是M2型TAMs[14]。M2型巨噬细胞还能够抑制TH1获得性细胞免疫,可以促进创伤愈合、血管增生、组织重塑等[15-17]。M2型巨噬细胞也能够释放免疫抑制因子(IL-10、TNF-β1)和基质金属蛋白酶(MMP-2,9)等,促进肿瘤细胞增殖、转移、血管生成以及诱导局部免疫耐受从而促进肿瘤进展。在卵巢癌的发生发展过程中,卵巢癌细胞蔓延到腹膜表面,引起腹膜毛细血管通透性及再吸收功能障碍,血管内单核-巨噬细胞在各种免疫因子的刺激下渗出腹膜,促进腹水形成。大量的单核-巨噬细胞在腹腔微环境中分化为M1、M2型巨噬细胞,并分泌各种细胞因子参与肿瘤的转移及腹水形成[18,19]。其中,IL-8参与卵巢癌腹水的形成,并通过促进其他炎性因子的释放,促进肿瘤细胞的增殖和血管的生成[20]。IL-8还可以提高内皮细胞的存活率、增值能力及MMP的分泌,从而调节血管生成[21]。M2型TAMs细胞表达细胞表面标记如CD163、CD204、CD206,M1型则表达CD64等。Lan等[22]研究110例晚期卵巢癌患者的M2型巨噬细胞表面的CD163分子,结果证明高表达CD163的患者无进展生存期及总生存期较低表达CD163的患者明显缩短。血清中较高的CD163水平也提示预后不良[23]。同样,另一个M2型TAMs相关标记物CD206的高表达也提示预后不良。但是单独的CD206+并不能直接作为诊断依据,CD206/CD68比值的增高与患者的无进展生存期密切相关[24]。也有越来越多的研究证明,M1/M2比值升高可以提高患者的生存期[25]。这些研究告诉我们,CD68+巨噬细胞细胞的总数并不影响患者的预后,而是M1/M2比值与患者预后密切相关。
本实验用SKOV3细胞培养上清模拟卵巢癌患者腹腔微环境,可以观察到培养7 d时,主要是CD64-M1型巨噬细胞;培养14 d时,主要是CD163-M2型巨噬细胞。根据结果结合文献报道,可以猜测,在卵巢癌的早期阶段,主要以M1型巨噬细胞为主,可以促进TH1型细胞免疫,抑制肿瘤的进展。随着腹腔微环境的变化,巨噬细胞在癌细胞释放的“M2型”细胞因子的诱导下,逐渐向M2型分化,M2型巨噬细胞则促进肿瘤细胞增殖、转移、血管生成以及诱导局部免疫耐受从而促进肿瘤进展。但腹腔微环境变化具体细微过程仍然没有能够直接明确的观察到,更多的细节过程有待进一步实验证明。
巨噬细胞不仅参与非特异性免疫反应,还参与特异性免疫应答。传统的免疫学认为,TAMs的出现能够有效地发挥杀瘤作用,但如今看来,越来越多的研究表明,TAMs不仅不能清除肿瘤,反而主动抑制免疫应答,促进了肿瘤的发生发展及转移。如何减少TAMs,如何诱导M2型巨噬细胞向M1型巨噬细胞分化,或者阻止MI向M2分化,进而改变腹腔微环境,抑制肿瘤细胞的增殖、侵袭及迁移,对这些问题的研究将有助于了解TAMs与肿瘤细胞的关系,并研究出新的治疗癌症的方法。
参考文献
1Allavena P,Sica A,Solinas G,et al.The inflammatory micro-environment intum or progression: the role of tumor-associated macrophages.J Crit Rev Oncol Hematol,2008,66:1-9.
2Chiara P,Biswas SK,Paola L,et al.Tumor promotion by tumor-associated macrophages.J Adv Exp Med Biol,2007,604:67-86.
3Claire EL, Jeffrey WP.Distinct role of macrophages in different tumor microenvironments.J Cancer Res,2006,66:605-612.
4Liliac L,Amalinei C,Balan R,et al.Ovarian cancer: insights into genetics and pathogeny.J Histol Histopathol,2012,27:707-719.
5Salani R,Bristow RE. Surgical management of epithelial ovarian cancer.J Clin Obstet Gynecol,2012,55:75-95.
6Bharwani N, Reznek RH, Rockall AG.et al. Ovarian cancer management: the role of imaging and diagnostic challenges.J Eur J Radiol,2011,78:41-51.
7Gonzalez Mejia ME, Doseff A. Regulation of monocytes and macrophages cell fate.J Front Biosci (Landmark Ed),2009,14:2413-2431.
8Shen Z,Seppnen H,Vainionp S,et al. IL10, IL11, IL18 are differently expressed in CD14+ TAMs and play different role in regulating the invasion of gastric cancer cells under hypoxia.J Cytokine,2012,59:352-357.
9Staudt ND, Jo MJ, Hu JJ, et al. Myeloid cell receptor LRP1/CD91 regulates monocyte recruitment and angiogenesis in tumors.J Cancer Res,2013,73:3902-3912.
10Chiara P, Biswas SK, Paola L, et al. Tumor promotion by tumor-associated macrophages.J Adv Exp Med Biol,2007,604:67-86.
11Alberto M, Anotonio S, Paola A, et al. Tumor-associated macrophages and the related myeloid-derived suppressor cells as a paradigm of the diversity of macrophage activation.J Hum Immunol,2009,70:325-330.
12Zhang J, Lu Y,Pienta KJ. Multiple roles of chemokine(C-C motif) ligand 2 in promoting prostate cancer growth.J Natl Cancer Inst,2010,
102:522-528.
13Kong LY WA, Doucette T, Wei J, et al. Intratumoral mediated immunosuppression is prognostic in genetically engineered murine models of glioma and correlates to immunotherapeutic responses.J Clin Cancer Res,2010,16:5722-5733.
14Alberto M,Silvano S,Massimo L,et al.Macrophage polarization:tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes.J Trends Immunol,2002,23:549-555.
15Allavena P,Sica A, Solinas G, et al. The inflammatory micro-environment in tumor progression: the role of tumor-associated macrophages.J Crit Rev Oncol Hematol,2008,66:1-9.
16Solinas G,Germano G,Mantovani A,et al. Tumor-associated macrophages(TAM ) as major players of the cancer-related in flammation.J Leukocyte Biol,2009,86:1-9.
17Sica A,Allavena P,Mantovani A. Cancer related inflammation: the macrophage connection.J Cancer Lett,2008,267:204-215.
18Wang X,Deavers M,Patenia R. Monocyte/macrophage and T-cell infiltrates in peritoneum of patients with ovarian cancer?or benign pelvicdisease.J Journal of Translational Medicin,2006,4:30.
19张婷, 马政文, 王颖, 等. 凝血因子Ⅱ可诱导单核细胞和巨噬细胞分化为卵巢癌腹膜内肿瘤相关样巨噬细胞.中国实用妇科与产科杂志,2009,25:265-268.
20Alvero AB,Fu HH,Holmberg J, et al. Stem -like ovarian cancer cells can serve as tumor vascular progenitors.J Stem Cells,2009,27:2405-2413.
21Kimura YN,Watari K,Fotovati A, et al. Inflammatory stimuli frommacrophages and cancer cells synergistically promote tumor growth and angiogenesis.J Cancer Sci,2007,98 :2009-2018.
22Lan C,Huang X,Lin S,et al.Expression of M2-polarized macrophages is associated with poor prognosis for advanced epithelial ovarian cancer.J Technol Cancer Res Treat,2013,12:259-267.
23No JH, Moon JM, Kim K,et al.Prognostic significance of serum soluble CD163 level in patients with epithelial ovarian cancer.J Gynecol ObstetInvest,2013,75:263-267.
24Le Page C, Marineau A, Bonza PK,et al. BTN3A2 expression in epithelial ovarian cancer is associated with higher tumor infiltrating Tcells and a better prognosis.J PloS one,2012,7.
25Zhang M,He Y,Sun X,et al.A high M1/M2 ratioof tumor-associated macrophages is associated with extended survival in ovarian cancer patients.J Ovarian Res,2014,7:19.
Effects of macrophage treated by culture supernatant with ovarian cancer SKOV3 cell line at different time points on the differentiation of macrophages
SONGYuxia*,ZHAOTao*,ZHANGWeican,etal.
*DepartmentofObstetricsandGynecology,TheFirstHospitalofShijiazhuangCity,Shijiazhuang050011,China
【Abstract】ObjectiveTo investigate the changes of differentiation subtypes of macrophages treated by culture supernatant with ovarian cancer SKOV3 cell line at different time points.MethodsThe peripheral blood mononuclear cells were separated from healthy adults by Ficoll density gradient method, which were induced into macrophages (M0) by GM-CSF.The culture supernatant in which the macrophages were cultured in medium with SKOV3 ovarian cancer cells at exponential growth phase was served as experimental group, however, the culture supernatant with macrophages in 1640 medium was served as control group. The morphological changes of macrophages were observed under microscope on the 7th day and 14th day,respectively, and the expression levels of the cytokines on surface of macrophages including CD64-M1 and CD163-M2 were detected by flow cytometry in different time points.ResultsThe morphous of macrophages was obviously changed on the 7th day after cultivation in experimental group,with cellular apophysis being increased and cells becoming long and thin, however, the morphous of macrophages was not obviously changed in control group. The proportion of CD64-M1 macrophages in experimental group was significantly lower than that in control group (P<0.05),however, the proportion of CD64-M2 macrophages in experimental group was significantly higher than that in control group (P<0.05) . On the 14th day after cultivation the morphous of macrophages was gradually recovered in experimental group,however, the morphous of macrophages was still not obviously changed in control group. Moreover the proportion of CD64-M1 macrophages in experimental group was significantly lower than that in control group (P<0.05),however, the proportion of CD64-M2 macrophages in experimental group was significantly higher than that in control group (P<0.05).The ratio of M1/M0 of CD64-M1 macrophages in experimental group on the 7th day was significantly higher than that on the 14th day (P<0.05),however, which in CD163-M2 macrophages on the 7th day was significantly lower than that on the 14th day (P<0.05).ConclusionThe cell culture supernatant treated by SKOV3 cells can change the morphous of macrophages and activate immune reaction of macrophage,with the time goes on, the morphous of cells will be recovered,with immunosuppression.Moreover the cell culture supernatant treated by SKOV3 cells can also promote the differentiation of macrophages, with the time goes on,different subtypes will appear,especially,CD64-M1 macrophages are differentiated into CD163-M2 macrophages.
【Key words】ovarian neoplasms;SKOV3;macrophages;cell differentiation
(收稿日期:2015-10-21)
【中图分类号】R 737.31
【文献标识码】A
【文章编号】1002-7386(2016)10-1498-05
通讯作者:郭清,050011河北省石家庄市第一医院妇产科;
doi:10.3969/j.issn.1002-7386.2016.10.016
E-mail:yfguoqing@163.com
