芪参养肝方抗肝纤维化的实验研究
2016-05-31徐莉英高月求周振华
徐莉英,高月求,周振华
(1. 上海市黄浦区传染病医院,上海 200011;2. 上海曙光医院,上海 201203)
芪参养肝方抗肝纤维化的实验研究
徐莉英1,高月求2,周振华2
(1. 上海市黄浦区传染病医院,上海 200011;2. 上海曙光医院,上海 201203)

[摘要]目的观察芪参养肝方对刀豆蛋白A(ConA)肝纤维化小鼠肝脏的肝星状细胞(HSC)活化、胶原合成及细胞因子α-SMA、TGF-β1分泌的影响,探讨其抗肝纤维化的作用机制。方法将40 只BALB/c小鼠随机分为正常组、模型组、芪参养肝方组,造模期间芪参养肝方组给予芪参养肝方药液灌胃。检测3组小鼠肝功能、肝组织中羟脯氨酸含量和α-SMA、Col I、ColⅢ、TGF-β1 mRNA表达以及α-SMA、Col I、TGF-β1蛋白表达情况。结果模型组血清ALT、AST水平及肝组织中羟脯氨酸含量均明显高于正常组(P均<0.05),而芪参养肝方组各指标水平均明显低于模型组(P均<0.05)。HE、天狼猩红染色显示,芪参养肝方组肝小叶破坏及胶原纤维增生较模型组明显减轻,胶原沉积明显好转。模型组肝组织中α-SMA、TGF-β1、Col I、ColⅢ mRNA表达量及α-SMA、TGF-β1、ColⅠ蛋白表达量均明显高于正常组(P均<0.05),而芪参养肝方组各指标水平均明显低于模型组(P均<0.05)。结论芪参养肝方能抑制ConA肝纤维化小鼠α-SMA、TGF-β1分泌及HSC活化,促进活化的HSC凋亡;并能下调ColⅠ、Col Ⅲ mRNA表达,抑制胶原纤维增生;其有保肝降酶、抗肝纤维化作用。
[关键词]芪参养肝方;刀豆蛋白;肝纤维化
肝纤维化是多种慢性肝病发展的共同病理基础,其实质是以胶原为主的细胞外基质(ECM)的合成大于降解,过多的ECM沉积在肝脏中,最终形成肝纤维化。大量的临床研究证实肝纤维化完全有可能发生逆转,但目前国内外尚无理想的抗肝纤维化药物,而中医中药在抗肝纤维化的治疗中优势明显。中医认为肝病日久,气阴亏损,血行不利,脉络瘀阻,而芪参养肝方有益气养阴、活血化瘀、软坚散结之功效,紧扣肝纤维化的病机特点,故本研究观察了芪参养肝方对刀豆蛋白A(ConA)诱导的肝纤维化小鼠肝脏的HSC活化、胶原合成、细胞因子α-SMA、TGF-β1分泌的影响,旨在探讨芪参养肝方抗肝纤维化的作用机制。
1实验资料
1.1实验动物BALB/c小鼠,雄性,体质量18~23 g,由上海中医药大学实验动物中心提供,动物合格证号:SCXK(沪)2008-0016。实验动物用标准饲料喂养,常规饲养观察1周后使用。
1.2药物与主要试剂芪参养肝方实验用药由芪参养肝胶囊溶解所得,由黄芪、鳖甲、丹参、灵芝、赤芍、五味子、白术、陈皮、柴胡组成,北京华神制药有限公司提供。去除胶囊外壳,将粉末溶于双蒸水,配成0.1 g/mL的药液,冷藏备用。ConA:Ⅵ型, SIGMA公司(C2010),用时配成1.25 mg/mL,用过滤器过滤,现配现用。
1.3实验方法将40 只小鼠随机分为正常组(8只)、模型组(16只)、芪参养肝方组(16只)。模型组和芪参养肝方组给予ConA 12.5 mg/kg尾静脉注射造模,每周1次,连续10周,正常组则相应给予生理盐水尾静脉注射。3组均给予正常饲料喂养,正常组和模型造模当天按1 mL/100 g小鼠体质量灌胃双蒸水,每日1次,共10周;芪参养肝方组造模当天按1 mL/100 g小鼠体质量灌胃芪参养肝方药液,每日1次,共10周。
1.4观察指标
1.4.1小鼠肝功能指标3组小鼠均于末次灌胃后24 h取血,全血置于1.5 mL EP管,静置2 h,3 000 r/min离心15 min,吸取血清,自动生化分析仪检测肝功能指标丙氨酸氨基转移酶(ALT)、天门冬氨基酸氨基转移酶(AST)、白蛋白(ALB)。
1.4.2小鼠肝组织中羟脯氨酸(Hyp)含量按南京建成生物工程研究所提供的Hyp测定试剂盒说明书操作:称取新鲜肝组织100 mg剪碎,置于试管中,准确加水解液1 mL,混匀。加盖后95 ℃中水解20 min(为使水解更充分,10 min混匀1次);调节pH值至6.0~7.0:①各试管流水冷却后分别加指示剂1滴,混匀;②各试管内准确加入调pH甲液1 mL,混匀(此时溶液应为红色);③试管内逐滴加入调pH乙液,每滴加入后均需混匀,直至液体中的指示剂变成黄绿色,此时pH值6.0~7.0;加蒸馏水至10 mL,混匀;取3~4 mL稀释的水解液加适量活性炭(20~30 mg),以上清液离心后澄清无色为准,混匀,4 000 r/min离心10 min,取上清液1 mL做检测。计算公式:Hyp含量=(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度) ×标准管含量(5 μg/mL)×水解液总体积(10 mL)/组织湿质量(mg)。
1.4.3小鼠肝组织病理切片染色取新鲜肝脏,清洁后称取肝质量,从肝右叶取1块肝组织,石蜡包埋,做HE、天狼猩红染色。在光镜下观察组织切片的病理变化:ColⅠ纤维紧密排列,为黄色或红色的粗大纤维;ColⅢ纤维为绿色的细纤维。摄片取四周及中央区域胶原纤维含量最多的视野,每个视野含一个汇管区。采用HIPAS-2000型计算机图像分析系统,通过显微摄影系统摄取图像并输入图像分析系统进行灰度转换,使胶原着色区域与背景分开,记录着色面积和总面积。在200倍镜下测定胶原纤维面积,计算胶原定量:胶原纤维面积/肝组织面积×100%,取平均值。
1.4.4小鼠肝组织中α-SMA、ColⅠ、ColⅢ、TGF-β1mRNA表达量采用RT-PCR法测定。①取液氮罐超低温冰箱保存肝脏组织,选用美国Invitrogen公司trizol,按照说明操作提取总RNA。②总RNA浓度测定:取1 μL灭菌纯水,置于RNA浓度测定仪器测定孔,仪器调零;各组总RNA分别取1 μL,加于测定孔,读取RNA浓度及OD260/OD280的比值。OD260/OD280值1.8~2.1说明RNA纯度好;<1.8表明溶液中蛋白或其他有机物污染,>2.1表明RNA已经降解为单核酸。③引物设计与合成 :从NCBI上查得基因序列,用oligo和primer5设计引物,设计好的引物由invitrogen公司合成。④反转录反应: 按照Ferments试剂盒(#K1621)操作。⑤PCR扩增反应。⑥结果分析:根据2-△△CT法,以GAPDH为参照,进行OPN基于表达的相对定量分析。
1.4.5小鼠肝组织中α-SMA、ColI、TGF-β1蛋白表达量采用Western Blot法测定。①提取总蛋白: 从-80 ℃冰箱取出肝组织,剪取一小块(30~50 mg)放入1.5 mL EP管,加入100 μL含1%PMSF的细胞裂解液,用小剪刀将其剪碎。冰上放置30 min使样品裂解充分,14 000 g 4 ℃离心5 min,取上清。②BCA法测定蛋白浓度: 按照试剂盒说明操作,根据读数做出标准曲线,计算各样品浓度。③制样: 每份样品上样总质量为20 μg,上样总体积为10 μL(其中含上样缓冲液2 μL),根据所测蛋白样品浓度,计算样品所需体积,余用0.9%NaCl补足。④制胶: 根据所测蛋白分子量,分别配制10%分离胶和5%浓缩胶灌分离胶,以蒸馏水水封,待凝胶后,将蒸馏水倒去,用滤纸吸干,灌入浓缩胶,插入10孔上样梳,注意避免气泡。⑤上样、电泳:将胶板置于电泳槽,加入电泳液。样品于100 ℃水浴煮沸5 min,依次上样,并留取一孔加入分子量标准。电泳时,起始电压为80 V,待样品进入分离胶后,将电压调至110 V。⑥半干法转膜:以分子量标准为参照,切取所需转膜部分分离胶,标记右上角,浸入转膜液(4 ℃预冷)中平衡15~30 min。分别切取与分离胶大小相似的PVDF膜1张及滤纸2张,膜标记右上角。将膜浸于甲醇中平衡1 min,与滤纸一并浸于转膜液中平衡15~30 min。从下而上,依次将滤纸、膜、分离胶、滤纸置于半干法转膜仪上,注意用玻璃棒排除其中气泡。盖上电转仪盖子,接通电源,根据所转蛋白分子量,室温、25 V恒压电转10~30 min。⑦封闭:将膜置于平皿,加入适量封闭液,置于摇床上,室温封闭2 h。⑧抗体孵育:从封闭液中取出膜,于TBST洗膜液中漂洗3 min。将膜放入杂交袋中,加入适量经稀释的一抗(1∶1 000~1∶500),封口,摇床上4 ℃孵育,过夜。取出膜,进入TBST洗膜液中漂洗3次,每次10 min,换另一杂交袋,加入二抗(1∶1 000),摇床上室温孵育2 h。取出膜,继续用TBST洗膜3次,每次10 min。⑨显影:打开显影暗夹,铺一层保鲜膜,PVDF膜正面朝上放于保鲜膜上,按说明要求将ECL Plus A液和B液1∶1混合,滴于PVDF膜上,静置3 min,吸去多余液体,盖上保鲜膜,排除气泡,移入暗室显影。取出1张X射线胶片,放于条带上面,轻轻盖上暗夹盖,注意防止胶片滑动。根据条带发光的强度,压片10 s~1 min,打开盖子,取出胶片,放入显影液显影,再用清水漂洗下,移入定影液中定影,最后清水漂洗,晾干。⑩图像分析:将胶片条带用图像扫描仪扫描入电脑,用图像分析软件对条带进行分析,以目的蛋白与内参蛋白灰度值的比值作为相对值,比较各样品间蛋白表达的差异性。
1.5统计学方法所有资料采用SPSS 15.0统计软件进行统计学分析。计量资料用均数±标准差表示,组间比较采用单因素方差分析,多重比较采用LSD法,率的比较用2检验。P<0.05表示差异具有统计学意义。
2结果
2.13组小鼠肝功能比较模型组小鼠血清ALT、AST水平明显高于正常组(P均<0.05);芪参养肝方组血清ALT、AST水平明显低于模型组(P均<0.05);3组ALB水平比较差异均无统计学意义(P均>0.05)。见表1。

表1 3组小鼠肝功能比较±s)
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
2.23组小鼠肝组织中Hyp含量比较正常组肝组织中Hyp含量为(58.7±7.2)μg/mg,模型组为(120.3±15.3)μg/mg,芪参养肝方组为(92.2±9.7)μg/mg。模型组Hyp含量明显高于正常组(P<0.05),芪参养肝方组明显低于模型组(P<0.05)。
2.33组小鼠肝组织病理表现
2.3.1HE染色镜下可见正常组小鼠肝细胞肝小叶结构完整,肝索以中央静脉为中心,放射状排列整齐,未见炎性细胞浸润;模型组小鼠肝细胞可见正常肝小叶结构破坏,肝索排列紊乱,镜下可见程度不一的肝细胞坏死区,可见大量炎性细胞浸润;与模型组比较,芪参养肝方组小鼠肝细胞肝小叶结构破坏明显减轻,肝索排列相对整齐,仅在汇管区见少量炎症细胞浸润。见图1~3。
2.3.2天狼猩红染色镜下可见正常组小鼠肝小叶结构完整,肝细胞索排列整齐,仅于汇管区血管周围有少量胶原纤维染色,未见明显胶原增生。模型组小鼠肝组织中胶原明显增生,胶原纤维沿汇管区或炎性坏死区向外延伸,形成厚度不一的纤维间隔,多位于汇管区和血管周围。芪参养肝方组与模型组比较,胶原纤维增生明显减少,纤维化程度有明显好转。见图4~6。天狼猩红染色胶原定量:正常组胶原指数(0.23±0.01)%,模型组胶原指数(9.37±0.73)%,芪参养肝方组胶原指数(5.12±0.47)%,模型组胶原沉积指数明显高于正常组(P<0.05),芪参养肝方组胶原沉积指数明显低于模型组(P<0.05)。
图1 正常组小鼠肝组织HE染色表现(×100)

图2 模型组小鼠肝组织HE染色表现(×100)

图3 芪参养肝方组小鼠肝组织HE染色表现(×100)

图4 正常组小鼠肝组织天狼猩红染色表现(×100)
2.43组小鼠肝组织中α-SMA、TGF-β1、ColⅠ、ColⅢmRNA表达量比较模型组小鼠肝组织中α-SMA 、TGF-β1、ColⅠ、ColⅢmRNA表达量均明显高于正常组(P均<0.05),而芪参养肝方组各指标表达量均明显低于模型组(P均<0.05)。见表2。

图5 模型组小鼠肝组织天狼猩红染色表现(×100)

图6 芪参养肝方组小鼠肝组织天狼猩红染色表现(×100)
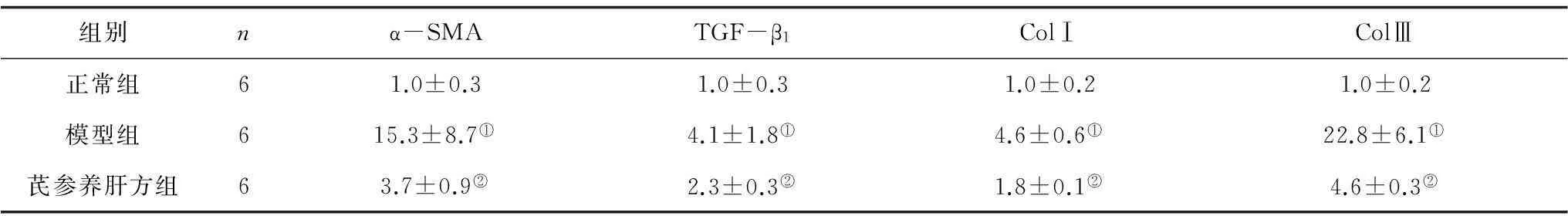
组别nα-SMATGF-β1ColⅠColⅢ正常组61.0±0.31.0±0.31.0±0.21.0±0.2模型组615.3±8.7①4.1±1.8①4.6±0.6①22.8±6.1①芪参养肝方组63.7±0.9②2.3±0.3②1.8±0.1②4.6±0.3②
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
2.53组小鼠肝组织中α-SMA 、TGF-β1、ColⅠ蛋白表达情况比较模型组小鼠肝组织中α-SMA 、TGF-β1、ColⅠ蛋白表达量明显高于正常组(P均<0.05),芪参养肝方组各指标表达量均明显低于模型组(P均<0.05)。见图7~9。

图7 3组小鼠肝组织中α-SMA蛋白表达情况

图8 3组小鼠肝组织中TGF-β1蛋白表达情况

图9 3组小鼠肝组织中ColⅠ蛋白表达情况
3讨论
肝纤维化是肝脏对慢性损伤刺激的自我修复反应,是慢性肝病向肝硬化发展的必经阶段,也是影响慢性肝病预后的重要环节。大量研究已证实肝纤维化在一定条件下可被逆转[1-2],所以发病机制的研究就成了肝病攻关的热点课题之一。研究发现HSC的过度活化是肝纤维化发生的中心环节[3]。HSC在肝内多分布在炎性间隔内,HSC活化增加ECM的形成最终导致纤维化,HSC的收缩作用可能是引起肝纤维化后门静脉压力增高的重要因素,而且HSC几乎能表达基质降解所需要的所有关键成分,在ECM降解过程中起着重要的作用[4]。慢性肝病时多种细胞因子、过氧化产物和ECM成分等与HSCs受体结合,经HSCs膜上的特异性受体通过细胞内的信号转导通路激活核内某些转录因子,促进相关靶基因的转录和表达,从而促进HSC活化、增殖、转型[5]。因此,HSC是在肝纤维化进展过程中起重要作用的细胞,抑制HSC的活化、促进活化的HSC凋亡是逆转肝纤维化的关键。
TGF-β是目前公认的最强力的肝纤维化促进因子,是激活HSC并促进其表达ECM的关键因子。HSC和受损的肝细胞能自分泌和旁分泌TGF-β,使其呈正反馈性增加,从而加重肝纤维化的进程[6]。有研究表明活化的TGF-β不仅加速静态HSC向肌成纤维细胞(MFB)转化,表达α-SMA,而且诱导血小板衍生因子(PDGF)的产生及其受体在HSC上的表达,间接刺激HSC的增殖和活化[7]。
目前国内外尚没有理想的抗肝纤维化药物,而中医通过正确的辨证论治,利用中药复方多成分、多靶点的作用,在抗肝纤维化的治疗中优势突出。近年来随着中医中药抗肝纤维化研究的逐渐深入,发现具有活血化瘀、补气健脾功效的中药有良好的抗肝纤维化作用。本研究所用芪参养肝方中黄芪补气升阳,鳖甲滋阴潜阳、软坚散结,二药共用为君;丹参祛瘀生新而不伤正,“能破宿血,补新血”,为臣;灵芝补肝气、益脾气;赤芍清热凉血、散瘀止痛;五味子益气补虚强阴;白术健脾益气,燥湿利水;陈皮理气健脾,燥湿化痰;柴胡疏肝解郁,引药入肝经;诸药合用共奏益气养阴、活血化瘀、软坚散结之功。现代药理学研究发现,黄芪可以改善肝纤维化患者的肝功能,降低血清ALT、AST水平,减少血清HA、PcⅢ、LN,TGF-β1含量[8-10];黄芪的有效成分黄芪多糖和黄芪总甙还可以抑制HSC的增殖和胶原合成[11]。鳖甲能明显抑制TGF-β1刺激的LX-1细胞的增殖,抑制α-SMA、 ColⅠ、ColⅢ、CoLⅣ、LN等因子的表达,促进ECM的降解,抑制HSC活化增殖及ECM合成分泌,促进ECM降解吸收,调控细胞因子水平及信号传导通路,从而发挥抗肝纤维化的作用[12]。丹参中含有丹参酚、丹参素、丹参酮等多种活性成分,可下调HSC中Smad2、Smad3 mRNA表达并上调Smad7 mRNA表达,通过TGF-β1/Smads信号通路干扰TGF-β1的生物效应,对HSC有直接的抑制作用,起到抑制肝纤维化的作用[13]。灵芝能促进肝脏再生, 加强肝脏的解毒作用及免疫调节作用[14]。赤芍能抑制HSC激活、增殖,促进HSC凋亡,抑制ECM过度沉积[15],大剂量赤芍能促进肝纤维化重吸收[16],与黄芪合用有明显的保肝降酶的作用,能减少HA、LN的沉积,预防治疗肝纤维化[17]。
本研究结果表明,模型组血清ALT、AST水平及肝组织中Hyp含量均明显高于正常组,而芪参养肝方组各指标水平均明显低于模型组。芪参养肝方组肝小叶破坏及胶原纤维增生较模型组明显减轻,胶原沉积明显好转。模型组肝组织中α-SMA、TGF-β1、Col I、ColⅢ mRNA表达量及α-SMA 、TGF-β1、ColⅠ蛋白表达量均明显高于正常组,而芪参养肝方组各指标水平均明显低于模型组。提示芪参养肝方可减少胶原在肝脏的沉积;抑制ConA肝纤维化小鼠α-SMA、TGF-β1分泌,抑制HSC活化,促进活化的HSC凋亡;并能下调ColⅠ、Col Ⅲ mRNA表达,抑制胶原纤维增生;其有保肝降酶、抗肝纤维化作用。
[参考文献]
[1]O’Connell MA,Rushworth SA. Curcumin:potential for hepatic fibrosis therapy?[J]. Br J Pharmacol,2008,153(3):403-405
[2]Arthur MJ. Fibrogenesis II. Metalloproteinases and their inhibitors in liver fibrosis[J]. Am J Physiol Gastrointest Liver Physiol,2000,279(2):245-249
[3]Friedman SL. Hepatic stellate cells:protean,multifunctional,and enigmatic cells of the liver[J]. Physiol Rev,2008,88(1):125-172
[4]Frideman SL. Liver fibrosis from bench to bedside[J]. Hepatol,2003,38 (1):S38-53
[5]Han YP,Zhou L,Wang J,et al. Essential role of matrix metallop roteinases in interleukine-1-induced myofibroblastic activation of hepatic stellate cell in collagen[J]. J Biol Chem,2004,279(6):4820-4828
[6]Kitamura Y,Ninomiya H. Smad expression of hepatic stellate cells in liver cirrhosis in vivo and hepatic stellate cell line in vitro[J]. Pathol Int,2003,53(1):18-26
[7]李春辉,潘理会. 肝纤维化发生机制的研究进展[J]. 承德医学院学报,2005,22(1):62-64
[8]陆江,李辰蕊. 黄芪注射液对早期肝硬化患者生化及肝纤维化指标的影响[J]. 山东中医杂志,2003,22(12):714-715
[9]程鹏,刘素侠,孙晋浩,等. 黄芪抗肝纤维化的作用与TGFβ1的关系[J]. 临床军医杂志,2000,28(3):22-23
[10] 马红,王宝恩,马雪梅. 黄芪抑制大鼠肝星状细胞增殖及胶原分泌的研究[J]. 中国中医药信息杂志,2001,8(4):35-36
[11] 张霄翔,扬雁,陈敏珠. 黄芪多糖对HSC-T6细胞增殖及胶原产生的影响[J]. 中国临床药理学与治疗学,2003,19(8):892-895
[12] 高建蓉,姚航平,刘焱文,等. 鳖甲水煎液药物血清对肝星状细胞的作用[J]. 中华中医药学刊,2013,31(11):2524-2528
[13] 郑磊,戴立里. 丹参素对转化生长因子β1刺激肝星状细胞信号传导的影响[J]. 重庆医科大学学报,2009,34 (2):181-185
[14] 吴保杰. 中草药药理学[M]. 北京:人民卫生出版社,1983:1108
[15] 张巍. 赤芍对肝纤维化因子ECM等的影响[J]. 临床合理用药,2011,4(5A):74-75
[16] 吴静. 赤芍的药理研究及抗肝纤维化临床应用近况[J]. 中西医结合肝病杂志,2008,18(3):189-191
[17] 吕跃山,邢杰,陈英利,等. 黄芪赤芍抗肝纤维化的实验研究[J]. 中国现代医学杂志,2008,18(14):1997-2018
Experimental study on anti-hepatic fibrosis effects of Qishen Yanggan Formula
XU Liying1, GAO Yueqiu2, ZHOU Zhenhua2
(1.The Infectious Disease Hospital of Shanghai Huangpu District, Shanghai 200011; 2.Shuguang Hospital, Shanghai 201203, China)
Abstract:Objective It is to observe the influence of Qishen Yanggan Formula (QSYGF) on hepatic stellate cells (HSC) activation, collagen synthesis, cytokine α-SMA and TGF-β1 secretion in liver of mice with liver fibrosis of ConA-induced, and explore its mechanism of anti-fibrotic portions. Methods 40 cases of BALB/c mice were randomly divided into normal group, model group and treatment group. The animals were intragastriced with liquid medicine of QSYGF during the model making. The content of hydroxyproline in liver tissue and liver function in mice were detected in three groups, the mRNA expressions of α-SMA, ColⅠ, ColⅢ and TGF-β1 were measured by RT-PCR and the protein expressions of α-SMA, ColⅠ and TGF-β1 were detected by Western Blot. Results The ALT, AST levels and the content of hydroxyproline in liver tissue in the model group were significantly higher than those in the normal group (all P<0.05), but the indexes in the treatment group were markedly reduced than the model group (all P<0.05). HE and Sirius red staining showed: compared with the model group, the damage of hepatic lobule and collagen fiber hyperplasia was significantly reduced; the collagen deposition was improved obviously in QSYGF group. The mRNA expression level of α-SMA, TGF-β1, ColⅠ, ColⅢ and protein expressions of α-SMA, TGF-β1, ColⅠ in model group were significantly higher than those in the normal group (all P<0.05), while all the indexes in the treatment group were decreased significantly than those in the model group (all P<0.05). Conclusion QSYGF can inhibit the secretion of the cytokine α-SMA, TGF-β1 and HSC activation in ConA-induced liver fibrosis mice model, promote the apoptosis of active HSC, and reduce the mRNA expression of ColⅠand ColⅢ, inhibit collagen hyperplasia; and has good effect of hepatoprotective and anti hepatic fibrosis.
Key words:Qishen Yanggan Formula; ConA; hepatic fibrosis
[收稿日期]2015-08-01
[中图分类号]R-332
[文献标识码]A
[文章编号]1008-8849(2016)06-0593-05
doi:10.3969/j.issn.1008-8849.2016.06.007
[作者简介]徐莉英,女,主治医师,研究方向为慢性乙肝肝纤维化的诊断和治疗。[通信作者]高月求,E-mail:gaoyueqiu@hotmail.com
