Roscovitine在衣霉素诱导足细胞损伤中的保护作用
2016-05-31高翔张悦张爱金付芃李佳琳吴建刘巍
高翔,张悦,张爱金,付芃,李佳琳,吴建,刘巍△
Roscovitine在衣霉素诱导足细胞损伤中的保护作用
高翔1,2,张悦3,张爱金1,付芃1,李佳琳1,吴建1,刘巍1△
摘要:目的应用衣霉素诱导内质网应激(ERS),观察Roscovtine对ERS导致足细胞损伤的保护作用。方法体外培养永生化小鼠足细胞,取37℃分化成熟细胞随机分组:(1)正常对照组、DMSO组及衣霉素Tunicamycin(1.0 μmol/L,TM)组,各实验组分别刺激3、6、12 h。(2)正常对照组、Tunicamycin(1.0 μmol/L,TM)组及Tunicamycin+Rosco⁃vitine(20、40 μmol/L,TM+ROS)组,各实验组分别刺激12 h。应用流式细胞术及TUNEL法检测足细胞凋亡情况;应用Western blot检测细胞周期素依赖性蛋白激酶5(Cdk5)及ERS标志蛋白GRP78、Caspase-12、CHOP的表达变化。结果(1)与正常对照组和DMSO组相比,Tunicamycin刺激3、6及12 h后,TM组足细胞凋亡率及Cdk5、GRP78、Caspase-12和CHOP蛋白的表达水平均呈明显的时间依赖性增高(P < 0.05);(2)加入Roscovitine干预后,与TM组相比,TM+ROS(20、40 μmol/L)组足细胞凋亡率及GRP78、Caspase-12和CHOP蛋白的表达水平均显著降低(P < 0.05),其干预作用呈现明显的剂量依赖性。结论Cdk5抑制剂Roscovitine能显著抑制衣霉素诱导的足细胞凋亡,从而发挥细胞保护作用。Roscovitine的足细胞保护作用可能有助于糖尿病肾病的治疗。
关键词:足细胞;凋亡;衣霉素;细胞周期素依赖性蛋白激酶5;内质网应激;Roscovitine
△通讯作者E-mail:lwei929@126.com
糖尿病肾病(diabetic nephropathy,DN)是糖尿病重要的血管并发症,是导致糖尿病患者死亡的重要原因之一。研究显示,足细胞作为肾小球滤过屏障的重要组成部分,其损伤在DN蛋白尿和肾小球硬化的进展中发挥了重要作用[1]。内质网应激(en⁃doplasmic reticulum stress,ERS)是细胞对各种有害刺激最为关键的应答机制,而过度ERS可直接导致细胞功能异常甚至死亡。已有研究显示,过度ERS导致的足细胞凋亡在DN的发生发展中发挥了重要作用[2]。因此,有效地抑制ERS可能会成为治疗DN的新方向。然而,目前尚没有针对DN的特异性ERS抑制剂。本课题组前期研究发现,1型糖尿病大鼠的细胞周期素依赖性蛋白激酶(Cdk)5在足细胞的表达较正常对照大鼠明显增高,Cdk5参与了ERS介导的细胞凋亡过程,并与大鼠肾功能受损程度密切相关;而Cdk5抑制剂Roscovitine能明显改善糖尿病大鼠的肾功能,减轻肾组织病变程度[3]。但是,Roscovitine发挥细胞保护作用的具体机制尚不清楚。本研究通过衣霉素(Tunicamycin,TM)诱导小鼠足细胞凋亡,探讨Roscovitine对足细胞过度ERS的影响,以期为DN的治疗提供新思路。
1 材料与方法
1.1材料条件性永生化小鼠足细胞购自中国医学科学院基础医学研究所细胞中心。Cdk5抗体购自美国Epitomics公司;β-actin、GRP78购自美国SAB公司;Caspase-12购自美国Abcam公司;CHOP购自Cell Signaling Technology公司。TM、Roscovitine和Ⅰ型胶原蛋白购自美国Sigma公司。DMEM培养基、胎牛血清购自美国Gibco公司。重组小鼠γ-干扰素(γ-interferon,γ-IFN)购自美国PeproTech公司。TUNEL凋亡检测试剂盒购自美国罗氏公司。Annexin V/PI凋亡检测试剂盒购自美国BD公司。
1.2方法
1.2.1细胞培养条件性永生化小鼠足细胞培养方法参照文献[4]。培养时,培养瓶及培养板底部均预先铺被0.1 g/L的Ⅰ型胶原蛋白。未分化足细胞用含有10%胎牛血清(FBS)、20 U/mL γ-IFN、100 U/mL青霉素和100 mg/L链霉素的DMEM培养基在33℃、5% CO2培养箱中培养,促进细胞增殖传代(许可条件)。许可条件下培养的足细胞按1∶10传代后,在37℃用不添加γ-IFN的DMEM培养基(含10% FBS、100 U/mL青霉素和100 mg/L链霉素)培养10~15 d(非许可条件),诱导足细胞分化成熟。
1.2.2实验分组足细胞在无血清培养基培养24 h后进行后续实验。(1)观察TM对足细胞凋亡及蛋白表达的影响,细胞分组:正常对照(Control)组、DMSO组、TM(1.0 μmol/L)组,分别刺激3、6、12 h。(2)观察Roscovitine对TM诱导足细胞凋亡及蛋白表达的影响,细胞分组如下:正常对照(Control)组;TM(1.0 μmol/L)组;TM+Roscovitine(20、40 μmol/L,TM+ ROS)组,各实验组分别刺激12 h。
1.2.3流式细胞术检测足细胞凋亡按1.2.2(1)、(2)分组并培养细胞,各实验组细胞刺激结束后,加入胰酶-EDTA消化细胞,室温1 000 r/min离心4 min,弃上清,加生理盐水洗涤2次。收集1×105个细胞,并加入500 μL Binding buffer,反复吹打均匀制成单细胞悬液;分别加入5 μL FITC标记的An⁃ nexin V和5 μL碘化丙啶(PI),混匀后避光室温孵育10 min。流式细胞仪检测细胞凋亡率,计算各组细胞Annexin-FITC 和PI染色细胞百分含量。
1.2.4Western blot检验相关蛋白表达按1.2.2(1)、(2)分组并培养细胞,收集各组细胞,提取总蛋白并行Western blot检测蛋白表达水平。各组蛋白样品分别取100 μg总蛋白,加6×上样缓冲液,100℃变性5 min,经10% SDS-PAGE凝胶电泳后,电转移至PVDF膜。5%脱脂奶粉37℃封闭2 h,加入Cdk5(1∶1 000)、GRP78(1∶1 000)、Caspase-12(1∶500)、CHOP(1∶1 000)和β-actin(1∶2 000)抗体,4℃孵育过夜。TBST洗膜后,加辣根过氧化物酶标记的羊抗兔或鼠免疫球蛋白(Ig)G(1∶5 000),37℃孵育2 h。TBST洗膜后,滴加ECL试剂,于Odyssey FC图像采集成像系统中显影,并对条带进行定量分析。以目的条带和β-actin条带积分光密度值比值作为最终结果。
1.2.5TUNEL检测细胞凋亡率以末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)法,按试剂盒说明进行细胞凋亡检测,DAPI复染细胞核。凋亡足细胞核呈绿色荧光。每张切片于凋亡细胞分布区域随机读取10个高倍视野,计算出平均每100个细胞中的凋亡细胞数,以百分数(%)表示凋亡百分率,每张切片重复3次。
1.3统计学方法采用SPSS 13.0统计软件进行统计。符合正态分布的计量资料以均数±标准差(±s)表示,多组间均数比较采用方差分析,组间多重比较用LSD-t法。P < 0.05为差异有统计学意义。
2 结果
2.1TM对足细胞凋亡的影响TM分别处理3、6及12 h后,与对照组和DMSO组相比,TM组足细胞凋亡率均增高(P < 0.05)。同时,TM对足细胞凋亡的影响呈明显的时间依赖性(P < 0.05),见表1、图1。
2.2TM对足细胞中Cdk5、GRP78、Caspase-12、CHOP表达的影响与Control组和DMSO组相比,TM刺激3、6及12 h后,足细胞中Cdk5、GRP78、Caspase-12及CHOP蛋白的表达水平均显著增高(均P < 0.05),并呈明显的时间依赖性(P < 0.05),见表2、图2。
Tab.1 The podocyte apoptotic rates treated by TM in three groups表1 TM处理后各组足细胞的凋亡率(n=3,%,±s)

Tab.1 The podocyte apoptotic rates treated by TM in three groups表1 TM处理后各组足细胞的凋亡率(n=3,%,±s)
*P<0.05;a与Control组比较;b与DMSO组比较;A与3 h组比较;B与6 h组比较,P < 0.05
组别Control组DMSO组TM组F 3 h 3.26±0.74 3.11±0.29 13.79±0.95ab265.66*6 h 2.99±0.39 3.16±0.62 22.38±1.61abA481.13*12 h 4.36±0.94 3.97±0.56 34.87±2.56abAB522.96*F 6.35 0.17 328.71*
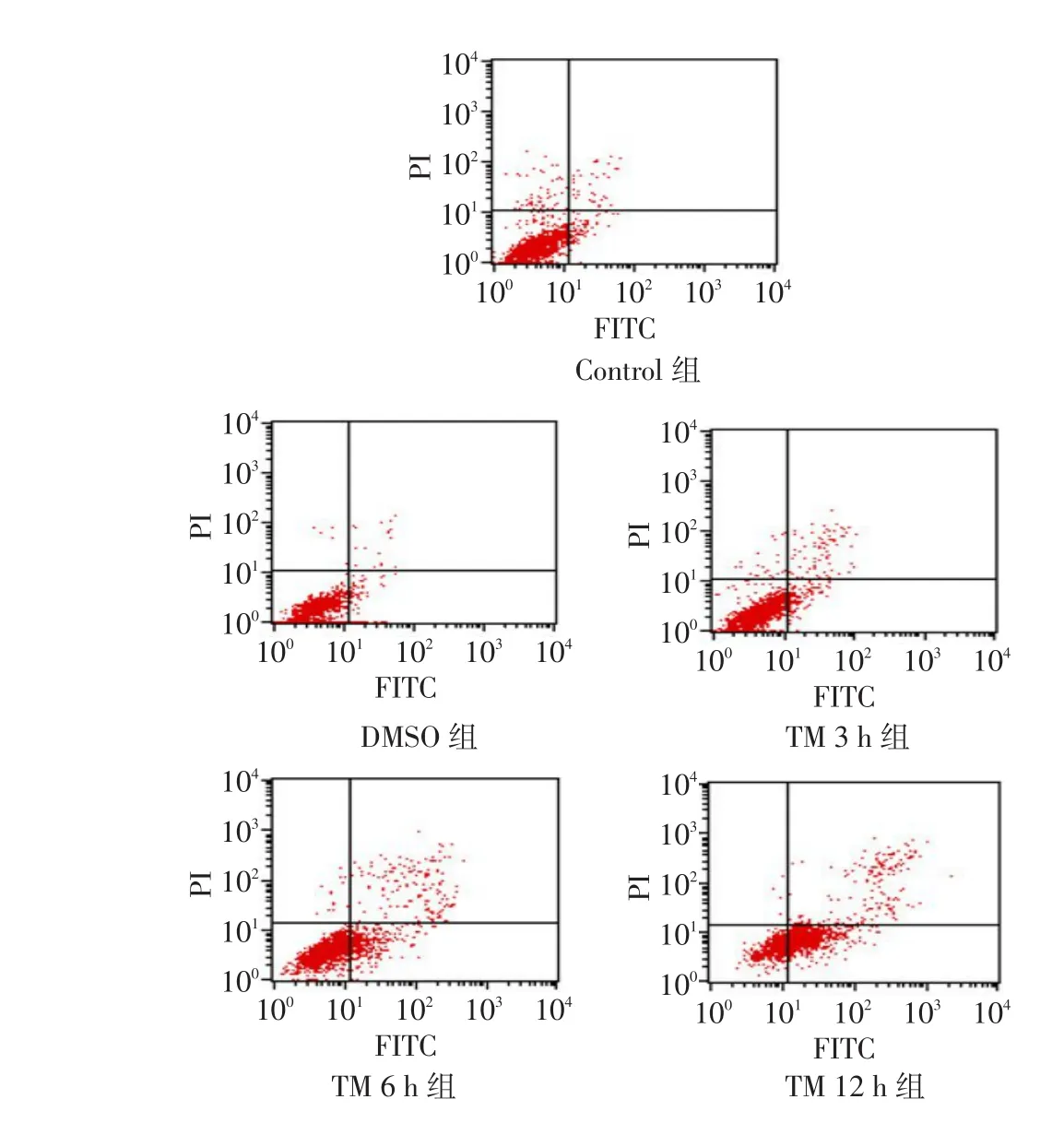
Fig.1 The podocyte apoptotic rates after TM treatment in four groups图1 TM刺激后各组足细胞凋亡率
Tab. 2 The integrated optical density of proteins after TM treatment in four groups表2 TM刺激后各组足细胞蛋白表达的积分光密度值(n=3,±s)

Tab. 2 The integrated optical density of proteins after TM treatment in four groups表2 TM刺激后各组足细胞蛋白表达的积分光密度值(n=3,±s)
*P<0.05;a与Control组比较,b与DMSO组比较,c与TM 3 h组比较,d与TM 6 h组比较,P<0.05
组别Control组DMSO组TM 3 h组TM 6 h组TM 12 h组F Cdk5 0.17±0.05 0.24±0.06 0.51±0.09ab0.67±0.03abc0.83±0.06abcd56.45*GRP78 0.42±0.13 0.40±0.08 0.86±0.05ab1.09±0.13abc1.33±0.17abcd34.41*Caspase-12 0.16±0.03 0.24±0.02 0.41±0.09ab0.53±0.05abc0.66±0.08abcd33.55*CHOP 0.06±0.03 0.06±0.02 0.34±0.08ab0.59±0.07abc0.78±0.06abcd96.14*

Fig.2 Expressions of Cdk5, GRP78, Caspase-12 and CHOP after TM treatment in four groups图2 TM刺激后各组Cdk5、GRP78、Caspase-12和CHOP蛋白的表达情况
2.3Roscovitine对TM诱导足细胞凋亡的影响TM组足细胞凋亡率高于Control组、TM+ROS(20 μmol/L)组和TM+ROS(40 μmol/L)组,并且TM+ROS(40 μmol/L)组细胞凋亡率低于TM+ROS(20 μmol/L)组,Control组凋亡率最低(均P < 0.05)。TUNEL检测结果显示,应用Roscovitine干预后,TM+ROS组足细胞凋亡率均显著低于TM组(均P < 0.05),见表3、图3。
Tab. 3 Podocyte apoptotic rates detected by flow cytometry and TUNEL after roscovitine treatment表3 流式细胞术和Tunel检测Roscovitine处理后足细胞凋亡率 (n=3,%,±s)

Tab. 3 Podocyte apoptotic rates detected by flow cytometry and TUNEL after roscovitine treatment表3 流式细胞术和Tunel检测Roscovitine处理后足细胞凋亡率 (n=3,%,±s)
*P<0.05;a与Control组比较;b与TM组比较;c与TM+ROS(20 μmol/L)组比较,P < 0.05;表4同
组别Control组TM组TM+ROS(20 μmol/L)组TM+ROS(40 μmol/L)组F流式细胞术4.82±0.60 37.96±3.54a21.63±1.31ab14.04±1.77abc177.20*TUNEL 3.19±0.52 38.46±3.31a20.97±1.31ab14.18±1.02abc238.42*

Fig. 3 The podocyte apoptosis detected by TUNEL (×400)图3 TUNEL法检测足细胞凋亡(×400)
2.4Roscovitine对TM诱导足细胞中GRP78、Cas⁃pase-12和CHOP表达的影响与TM组相比,TM+ROS(20 μmol/L)组和TM+ROS(40 μmol/L)组足细胞中GRP78、Caspase-12和CHOP的蛋白表达水平降低(P < 0.05),并且TM+ROS(40 μmol/L)组较TM+ROS(20 μmol/L)组的作用效果更显著,但这2组蛋白表达水平仍高于Control组(P < 0.05),见表4、图4。
Tab. 4 The integrated optical density of proteins after roscovitine treatment表4 Roscovitine处理后各组足细胞蛋白表达的积分光密度值 (n=3,±s)

Tab. 4 The integrated optical density of proteins after roscovitine treatment表4 Roscovitine处理后各组足细胞蛋白表达的积分光密度值 (n=3,±s)
组别Control组TM组TM+ROS(20 μmol/L)组TM+ROS(40 μmol/L)组F GRP78 0.46±0.05 2.23±0.38a1.48±0.08ab0.94±0.12abc40.51*Caspase-12 0.33±0.04 1.88±0.07a0.81±0.08ab0.48±0.05abc349.56*CHOP 0.28±0.06 2.33±0.38a1.16±0.16ab0.71±0.03abc53.54*

Fig. 4 Expressions of GRP78, Caspase-12 and CHOP after roscovitine treatment in four groups图4 Roscovitine处理后各组GRP78、Caspase-12和CHOP蛋白的表达情况
3 讨论
足细胞是一种终末分化的肾小球上皮细胞,附着于肾小球基底膜外侧,是参与构成肾小球滤过屏障的关键结构。足细胞数目及密度的下降是导致DN蛋白尿产生和肾小球硬化的重要原因。凋亡是造成足细胞数目减少的重要原因之一[5]。
一般情况下,内质网的正常生理功能主要是折叠、修饰和降解分泌蛋白和跨膜蛋白;生理和病理状态下,大量未折叠蛋白在内质网中蓄积会导致ERS的发生。糖尿病状态下,高糖、ROS、游离脂肪酸、糖基化终产物等因素会导致内质网中大量未折叠蛋白的产生,从而诱发ERS。ERS导致肾脏固有细胞,如系膜细胞、足细胞凋亡,是促进DN发生发展的重要因素[6-7]。因此,抑制ERS可能成为治疗DN的一个重要方法。为了研究DN进展中ERS对足细胞的影响,本研究采用TM刺激足细胞,诱导ERS的发生,结果显示,TM处理后足细胞内ERS标志蛋白GRP78的表达水平高于Control组,并且随处理时间的延长,ERS相关凋亡蛋白Caspase-12和CHOP的表达水平及足细胞的凋亡率也有增高,提示TM的刺激可以诱导足细胞ERS及凋亡的发生。
ERS发生后主要通过ATF6、IRE1和PERK三种跨膜蛋白传递信号,调节内质网功能,从而减轻细胞损伤或诱导细胞凋亡[6]。然而,目前尚不清楚是否有其他蛋白介导了ERS引起的细胞凋亡过程。Cdk5是Cdk家族的特殊成员,是脯氨酸限制性丝/苏氨酸蛋白激酶,普遍存在于哺乳动物的细胞内。在氧化应激、高血糖、缺氧等因素下,Cdk5可被过度激活并过度磷酸化某些底物,从而导致细胞凋亡,参与多种疾病的发生[8]。肾组织中,Cdk5表达于足细胞中,对维持足细胞的正常结构及功能有重要作用[9]。在高糖环境中,足细胞中Cdk5的表达水平及激酶活性有显著的增高,而抑制Cdk5的表达可以显著降低高糖诱导的足细胞凋亡,Cdk5的过度表达及过度激活是导致糖尿病足细胞凋亡的原因[10]。Kang等[11]发现,Cdk5参与了常染色体显性色素性视网膜炎中ERS导致的细胞凋亡过程,但其是否参与ERS诱导的足细胞凋亡过程尚不清楚。本研究显示,TM处理后,足细胞中Cdk5的蛋白表达水平显著高于Control组,并呈明显的时间依赖性,提示ERS可能通过提高Cdk5的表达水平而诱导足细胞凋亡。
Roscovitine是一种强效的二代细胞周期蛋白依赖性激酶抑制剂,对Cdk5的激酶活性具有高效的抑制作用[12]。高浓度Roscovitine处理Heymann肾炎大鼠模型结果显示,其对肾小球中足细胞有很好的保护作用[13]。笔者前期研究显示,应用Roscovi⁃tine处理糖尿病大鼠,能够有效地减轻糖尿病大鼠肾功能的损伤及病理改变,具有明显的肾脏保护作用[3]。本研究显示TM诱导的足细胞凋亡可以被Roscovitine抑制,足细胞凋亡率在Roscovitine干预组显著低于单纯TM处理组,并且40 μmol/L的干预效果显著优于20 μmol/L组。同时,Western blot结果显示,Roscovintine的干预可以显著降低足细胞中ERS相关凋亡蛋白CHOP和Caspase-12的表达水平,表明Cdk5明显参与了ERS诱导的足细胞凋亡过程,采用Roscovitine抑制Cdk5活性对降低ERS导致的足细胞凋亡具有良好的效果,具有一定的肾脏保护作用。
综上所述,在DN发展过程中,ERS可通过增强Cdk5的表达而诱导足细胞凋亡,抑制Cdk5可能会成为治疗DN的新靶点。虽然大量体内外研究证实Roscovitine可通过抑制Cdk5发挥神经、肾脏等保护功能,并且可以从不同方面干预DN的进展,然而还缺乏长期、大量的临床研究证实。本研究结果为DN的防治提供了新的思路和方向。
参考文献
[1] Reidy K, Kang HM, Hostetter T, et al. Molecular mechanisms of dia⁃betic kidney disease [J]. J Clin Invest, 2014, 124(6):2333-2340. doi: 10.1172/JCI72271.
[2] Zhuang A, Forbes JM. Stress in the kidney is the road to pERdition: is endoplasmic reticulum stress a pathogenic mediator of diabetic nephropathy [J]? J Endocrinol, 2014, 222(3):R97-111. doi: 10.153 0/JOE-13-0517.
[3] Zhang Y, Zhou Y, Zhang Y, et al. Effects of Cdk5 inhibitor Roscovi⁃tine on renal function and nestin expression in diabetic rat [J]. Chi⁃nese Pharmacological Bulletin, 2013, 29(8):1077-1078. [张悦,周毅,张怡,等. Cdk5抑制剂Roscovitine对糖尿病大鼠肾功能及nestin表达的影响[J].中国药理学通报, 2013, 29(8):1077-1078].
[4] Mundel P, Reiser J, Zúñiga Mejía Borja A, et al. Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocyte cell lines [J]. Exp Cell Res, 1997, 236:248-258.
[5] Anil Kumar P, Welsh GI, Saleem MA, et al. Molecular and cellular events mediating glomerular podocyte dysfunction and depletion in diabetes mellitus [J]. Front Endocrinol (Lausanne), 2014, 5:151. doi: 10.3389/fendo.2014.00151.
[6] Madhusudhan T, Wang H, Dong W, et al. Defective podocyte insu⁃lin signalling through p85-XBP1 promotes ATF6-dependent mal⁃adaptive ER-stress response in diabetic nephropathy [J]. Nat Com⁃mun, 2015, 6:6496. doi: 10.1038/ncomms7496.
[7] Ding Y, Choi ME. Autophagy in diabetic nephropathy [J]. J Endocri⁃ nol, 2015, 224(1):R15-30. doi: 10.1530/JOE-14-0437.
[8] Arif A. Extraneuronal activities and regulatory mechanisms of the atypical cyclin- dependent kinase Cdk5 [J]. Biochem Pharmacol, 2012, 84(8):985-993. doi: 10.1016/j.bcp.2012.06.027.
[9] Griffin SV, Hiromura K, Pippin J, et al. Cyclin-dependent kinase 5 is a regulator of podocyte differentiation, proliferation, and morphol⁃ogy [J]. Am J Pathol, 2004, 165(4):1175-1185.
[10] Zhang Y, Li H, Hao J, et al. High glucose increases Cdk5 activity in podocytes via transforming growth factor-β1 signaling pathway [J]. Exp Cell Res, 2014, 326(2):219- 229. doi: 10.1016/j.yex⁃cr.2014.04.014.
[11] Kang MJ, Chung J, Ryoo HD. CDK5 and MEKK1 mediate proapoptotic signalling following endoplasmic reticulum stress in an au⁃tosomal dominant retinitis pigmentosa model [J]. Nat Cell Biol, 2012, 14(4): 409-415. doi: 10.1038/ncb2447.
[12] Le Tourneau C, Faivre S, Laurence V, et al. Phase I evalua⁃tion of seliciclib (R- roscovitine), a novel oral cyclin- dependent ki⁃nase inhibitor, in patients with advanced malignancies [J]. Eur J Cancer, 2010, 46(18):3243-3250. doi: 10.1016/j.ejca.2010.08.001.
[13] Milovanceva-Popovska M, Kunter U, Ostendorf T, et al. R-rosocvi⁃tine (CYC202) alleviates renal cell proliferation in nephritis without aggravating podocyte injury [J]. Kidney Int, 2005, 67(4):1362-1370. doi:10.1111/j.1523-1755.2005.00213.x.
(2015-06-08收稿2015-08-24修回)
(本文编辑陆荣展)
作者单位:1河北医科大学病理学教研室(邮编050017);2河北医科大学第二医院血管外科;3河北医科大学诊断学教研室
The role of roscovitine in tunicamycin induced podocyte injury
GAO Xiang1, 2, ZHANG Yue3, ZHANG Ai′jin1, FU Peng1, LI Jialin1, WU Jian1, LIU Wei1△
1 Department of Pathology, Hebei Medical University, Shijiazhuang 050017, China; 2 Department of Vascular Surgery, the Second Hospital of Hebei Medical University, 3 Department of Diagnostics, Hebei Medical University
△Corresponding Author E-mail: lwei929@126.com
Abstract:Objective To observe the protective effects of roscovitine on the podocyte injury induced by endoplasmic reticulum stress (ERS) caused by tunicamycin. Methods The differentiated podocytes cultured at 37℃were randomly di⁃vided into: (1) Control group, DMSO group and tunicamycin group (TM, 1.0 μmol/L). The treatment was given for 3, 6 and 12 hours in three groups. (2) For control group, tunicamycin group, tunicamycin+roscovitine group (20, 40 μmol/L, TM+ROS), the treatment was given for 12 hours. The podocyte apoptosis was detected by flow cytometry and TUNEL method. The ex⁃pressions of Cdk5, GRP78, Caspase-12 and CHOP were detected by Western blot assay. Results (1) Compared with con⁃trol group and DMSO group, the podocyte apoptosis was increased significantly in a time dependent manner after tunicamy⁃cin treatment in TM group; the protein expressions of Cdk5, GRP78, Caspase-12 and CHOP were also up-regulated signifi⁃cantly in TM group (P < 0.05). (2) Flow cytometry and TUNEL analysis showed that tunicamycin induced apoptosis in podo⁃cytes, which was significantly inhibited by roscovitine in a concentration dependent manner in TM+ROS group as compared to that of TM group (P < 0.05). The protein expressions of GRP78, Caspase-12 and CHOP were also significantly decreased in a concentration dependent manner in TM+ROS group compared to those of TM group (P < 0.05). Conclusion Roscovi⁃tine, the inhibitor of Cdk5, can reduce the podocyte apoptosis induced by tunicamycin. The protective effects of roscovitine on podocytes can be a novel approach of treating diabetic nephropathy.
Key words:podocyte; apoptosis; Tunicamycin; Cdk5; endoplasmic reticulum stress; Roscovitine
中图分类号:R692.6
文献标志码:A
DOI:10.11958/59025
基金项目:国家自然科学基金资助项目(81400731);河北省自然科学基金资助项目(H2013206139,H2015206257);河北省卫生和计划生育委员会重点科技研究计划项目(20130140);河北医科大学大学生创新性实验计划资助项目(201410089018)
作者简介:高翔(1982),男,主治医师,硕士,主要从事糖尿病血管病变研究
