大蒜素治疗白塞病的效果和安全性评价
2016-05-31钟建桥先德海
钟建桥,先德海
大蒜素治疗白塞病的效果和安全性评价
钟建桥1,先德海2
摘要:目的评价大蒜素对白塞病(BD)的治疗效果和安全性的影响。方法将38例主要累及皮肤黏膜和关节的BD患者用随机数字表法分为治疗组(20例)和对照组(18例),分别予以大蒜素和安慰剂连续口服12周,随访至16周。观察2组BD患者治疗前后临床症状和实验室检测值的变化,比较2组的治疗效果和不良反应。结果共有31例患者完成试验,治疗组有效率为88.89%,明显高于对照组(7.69%),差异有统计学意义;治疗后治疗组血中白细胞计数(WBC)与治疗前及对照组比较均无明显差异(P > 0.05),而红细胞沉降率(ESR)和C反应蛋白(CRP)水平则较治疗前及对照组显著降低(P < 0.01);尽管大蒜素有一些不良反应,但大部分患者能耐受且停药后可消退。结论大蒜素是治疗BD的一种安全有效的药物,疗效明显优于安慰剂,值得进一步研究和推广。
关键词:大蒜素;白塞病;随机对照试验
白塞病(Behcet′s disease, BD)是一种多系统炎症性疾病,可累及皮肤黏膜、眼部、血管等多个系统,严重可导致视力损伤甚至危及生命,迄今为止仍无满意的治疗方法[1]。BD的确切发病机制尚不明确,大多认为主要与遗传、感染、免疫及氧化应激有关。大蒜素是大蒜中的主要生物活性成分,具有抗感染、抗炎、抗氧化、调节免疫等作用,目前已被广泛应用于感染性疾病、心血管疾病、肿瘤等疾病的治疗[2-3],而关于大蒜素用于BD的治疗目前尚鲜见报道。笔者前期研究发现大蒜素对实验性BD有显著疗效[4]。本研究通过开展临床研究观察大蒜素对BD的有效性和安全性,以期为BD治疗提供新途径。
1 资料与方法
1.1患者资料选取2013年9月—2014年12月来我院皮肤科门诊就诊的BD患者38例,其中男22例,女16例;年龄20~69岁,平均(37.5±15.3)岁,病程2个月~7年,平均(46.3±38.9)个月。入选标准:(1)所有患者在入选前2个月没有使用过激素、免疫抑制剂、生物制剂和抗氧化剂等药物。(2)符合BD国际研究小组制定的诊断标准[5],即每年至少有3次复发性口腔溃疡并且至少伴发2种下述表现:眼部损害、复发性生殖器溃疡皮损(包括假性毛囊炎、结节性红斑、痤疮样皮疹和丘疹性脓疱疹)和针刺反应阳性(用钝针倾斜刺入皮肤48 h后,若针刺部位出现脓疱或毛囊炎样皮损,为皮肤针刺反应试验阳性)。(3)损害局限于皮肤黏膜或关节(关节炎/关节痛)。若伴有下述之一情况者须排除:近期曾摄入大蒜类制剂,对大蒜过敏,孕期或哺乳期,患有中、重度眼部损害、神经系统炎症或累及其他内脏需接受免疫抑制剂治疗者,伴有慢性病变或重症疾病(包括精神病、全身感染、心肝肾呼吸系统疾病、血液病、红斑狼疮和肿瘤等)。在入选前,向患者详细介绍本研究的目的、方案、持续时间以及大蒜素治疗的优点和潜在的风险。所有患者已签知情同意书,研究方案经伦理委员会审核同意。
1.2药物大蒜素胶囊由江苏正大清江制药有限公司生产(批号:H32025683),每片含量为20 mg。安慰剂外观、大小和颜色同大蒜素胶囊一致,内含乳糖、预胶化淀粉、羧甲淀粉钠等成分。
1.3方法
1.3.1试验设计和随访采用随机对照开放安慰剂方法将38例BD患者分为治疗组(20例)和对照组(18例)。治疗组予以大蒜素口服,对照组予以安慰剂口服,均为每次1片,每日3次,连续12周。所有患者随访至16周。分别在治疗前、治疗开始后4周、12周和16周随访。每次随访时一旦有任何相关的系统症状出现,应立即行眼部、神经系统和内脏系统等方面的专业检查。一旦发生下述情况应立即终止试验:发生系统疾病需要其他治疗,中、重度眼部损害,出现神经系统或内脏疾患,对治疗无依从性或拒绝继续进行试验。
1.3.2实验室检查常规检查2组治疗前及治疗16周后的血常规、红细胞沉降率(ESR)和C反应蛋白(CRP)水平。
1.3.3疗效评估根据患者临床表现和实验室检查结果的变化对其治疗效果进行评价。痊愈:临床症状和体征消失,停药后无复发,实验室检查未见异常。显效:大部分症状和体征消失,实验室检查基本正常。好转:部分症状和体征消失或改善,实验室检查结果有所改善。无效:临床症状、体征及实验室检查无改善或加重。有效率=(痊愈例数+显效例数)/总例数。
1.3.4安全性评价即在随访时对患者出现的药物不良反应进行评价,主要包括皮疹、异味、恶心、呕吐和腹痛以及其他可能出现的不良反应。
1.4统计学方法所有数据均用SPSS 15.0软件进行统计分析,计量资料以±s表示,组间比较采用t检验,治疗前后比较采用配对t检验;计数资料组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果
2.1一般资料比较2组BD患者的年龄、性别构成和病程比较均无明显差异(P > 0.05),见表1。
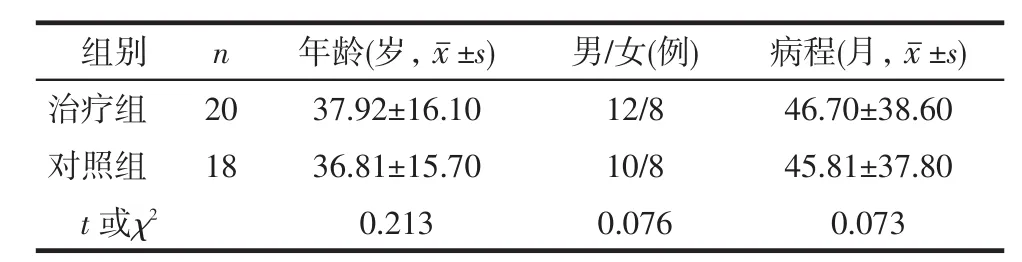
Tab. 1 Comparison of basic characteristics between two groups of patients表1 2组BD患者一般资料比较
2.2临床疗效评价至16周实验结束时,共有31例患者完成本次临床研究,治疗组18例,对照组13例,其中治疗组的有效率高于对照组(P < 0.01),见表2。
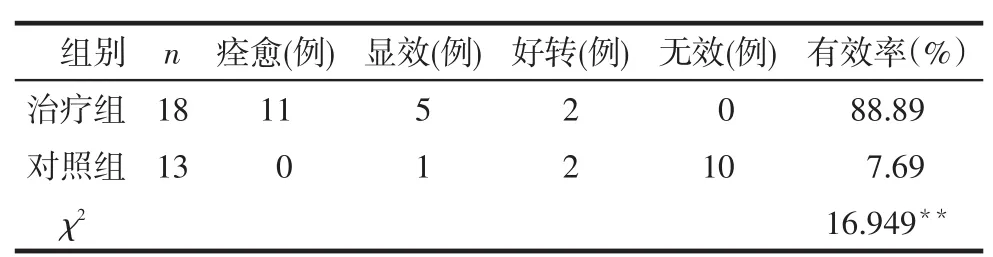
Tab. 2 Comparison of clinical efficacy between two groups of patients表2 2组临床疗效比较
2.3实验室检测结果2组BD患者治疗后的白细胞计数(WBC)与治疗前均无明显差异(P > 0.05);治疗前、后2组间WBC差异亦无统计学意义。治疗组经大蒜素治疗后ESR和CRP水平均明显降低(P < 0.05),而对照组治疗后的ESR和CRP水平与治疗前无明显差异(P > 0.05);治疗前2组的ESR 和CRP水平无明显差异,治疗后治疗组的ESR和CRP水平明显低于对照组(P < 0.05),见表3。
Tab.3 Comparison of WBC, ESR and CRP levels before and after treatment between two groups表3 2组治疗前后WBC、ESR及CRP水平比较 (±s)

Tab.3 Comparison of WBC, ESR and CRP levels before and after treatment between two groups表3 2组治疗前后WBC、ESR及CRP水平比较 (±s)
*P < 0.05
组别治疗组对照组t n 18 13 WBC (×109/L)治疗前7.29±3.86 7.37±3.85 0.057治疗后6.35±2.13 7.19±3.16 0.886 t 0.905 0.130 ESR (mm/1 h)治疗前42.13±16.87 41.92±16.11 0.035治疗后13.69±5.10 39.75±15.83 6.565*t 6.846*0.346 CRP (mg/L)治疗前69.25±16.15 69.32±16.28 0.012治疗后9.53±3.65 65.95±17.16 13.613*t 15.303*0.505
2.4大蒜素的不良反应2组患者的不良反应均很少,但治疗组更易出现不良反应。主要包括:特殊臭味(10例)、胃肠道不适(5例)、体质量减轻(2例)和过敏反应(1例)。治疗组1例患者因过敏反应而中断治疗,1例因治疗效果不明显退出。其余患者均能耐受反应而完成整个研究,并且这些不良反应在药物停止治疗后消失,对工作和生活无明显影响。
3 讨论
目前关于BD的治疗尚无有效的根治方法。虽然一些传统药物如激素、免疫抑制剂、细胞毒素剂等对BD有一定疗效,但停药后易复发,并且长期使用可能导致严重的不良反应,如严重感染或继发性恶性肿瘤[6]。近年来也有报道采用β干扰素、肿瘤坏死因子抑制剂等生物制剂治疗BD,但由于其潜在不良反应或昂贵的费用而限制其使用[7]。大蒜素来源于新鲜大蒜,为百合科植物大蒜鳞茎中所含的一种生物活性成分,其价额低廉、来源丰富,不良反应较少。同时具有抗炎、抗感染、抗氧化、降血压、降血脂、预防心脑血管疾病等多种药理作用,尤其在心血管损伤的防治研究较多[8-10]。作为嫡属血管炎性疾病的BD,其病因可能与感染、氧化、免疫有关,故在大蒜素广泛用于治疗各种心血管疾病等安全有效的启示下,笔者推测大蒜素可能具有治疗BD的作用。本临床试验结果表明,大蒜素能较好治疗BD患者的皮肤黏膜及关节部位损害,有效率明显优于安慰剂(88.89% vs 7.69%),且能明显降低BD患者血中的ESR和CRP水平,进而有效控制BD患者的现有症状,防止重要脏器的损伤,减缓疾病的发展。与笔者前期实验结果[4]和国内谢晓莉等[11]研究结果一致。谢晓莉等[11]研究发现外用大蒜素软膏能有效地缓解口腔溃疡疼痛,促进口腔溃疡愈合,减少复发,其作用机制可能与大蒜素抗菌、消炎、改善局部微循环和免疫调节有关。此外,本研究还发现大蒜素的不良反应不大,尽管有一些不良反应如特殊臭味、胃肠道不适、体质量减轻和过敏反应等,除1例因过敏反应中止试验外,其余均能耐受,并且在停药后其不良反应消失,对生活工作无不良影响。再次证实大蒜素是一种具有多种治疗作用,不良反应较轻的中草药替代物,值得进一步研究和推广。
参考文献
[1] Mat MC, Sevim A, Fresko I, et al. Behçet′s disease as a systemic disease [J]. Clin Dermatol, 2014, 32(3):435- 442. doi: 10.1016/j. clindermatol.2013.11.012.
[2] Rahman MS. Allicin and other functional active components in gar⁃lic: Health benefits and bioavailability [J]. Int J Food Pro, 2007, 10 (2): 245-268. doi:10.1080/10942910601113327.
[3] Chan JY, Yuen AC, Chan RY, et al. A review of the cardiovascular benefits and antioxidant properties of allicin [J]. Phytother Res, 2013, 27(5):637-646. doi: 10.1002/ptr.4796.
[4] Zhong JQ, Xian DH, Liao YM. To investigate the treatment and mechanism of Allicin on Behcet′s disease [J]. Chongqing Medicine, 2014, 32(43): 4273-4276.[钟建桥,先德海,廖勇梅.大蒜素对贝赫切特病的治疗作用及机制探讨[J].重庆医学, 2014, 32(43): 4273-4276].
[5] Davatchi F, Sadeghi Abdollahi B, Chams-Davatchi C, et al. The sa⁃ga of diagnostic/classification criteria in Behcet′s disease[J]. Int J Rheum Dis,2015,18(6):594-605. doi: 10.1111/1756-185X.12520.
[6] Fresko I, Yazici H. Treatment strategies for Behcet′s disease [J]. Ex⁃pert Opin Pharmacother, 2008, 9: 3211- 3219. doi: 10.1517/ 14656560802457749.
[7] Saleh Z, Arayssi T. Update on the therapy of Behçet disease [J]. Ther Adv Chronic Dis, 2014, 5(3):112- 134. doi: 10.1177/ 2040622314523062.
[8] Borlinghaus J, Albrecht F, Gruhlke MC, et al. Allicin: chemistry and biological properties [J]. Molecules, 2014, 19(8):12591-12618. doi: 10.3390/molecules190812591.
[9] Chan JY, Tsui HT, Chung IY, et al. Allicin protects rat cardiomyo⁃blasts (H9c2 cells) from hydrogen peroxide-induced oxidative inju⁃ry through inhibiting the generation of intracellular reactive oxygen species [J]. Int J Food Sci Nutr, 2014, 65(7):868-873. doi: 10.3109/ 09637486.2014.925428.
[10] Lin CH, Pan SY. The clinical study of allicin combined with aspirin in the treatment of angina pectoris [J]. World Health Digest, 2012, 9 (26): 449-450. [林创辉,潘少奕.大蒜素联合拜阿司匹林治疗冠心病心绞痛的临床应用[J].中外健康文摘, 2012, 9(26): 449-450].
[11] Xie XL, Tang ZG, Yuan TH. The clinical study of garlic on recur⁃rent oral ulcer [J]. J Clin Stommol, 2004, 20 (2):113-114. [谢晓莉,唐瞻贵,袁涛洪.佳力克(大蒜素)治疗口腔溃疡的临床研究[J].临床口腔医学杂志, 2004, 20 (2):113-114].
(2015-07-07收稿2015-09-10修回)
(本文编辑闫娟)
作者单位:1泸州医学院附属医院皮肤科(邮编646000);2泸州医学院解剖教研室
Efficacy and safety of allicin in Behcet′s disease
ZHONG Jianqiao1, XIAN Dehai2
1 Department of Dermatology, the Affiliated Hospital of Luzhou Medical College, Luzhou 646000, China;
2 Department of Human Anatomy, Luzhou Medical College
Abstract:Objective To evaluate the efficacy and safety of allicin in patients with Behcet′s disease (BD). Methods Thirty-eight patients with BD that was mainly involved skin, mucosa and joints were divided into treatment group (20 cases) and control group (18 cases) by randomized digital table method. Two groups of patients were respectively assigned to receive allicin tablets and identical placebo vehicles for 12 weeks, and were followed up to 16 weeks. The changes of clinical symp⁃toms and laboratory detection were observed in the time of pretreatment and post-treatment in two groups. Meanwhile, the ef⁃ficacy and side effects were compared between both groups. Results A total of 31 patients completed the experiment. The effective rate was 88.89% in treatment group, which was significantly higher than that of the control group (7.69%, P < 0.01). After administration of allicin or placebo, there was no significant difference in white blood cell (WBC) count between treat⁃ment group and control group(P > 0.05). The levels of ESR and CRP were significant lower in treatment group than those in pretreatment and control group (P < 0.01). Although allicin displayed some adverse reactions, most patients could tolerate them, and these side effects tended to dissipate once the drug ceased. ConclusionAllicin is a safe and effective drug in the treatment of BD, which is significantly better than placebo, and is worth to be further researched and promoted.
Key words:Allcin; Behcet′s disease (BD); randomized controlled trials
中图分类号:R758.69
文献标志码:A
DOI:10.11958/59156
基金项目:四川省卫生厅科研课题(100283)
作者简介:钟建桥(1973),女,副主任医师,博士,主要从事皮肤美容与炎症性疾病研究
