嵌合抗原受体T细胞治疗原发性肿瘤的优势与研究进展
2016-05-31张巍闫丹丹高莉邵明亮闫会敏
张巍,闫丹丹,高莉,邵明亮,闫会敏△
嵌合抗原受体T细胞治疗原发性肿瘤的优势与研究进展
张巍1,闫丹丹2,高莉2,邵明亮1,闫会敏1△
摘要:嵌合抗原受体(Car)T细胞因不仅具有较强特异性识别肿瘤抗原的特性,还具有杀伤性、亲和力高等优点,因而受到较多的关注。尽管其在抗肿瘤方面发挥了很多优势,但是仍存在不足之处,需要进一步优化来提高其临床应用的安全性。本研究对Car T细胞结构及其生物功能、治疗流程、应用进展以及应用风险进行综述,为进一步在临床开展Car T免疫治疗提供参考。
关键词:嵌合抗原受体T;细胞治疗;肿瘤;综述
△通讯作者E-mail:yanhm_2538@163.com
2013年《Science》杂志评选的“十大科技突破”中,肿瘤免疫治疗被列为首位。免疫治疗主要包括肿瘤非特异性小分子化合物免疫治疗、过继性细胞免疫治疗(adoptive cellular therapy, ACT)、肿瘤疫苗治疗、肿瘤单克隆抗体的免疫治疗、分子靶向治疗和基因治疗等。其中ACT应用最为广泛,是将体外培养的T细胞或自然杀伤(natural killer, NK)细胞回输到患者体内,目的是利用这些体外培养、活化或者基因修饰的细胞所拥有的抗肿瘤、抗病毒活性来治疗疾病[1]。这种治疗技术能够使具有抗肿瘤活性的效应细胞在短时间内扩增、活化,并且仅有轻微的不良反应。目前,肿瘤浸润淋巴(tumor infiltrating lymphocyte, TIL)细胞、淋巴因子激活杀伤(lymphokine activated killer, LAK)细胞、细胞因子诱导的杀伤(cytokine-induced killer, CIK)细胞、NK细胞和NKT细胞等用于临床ACT中,取得了一定的疗效[2]。一直以来,研究者尝试使用基因修饰的T淋巴细胞实现对肿瘤细胞的杀伤作用,如使用白细胞介素(IL)-2、IL-15或者T细胞受体(T cell receptor ,TCR)、嵌合抗原受体(chimeric antigen receptor,Car)等来修饰T淋巴细胞[3]。本文对Car T细胞结构、生物功能及其流程和使用范围综述如下。
1 Car T细胞结构及其生物功能
Car是一种能够特异性识别并结合肿瘤抗原的嵌合受体,利用基因工程技术将其与T细胞的活化基序结合,即将抗体对肿瘤抗原的高亲和性与T淋巴细胞的杀伤机制相结合,使T细胞表达特异性的Car,从而具有特异性识别并杀伤肿瘤细胞的能力。目前Car结构经历了3代进化。第1代Car的基本结构,胞内信号域只嵌合TCR/CD3的ζ链或免疫球蛋白Fc受体(FcεRI)的γ链[4];第2代Car胞内段添加一个协同刺激分子;第3代Car胞内段添加2个以上协同刺激分子[5]。
Car T细胞因不仅具有较强特异性识别肿瘤抗原的特性,还具有杀伤性、亲和力高等优点,因而受到较多关注[6]。Car T细胞能与特异性肿瘤抗原结合,产生主要组织相容性复合体(major histocompatibility complex,MHC)非限制性的活化,进而发挥抗肿瘤效应[7]。Car T细胞抗肿瘤作用不依赖人类白细胞抗原(human leukocyte antigen,HLA)分子,而且可使T淋巴细胞尤其是CD8+T细胞绕过抗原提呈细胞,不受免疫逃逸的影响。Car T细胞能够产生颗粒酶、穿孔素,直接介导肿瘤细胞溶解,也可以诱导巨噬细胞分泌IL-6等,间接影响肿瘤细胞的生长[8]。Car T细胞还能上调表达MHC-Ⅱ、干扰素(interferon,IFN)-γ、CD86、IL-2、IL-15等,对抗肿瘤、抑制微环境,进而影响肿瘤的生长[9]。另外,Car T细胞具有一定的增殖能力,在体外能够迅速增殖到治疗剂量,减少治疗等待时间;在体内维持治疗剂量,保证治疗效果,产生针对特定肿瘤抗原记忆型的T淋巴细胞,增强Car T细胞在临床试验中的可行性[5]。Car T细胞与另一种采用TCR基因修饰的T细胞相比,TCR只能识别蛋白类抗原,而Car除可以识别蛋白类抗原外,还可以识别糖类以及糖脂类抗原,因而扩大了靶点的选择范围[10]。与抗体药物相比,Car T细胞成功地将抗体的靶向特异性与T细胞结合起来用于肿瘤治疗,不仅具有靶向特异性,还具有归巢和组织穿透的能力[11]。
2 Car T细胞治疗试验流程
Car T技术应用于临床包括特异性抗肿瘤细胞的制备及回输,具体流程分为以下步骤:(1)在细胞治疗前,需进行全面实验室及影像学的常规检查。从癌症患者外周血单个核细胞中分离出细胞。(2)在1~2周的时间内完成细胞的体外激活、扩增和质量检测。利用基因工程将CD3-ζ链或FcεR Ⅰγ的胞内部分在体外偶联为一个嵌合蛋白,通过基因转导的方法转染患者的T细胞,使其表达Car。患者的T细胞被“重编码”后,生成大量肿瘤特异性的Car T细胞。(3)体外培养,大量扩增细胞至治疗所需剂量,一般需要单位体积1× 108~1×109/L以上。(4)进行回输之前清除患者体内的免疫抑制细胞,减少肿瘤负荷,从而起到增强疗效的作用。(5)回输细胞,观察疗效并严密监测不良反应,包括可能的发热、B细胞抑制、细胞因子效应等。(6)对接受细胞治疗的患者进行长期随访,关注患者原发疾病的状态、患者免疫系统功能及各系统功能的情况。定期进行CT扫描、骨髓免疫组化淋巴细胞持续增殖观察,外周血淋巴细胞表面标志的流式细胞检查等。
3 Car T治疗肿瘤的应用进展
3.1血液肿瘤Car T细胞回输后会在患者体内大量扩增,并清除白血病细胞,也是目前细胞治疗应用效果较好的领域。为了更好地活化T细胞,很多试验开始研究第3代Car,如CD23、免疫球蛋白κ链等,寻找最佳的信号组合。有学者认为,肿瘤坏死因子CD134-4-1BB协同刺激可使Car T细胞持续稳定增殖[12]。有研究显示5例复发难治的成人急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)患者接受抗CD19 Car修饰的T细胞治疗后获得了完全缓解[13]。有研究表明抗CD38、CD56的Car T对人多发性骨髓瘤(Multi⁃ple myeloma,MM)细胞有较强的细胞毒性[14]。
在美国血液学会(ASH)第55届年会上,3个课题组分别报道了抗CD19的Car T细胞在治疗慢性、急性淋巴细胞性白血病以及B细胞淋巴瘤的早期临床治疗效果。研究者构建了不同结构的Car T细胞,如FAP特异性Car T细胞、抗PSMA-Car T细胞、FR-Car-T细胞、EGFRv-ICOS-Car-T细胞、GD2-Car-T细胞[15]。宾夕法尼亚大学Michael Kalos对6例慢性淋巴细胞白血病患者、4例ALL儿童以及2例ALL成人患者行靶向CD19的Car T细胞治疗,除1例淋巴细胞白血病儿童外,其余患者外周血或骨髓中均未发现B细胞,获得完全缓解。费城大学Stephan Grupp对60多例复发急淋和慢淋患者行靶向CD19的Car T细胞治疗,其缓解率达90%。James N. Kochenderfer对13位难治性B细胞淋巴瘤患者行靶向CD19的Car T细胞治疗,12例获得部分或完全缓解[15]。
3.2原发性肝癌(hepatocellular carcinoma,HCC) HCC是一种常见的恶性肿瘤,肝癌患者体内天然免疫、特异性免疫功能低下,根治性手术切除率低,术后复发率高,放射、化学治疗疗效差,易发生肝内播散及肝外转移,因此急需寻找新的有效治疗方法。
乙型肝炎病毒(hepatitis B virus,HBV)的感染增加患者发生肝硬化和肝癌的风险。HBV的共价闭环DNA(covalen⁃tiy closed circular DNA, cccDNA)是病毒复制的模板,构建cccDNA特异性Car T细胞,并回输至感染HBV小鼠模型中,结果显示cccDNA特异性Car T细胞在HBV感染的小鼠中可存活和扩增,并定位于病毒感染的肝脏部位,特异性识别并杀伤有HBV复制的肝癌细胞,发挥抗肿瘤效应[16]。另有研究成功构建两种靶向黏蛋白(mucin,MUC1)Car表达框的重组慢病毒Jurkat Car T细胞株,两种Jurkat Car T细胞均能特异性识别MUC1分子,特异性杀伤MUC1高表达的肝癌细胞QGY-7701,但是对MUC1低表达的正常肝细胞基本不杀伤[17]。
3.3其他肿瘤研究显示Car T细胞在治疗肺癌、前列腺癌、卵巢癌、神经胶质瘤、神经母细胞瘤等其他肿瘤中发挥强烈的抗肿瘤效应。有研究应用针对神经节苷脂(GD2)的Car T细胞治疗11例儿童神经母细胞瘤患者,在8例可评价疗效患者中4例患者出现肿瘤坏死与消退,其中1例患者为完全缓解,这11例患者随访2年均未见明显不良反应[18]。有研究对19例接受抗GD2 Car T细胞治疗的高危神经母细胞瘤患者进行长期随访,发现GD2-CAR-T细胞具有抗神经母细胞瘤作用,这些Car T细胞可在患者体内扩增并持续存在,而Car T细胞的持续存在与患者的长期生存相关[19]。另有研究应用间皮素特异性mRNA Car T细胞治疗间皮素高表达的晚期实体瘤,取得了较好的临床疗效[20]。
4 Car T细胞治疗肿瘤的应用风险
Car T细胞治疗肿瘤的应用风险包括:(1)Car T细胞用于临床治疗的首要问题就是脱靶效应。Car T细胞定向的肿瘤抗原大多数为肿瘤相关抗原,这样就会导致对其他组织的免疫攻击,若这些抗原在重要的脏器上有表达,就会造成免疫系统的损伤。在临床试验前,可应用抗体封闭正常组织上的肿瘤相关性抗原(tumor associated antigen,TAA),降低每次输注的Car T细胞数量,构建跨信号Car(Car结构中T细胞活化信号1即CD3ζ与共刺激信号CD28分子不直接相连)或者通过引入自杀基因系统来预防及治疗这种脱靶毒性。(2)Car T细胞大量杀伤肿瘤细胞,产生细胞因子(如IFN-γ、IFN-α、TNF-α、IL-1、IL-6和IL-12等)的大量释放进入血液循环,形成细胞因子释放综合征(cytokine release syndrome,CRS),引起患者急性呼吸窘迫综合征(acute respiratory dis⁃tress synodrome, ARDS)和多器官衰竭(multiple organ dysfunc⁃tion synodrome, MODS)。例如结肠癌伴肝肺转移患者在接受特异性Car T细胞回输联合环磷酰胺非清髓预处理,迅速出现ARDS导致死亡[21]。(3)插入T细胞中的外源DNA片段造成了T细胞结构的改变,从而有一定的致瘤风险。(4)转染方式的选择也限制了其临床应用。电穿孔转染效率低、失败率高,造成时间的浪费。目前,最具有临床应用前景的慢病毒法虽然转染效率高,但是仍有基因毒性。(5)免疫逃逸也是Car T细胞免疫治疗中遇到的问题。若肿瘤细胞下调表面抗原的表达,会影响Car T细胞的治疗效果,并且肿瘤细胞异质性较高,即使是同种类型的肿瘤抗原也有可能表达不同细胞表面抗原,进而使临床治疗效果不佳[22]。
美国重组DNA咨询委员会在2010年针对Car T细胞在临床试验中出现的问题提出了以下几点建议[23]:(1)引入自杀基因的人工调控开关,诱导转染自杀基因并识别靶抗原的T细胞凋亡来减轻相关的毒性反应。(2)临床上严格按照Ⅰ期临床试验进行治疗,采用剂量爬坡的适量方法,把细胞剂量由小到大分几次回输到患者体内,防止速发的细胞毒性。(3)在T细胞中同时转入抑制性的Car,构建双靶抗原Car T细胞。抑制性的Car将与效应T细胞的激活产生拮抗作用。(4)临床上在使用第2代或者第3代Car T细胞治疗时,不用或者谨慎使用IL-2,进而降低潜在的细胞毒性。(5)采用低剂量、多次输注Car T细胞的方法,建立免疫记忆的潜能、增加Car T细胞的抗肿瘤特异性,减少对健康组织的损伤。
5 小结
随着细胞免疫治疗HCC技术的不断进步,Car T细胞免疫治疗越来越受到人们的关注。尽管其在抗肿瘤方面发挥了很多优势,但是仍存在不足之处,需要进一步优化来提高其临床应用的安全性。如何在提高Car T细胞特异性杀伤肿瘤细胞的同时避免各种风险是目前迫切需要解决的问题。但是,笔者认为,随着医学研究的不断深入,Car T细胞免疫治疗应用于原发性肿瘤将会成为细胞免疫治疗的中坚力量。
参考文献
[1] Enblad G, Karlsson H, Loskog AS. Car T-cell therapy: the role of physical barriers and immunosuppression in lymphoma[J]. Hum Gene Ther, 2015, 26(8):498-505. doi: 10.1089/hum.2015.054.
[2] Chen F, Fan C, Gu X, et al. Construction of anti-CD20 singlechain antibody-CD28-CD137-TCRζ recombinant genetic modified T cells and its treatment effect on B cell lymphoma[J]. Med Sci Monit, 2015,21(21):2110-2115. doi: 10.12659/MSM.893791.
[3] Huang X, Park H, Greene J, et al. IGF1R- and ROR1-specific Car T cells as a potential therapy for high risk sarcomas[J]. PLoS One, 2015, 10(7):e0133152. doi: 10.1371/journal.pone.0133152.
[4] Maude SL, Teachey DT, Porter DL, et al. CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia [J]. Blood, 2015, 125(26): 4017-4023. doi: 10.1182/blood-2014-12-580068.
[5] Kalos M, Levine BL, Porter DL, et al. T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia[J]. Sci Transl Med, 2011, 3(95): 95ra73. doi: 10.1126/scitranslmed.3002842.
[6] Ramos CA, Dotti G. Chimeric antigen receptor (CAR)-engineered lymphocytes for cancer therapy[J]. Expert Opin Biol Ther, 2011, 11 (7):855-873. doi: 10.1517/14712598.2011.573476.
[7] Zhou ZF, Jiang JH, Li JY, et al. IL-12 induced antitumor effects of NK cells in the microenvironment of hepatocellular carcinoma[J]. Chinese Journal of Cancer Biotherapy, 2013,20(1):93-98. [周智锋,江金华,李洁羽,等,IL-12诱导肝癌微环境中NK细胞活化发挥抗肿瘤作用[J].中国肿瘤生物治疗杂志,2013,20(1):93-98]. doi:10.3872/j.issn.1007-385X.2013.01.016.
[8] Spear P, Barber A, Rynda-Apple A, et al. Chimeric antigen recep⁃tor t cells shape myeloid cell function within the tumor microenvi⁃ronment through IFN-α and GM-CSF[J]. J Immunol, 2012, 188(12): 6389-6398.doi: 10.4049/jimmunol.1103019.
[9] Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptormodified T cells for acute lymphoid leukemia[J]. N Engl J Med, 2013, 368(16):1509-1518. doi: 10.1056/NEJMoa1215134.
[10] Han EQ, Li XL, Wang CR, et al. Chimeric antigen receptor-engi⁃neered T cells for cancer immunotherapy: progress and challenges [J]. J Hematol Oncol, 2013, 6:47. doi: 10.1186/1756-8722-6-47.
[11] Jones BS, Lamb LS, Goldman F, et al. Improving the safety of cell therapy products by suicide gene transfer[J]. Front Pharmacol, 2014, 5:254. doi: 10.3389/fphar.2014.00254.
[12] Meylan F, Hawley ET, Barron L, et al. The TNF-family cytokine TL1A promotes allergic immunopathology through group 2 innate lymphoid cells[J]. Mucosal Immunol, 2014, 7(4):958- 968. doi: 10.1038/mi.2013.114.
[13] Ma Q, Wang Y, Lo AS, et al. Cell density plays a critical role in ex vivo expansion of T cells for adoptive immunotherapy[J]. J Biomed Biotechnol, 2010, 2010:386545. doi: 10.1155/2010/386545.
[14] Pak Y, Zhang Y, Pastan I, et al. Antigen shedding may improve effi⁃ciencies for delivery of antibody-based anticancer agents in solid tumors[J]. Cancer Res, 2012, 72(13):3143- 3152. doi: 10.1158/ 0008-5472.CAN-11-3925.
[15] Krebs K, Böttinger N, Huang LR, et al. T cells expressing a chime⁃ric antigen receptor that binds hepatitis B virus enxelope proteins control virus replicatong in mice.[J]. Gastroenterology, 2013, 145(2): 456-465.doi: 10.1053/j.gastro.2013.04.047.
[16] Brentjens RJ, Curran KJ, Seinstra BA, et al. Enhancing antitumor ef⁃ficacy of chimeric antigen receptor T cells through constitutive CD40L expression[J]. Mol Ther, 2015, 23(4):769-778. doi: 10.1038/ mt.2015.4.
[17] Song DG, Ye Q, Carpenito C, et al. In vivo persistence,tumor local⁃ization,and antitumoractivity of CAR- engineered T cells is en⁃hanced bycostimulatory signaling through CD137 (4-1BB)[J]. Can⁃cer Res, 2011, 71(13):4617-4627. doi: 10.1158/0008-5472.CAN-11-0422.
[18] Shen CJ, Yang YX, Han EQ, et al. Chimeric antigen receptor con⁃taining ICOS signaling domain mediates specific and efficient anti⁃tumor effect of T cells against EGFRvIII expressing glioma[J]. J He⁃matol Oncol, 2013, 6:33. doi: 10.1186/1756-8722-6-33.
[19] Ma YD, Wang Z, Gong RZ, et al. Target to mucin 1 chimeric anti⁃gen receptor modified Jurkat T cell specific killer hepatoma cells[J]. Journal of Second Military Medical University, 2014,11 (35):1177-1182. [马宜冬,王真,巩睿智,等,靶向黏蛋白1嵌合抗原受体修饰的Jurkat T细胞特异杀伤肝癌细胞[J].第二军医大学学报,2014,11(35):1177-1182]. doi:10.3724/SP.J.1008.2014.01177.
[20] Louis CU, Savoldo B, Dotti G, et al. Antitumor activity and longterm fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma[J]. Blood, 2011, 118(23):6050-6056. doi: 10.1182/ blood-2011-05-35444.
[21] Hillerdal V, Essand M. Chimeric antigen receptor- engineered T cells for the treatment of metastatic prostate cancer[J]. Bio Drugs, 2015, 29(2):75-89. doi: 10.1007/s40259-015-0122-9.
[22] Lamers CH, van Steenbergen-Langeveld S, van Brakel M, et al. Tcell receptor-engineered T cells to treat solid tumors: T cell pro⁃ cessing toward optimal T cell fitness[J]. Hum Gene Ther Methods, 2014, 25(6):345-357. doi: 10.1089/hgtb.2014.051.
[23] Beatty GL, Haas AR, Maus MV, et al. Mesothelin-specific chimeric antigen receptor mRNA-engineered T cells induce anti-tumor ac⁃tivity in solid malignancies[J]. Cancer Immunol Res, 2014, 2(2): 112-120. doi: 10.1158/2326-6066.CIR-13-0170.
(2015-05-14收稿2015-09-23修回)
(本文编辑陈丽洁)
miRNA-7对食管癌细胞TE-1化疗耐药的影响

Fig. 4 The EGFR distribution of transfection control group and transfection group (Confocal microscope ,×400)图4 转染对照组和转染组EGFR分布(共聚焦显微镜,×400)
亚低温联合载神经干细胞的纤维蛋白支架对颅脑创伤的
修复作用
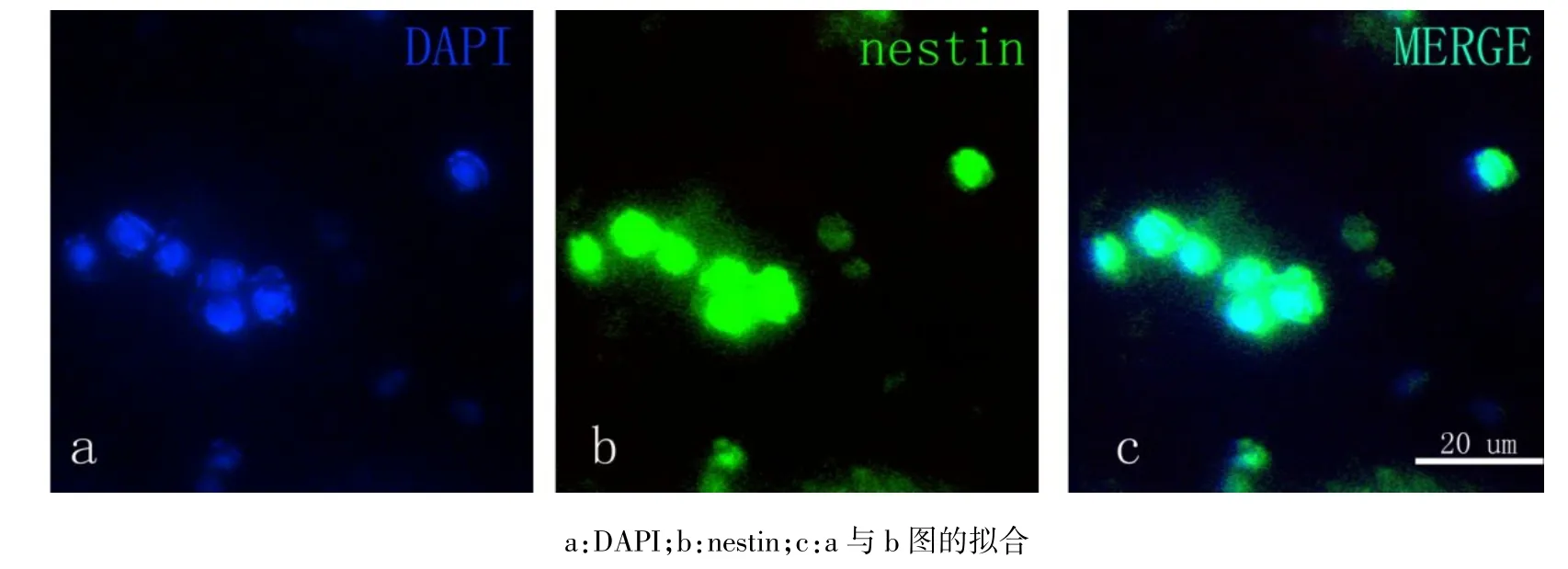
Fig. 2 The mixed fibrin scaffold’s nestin immunofluorescence staining图2 共培养支架Nestin染色

Fig. 3 BrdU labeled NSCs was differented into neurons图3 BrdU标记的神经干细胞分化为神经元
补肾和脉方治疗动脉粥样硬化炎症的效果及机制探讨

Fig.1 HE staining of thoracic aorta lesions of three groups (×40)图1 3组小鼠胸主动脉斑块HE染色(×40)

Fig. 2 Immunohistochemical staining of CD68 in thoracic aorta lesions of three groups (SP,×40)图2 3组小鼠胸主动脉斑块内巨噬细胞(CD68)的免疫组化染色(SP,×40)
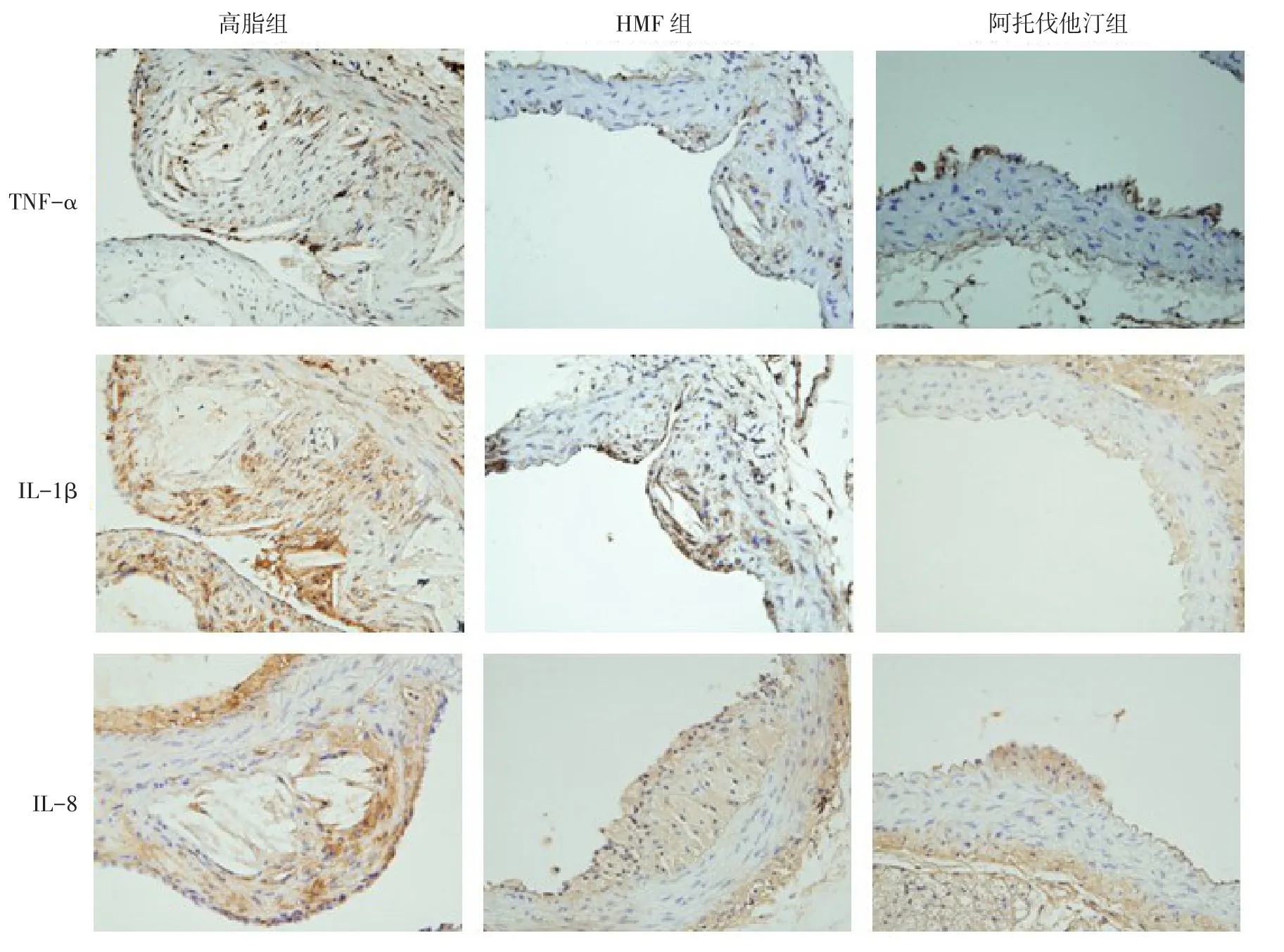
Fig. 3 Immunohistochemistry staining of TNF-α,IL-1β,IL-8 in thoracic aorta lesions of three groups(SP,×40)图3 3组小鼠胸主动脉斑块内TNF-α、IL-1β和IL-8的免疫组化染色(SP,×40)
槲皮素对痛风性关节炎大鼠的治疗作用及肾功能的影响

Fig. 2 Morphological examination of kidney with HE staining(×10)图2 病理组织形态学结果(HE,×10)
辛二酰苯胺异羟肟酸对人卵巢癌细胞恶性表型的抑制作用

Fig.1 Effects of SAHA on the cell cycle of ovarian carcinoma cells图1 不同浓度SAHA对3组细胞周期的影响
作者单位:1石家庄市第五医院研究所(邮编050021);2河北师范大学
The advantages and research progress of T cells of the chimeric antigen receptor in the treatment of primary tumors
ZHANG Wei1, YAN Dandan2, GAO Li2, SHAO Mingliang1, YAN Huimin1△
1 Institute of Liver Diseases, Shijiazhuang Fifth Hospital, Shijiazhuang 050021, China; 2 Hebei Normal University
△Corresponding Author E-mail: yanhm_2538@163.com
Abstract:Chimeric antigen receptor (Car) T cells, not only have the characteristics of strong specific recognition of tu⁃mor antigens, but also have destruction and high affinity advantages, thus receiving more attention. Although it has played a lot of advantages in anti-tumor, it still has some shortcomings, which needs to be further optimized to improve the safety of its clinical application. In this study, The cell structure and biological function, treatment process, application development and application risk of Car T cells are reviewed, which provide references for further clinical immunotherapy of Car T.
Key words:Car T; cell therapy; neoplasms; review
中图分类号:R73-36+2
文献标志码:A
DOI:10.11958/58917
基金项目:河北省卫生厅科研项目(ZD20140735)
作者简介:张巍(1976),女,副主任医师,主要从事肿瘤早期干预研究
