双重实时荧光定量PCR检测人维生素D受体的方法学构建
2016-05-31喻妙梅于洋张俊姚霜潘丽莉罗光华
喻妙梅,于洋,张俊,姚霜,潘丽莉,罗光华
双重实时荧光定量PCR检测人维生素D受体的方法学构建
喻妙梅,于洋,张俊,姚霜,潘丽莉,罗光华△
摘要:目的建立单管检测人维生素D受体(VDR)及甘油醛-3-磷酸脱氢酶(GAPDH)基因的双重实时荧光定量聚合酶链反应(dual real-time PCR)的方法。方法以GAPDH基因为内参,采用Primer Premier 5.0软件设计特异性引物及TaqMan探针,进行PCR扩增检测VDR基因。将VDR及GAPDH扩增产物片段纯化后克隆构建成重组质粒,作为定量检测基因表达的标准品,并用于分析该方法的灵敏度和重复性。结果PCR扩增产物经测序分析证实为VDR及GAPDH特异性片段;该方法检测VDR与GAPDH灵敏度达40拷贝/μL;线性范围为4.00×101~4.00×105拷贝/μL;决定系数R2分别为0.998、0.999;扩增效率E分别为96.10%、85.15%;批内变异系数(CV)分别为0.09%~ 1.21%、0.35%~0.88%;批间CV分别为0.17%~0.51%、0.51%~2.46%。结论成功建立了单管检测人VDR及GAPDH的双重实时荧光定量PCR方法,且该方法特异性好、灵敏度高、可快速高通量检测VDR的相对表达量,有效缩短时间,减小实验误差。
关键词:受体,骨化三醇;聚合酶链反应;甘油醛-3-磷酸脱氢酶类;维生素D受体;双重实时荧光定量PCR
△通讯作者E-mail:shineroar@163.com
维生素D受体(vitamin D receptor, VDR)为亲核蛋白,是介导1,25-(OH)2D3发挥生物效应的核内生物大分子,属于类固醇激素/甲状腺激素受体超家族成员。VDR广泛分布于人体各组织细胞中,其中结肠、肾脏、骨骼等部位及淋巴细胞中的表达尤为显著[1]。VDR是一种配体依赖的核转录因子,主要通过介导基因转录而调控蛋白合成。它在维持机体矿物质动态平衡、钙磷代谢、骨代谢、调节细胞增殖、分化和免疫等方面起重要作用[2]。因单荧光实时定量PCR在检测多个基因时需要多管反应体系,试剂耗费多且耗时长。另外,在定量研究靶基因表达水平时,必须有内参基因,如甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphatedehydrogenase,GAPDH)基因的参与,通过靶基因与内参基因表达量的比来消除标本间RNA提取时的取样误差。如果用单荧光实时定量PCR检测靶基因和内参基因,需要分两管进行,会在模板(cDNA)加样环节产生加样误差。为避免此误差并减少PCR次数,本研究构建了单管检测VDR及GAPDH基因表达的双重实时荧光定量PCR(dual real-time PCR)的方法,现报告如下。
1 材料与方法
1.1材料实时荧光定量PCR扩增仪(Light Cycler 480Ⅱ,Roche公司),核酸蛋白测定仪(Eppendorf公司),台式高速冷冻离心机(5804R,Eppendorf公司),脂肪组织总RNA提取试剂盒(QIAGEN公司),cDNA首链合成试剂盒(Thermo Fisher公司),Immolasetm DNA Polymerase(Bioline公司)。
1.2方法
1.2.1引物及探针的设计与合成在GenBank中查找VDR (NM_001017535)和GAPDH(NM_001289745)的碱基序列,采用Primer Premier 5.0软件设计引物及TaqMan探针,引物和探针序列均委托生工生物工程(上海)有限公司合成,见表1。
1.2.2脂肪组织总RNA制备取剖宫产产妇腹部皮下脂肪组织约黄豆大小(约0.1 g,来源于常州市妇幼保健院),按脂肪组织总RNA提取试剂盒说明书提取分离总RNA,用核酸蛋白测定仪检测吸光度(A260 /280 nm),计算RNA浓度及纯度。
1.2.3逆转录反应及PCR扩增取A260 /280 nm在1.8~2.0之间的标本,参照cDNA首链合成试剂盒说明书将总RNA逆转录为cDNA(-20℃保存)。所有PCR均在Light Cycler 480Ⅱ型荧光定量PCR扩增仪上进行。反应结束后将PCR产物送生工生物工程(上海)有限公司进行克隆测序,测序正确的重组质粒用于制备标准品。
1.2.4VDR/GAPDH混合质粒标准品制备测序结果比对正确的重组质粒经核酸蛋白测定仪检测浓度,选取1×106拷贝/μL数量级的VDR和GAPDH质粒等比例混合作为标准品原液,将标准品原液10倍梯度稀释成1×101~1×106拷贝/μL数量级的标准品,依次作为模板进行PCR扩增。
1.2.5双重实时荧光定量PCR反应体系及条件优化PCR总反应体系为25 μL,其中VDR/GAPDH混合质粒4 μL,10× ImmoBuffer 2.5 μL,50 mmol/L MgCl22 μL,10 mmol/L dNTPs 1 μL,1 mmol/L ASETM热启动酶0.5 μL,100 μmol/L VDR及GAPDH正、反义引物和探针均为0.04 μL,加ddH2O补足至25 μL。反应条件为:95℃预变性10 min;95℃5 s,60℃15 s(温度转换率均为20℃/s),扩增40个循环;40℃1 min。60℃延伸时采集荧光信号。检测通道分别为FAM通道(465~510 nm,VDR)和CY5通道(618~660 nm,GAPDH)。结果判断:在阴性对照成立条件下,Ct值≤35 HU时,PCR扩增有效;Ct值≥40 HU时检测结果为阴性;Ct值在35~40 HU时,建议复检。
1.2.6双重实时荧光定量PCR灵敏度和重复性试验每个样品重复5个批次(批间重复),每个批次重复5个复孔(批内重复),根据临界循环数以及模板起始拷贝数绘制标准曲线,计算标准方程。根据得到的Ct值计算其标准差和变异系数(CV),验证该方法的批内及批间重复性。
2 结果
2.1重组质粒序列分析PCR产物克隆测序比对结果见图1,将VDR和GAPDH重组质粒测序结果分别与其各自基因序列进行比对,结果显示其符合率为100%。
2.2VDR/GAPDH扩增曲线及灵敏度分析VDR基因在FAM通道出现典型的扩增曲线,见图2A。GAPDH基因在CY5通道出现典型的扩增曲线,见图2B。VDR和GAPDH混合质粒标准品经10倍连续稀释(4×101~4×105),按上述条件进行荧光定量RT-PCR,结果表明,该法对检测人VDR和GAPDH基因灵敏度均为4×101拷贝/μL。
2.3标准曲线的建立及线性检测范围人VDR和GAPDH基因双重实时荧光定量PCR标准曲线方程分别为:=-3.419 X+39.40(图3A)、=-3.738 X+ 40.51(图3B),其中Y代表Ct值,X代表模板量的对数值。其线性范围为4×101~4×105拷贝/μL;决定系数R2分别为0.998、0.999;扩增效率E分别为96.10%、85.15%。

Tab. 1 Primer and probe sequences of VDR/GAPDH表1 VDR/GAPDH引物及探针序列
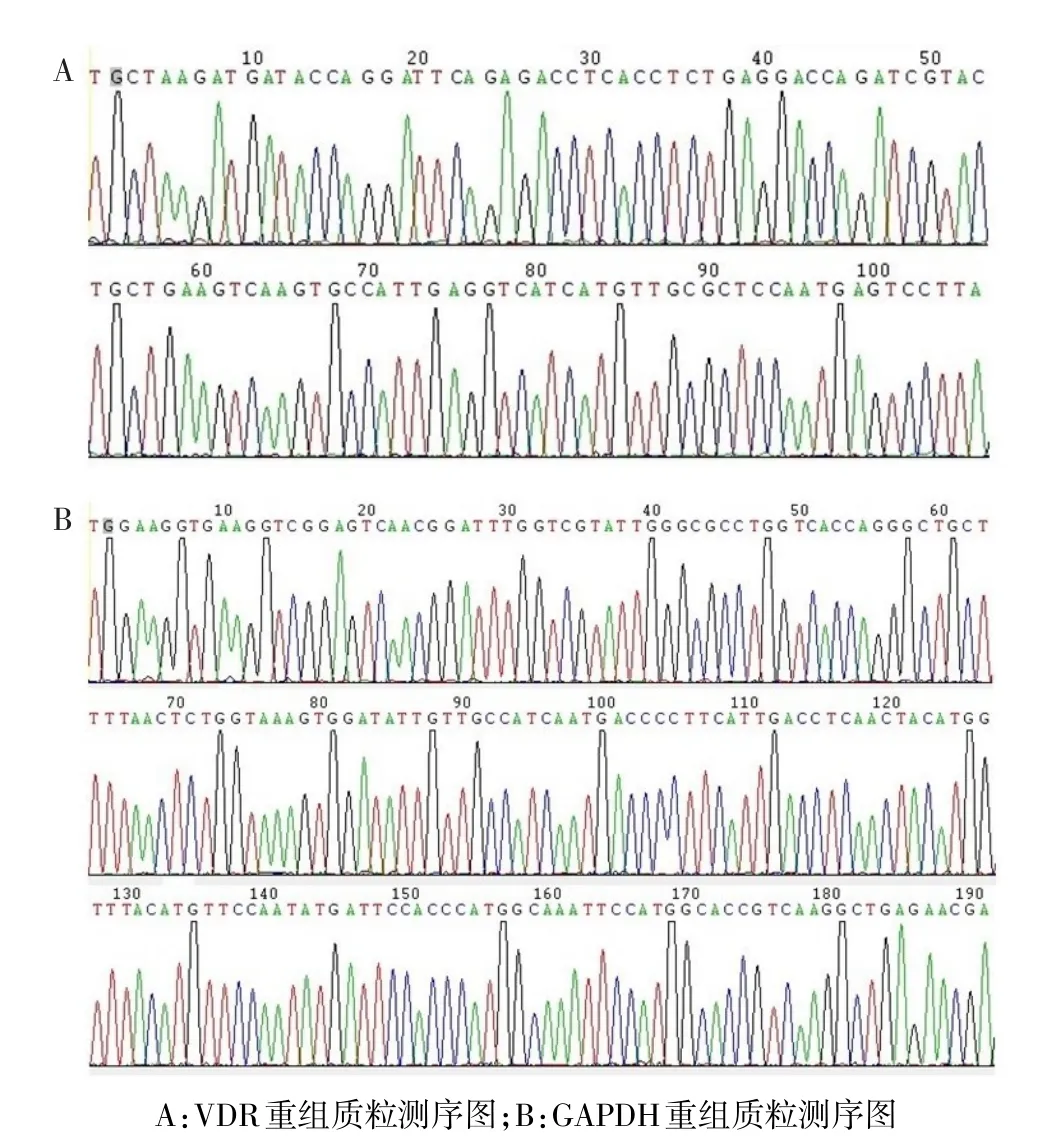
Fig.1 The analysis of recombinant plasmid sequence图1 重组质粒序列分析
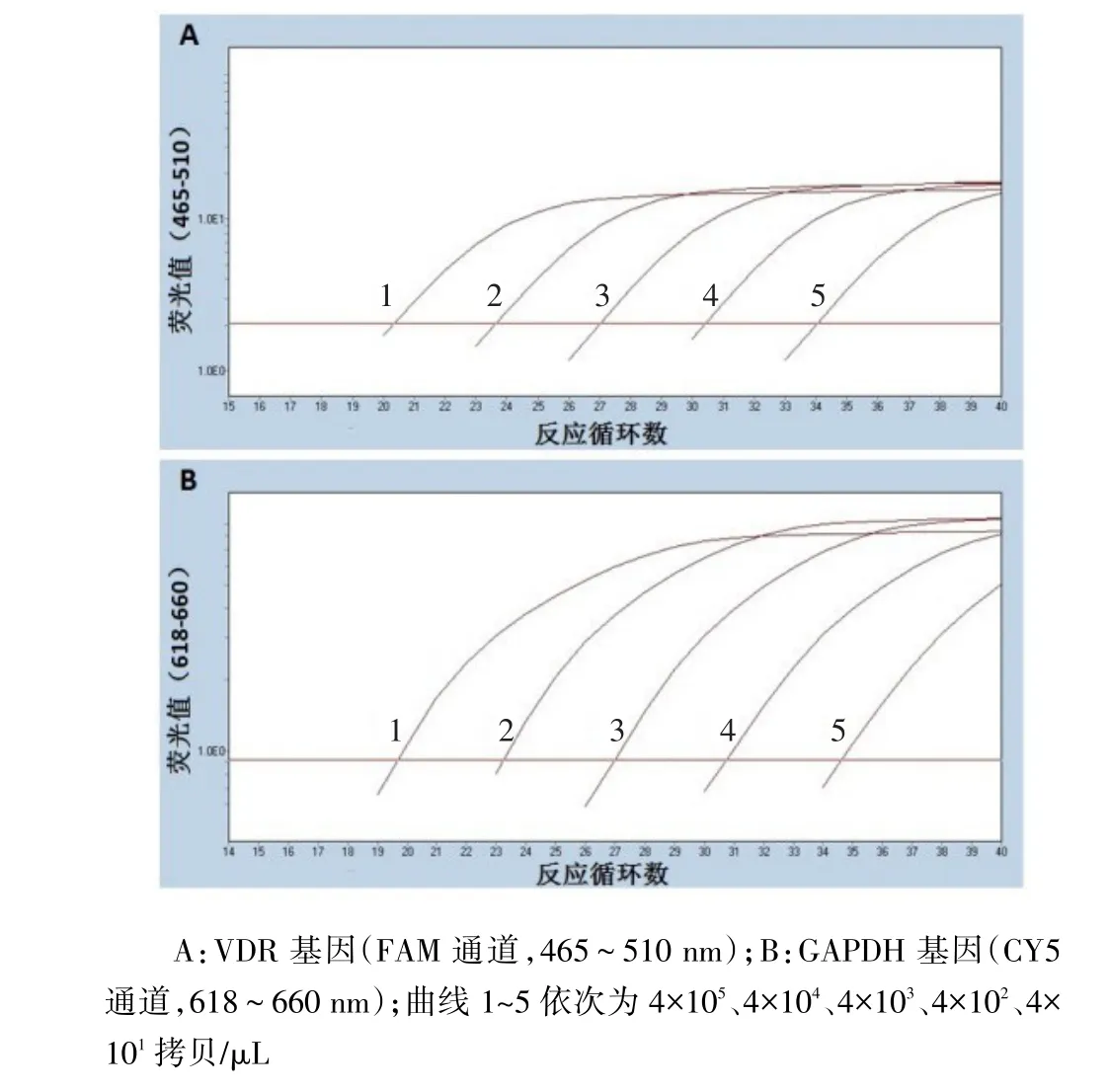
Fig. 2 Amplification curves of human VDR/GAPDH detected by dual real-time fluorescence quantitative PCR assay图2 双重实时荧光定量PCR法检测人VDR/GAPDH扩增曲线
2.4VDR/GAPDH标准品的重复性分析VDR和GAPDH批内变异系数分别为0.09%~1.21%、0.35%~ 0.88%,具有较好的批内重复性,见表2。VDR和GAPDH批间变异系数分别为0.17%~0.51%、0.51%~ 2.46%,具有较好的批间重复性,见表3。
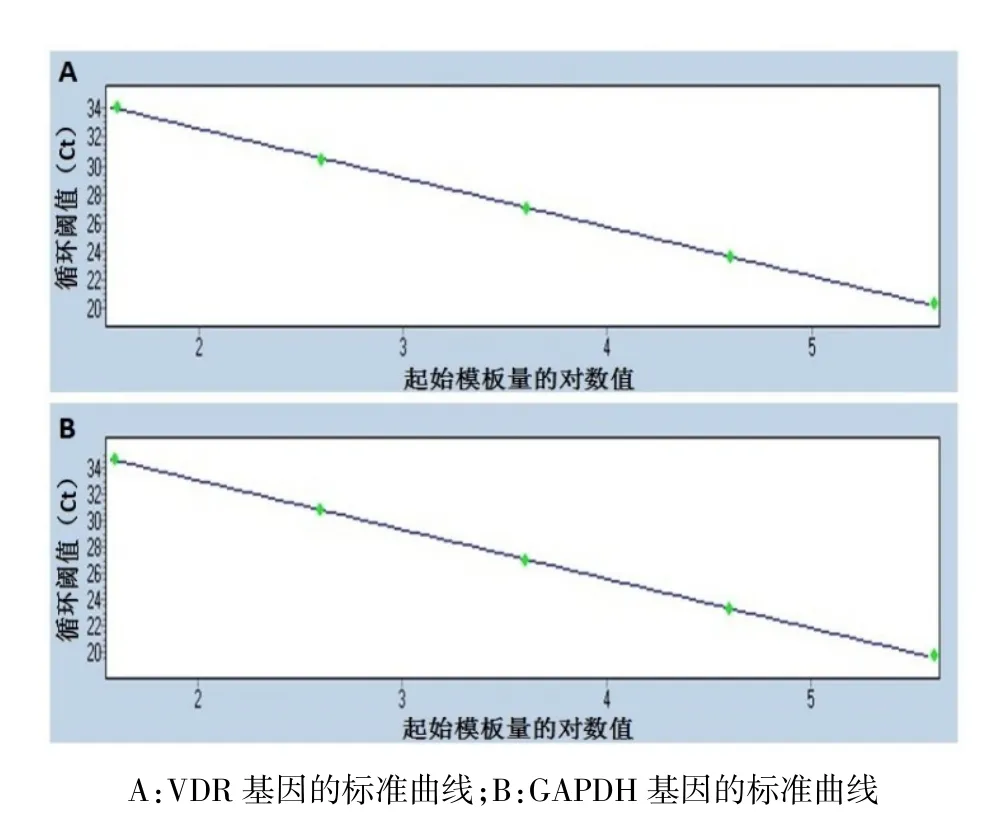
Fig.3 Standard curves of human VDR/GAPDH detected by dual real-time fluorescence quantitative PCR assay图3 双重实时荧光定量PCR法检测人VDR/GAPDH的标准曲线
Tab. 2 Intra-batch repeatability of VDR/GAPDH standards表2 VDR/GAPDH标准品的批内重复性(n=5,±s)
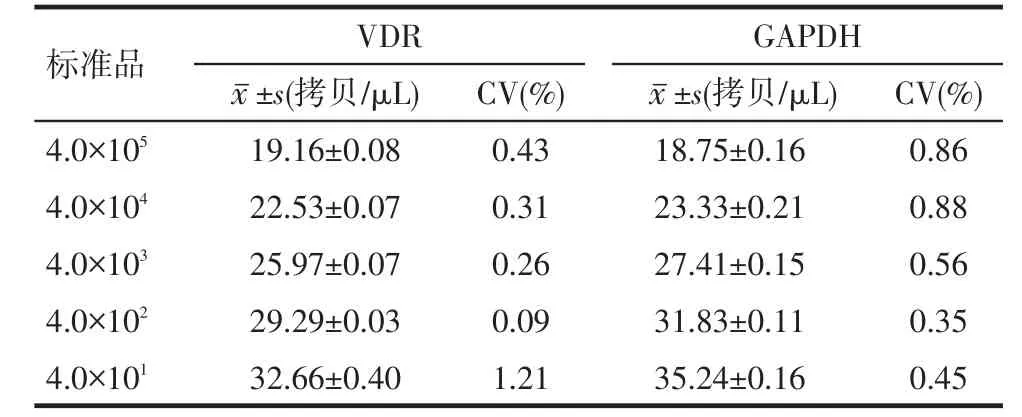
Tab. 2 Intra-batch repeatability of VDR/GAPDH standards表2 VDR/GAPDH标准品的批内重复性(n=5,±s)
标准品4.0×1054.0×1044.0×1034.0×1024.0×101VDR±s(拷贝/μL) 19.16±0.08 22.53±0.07 25.97±0.07 29.29±0.03 32.66±0.40 CV(%) 0.43 0.31 0.26 0.09 1.21 18.75±0.16 23.33±0.21 27.41±0.15 31.83±0.11 35.24±0.16 GAPDH±s(拷贝/μL) CV(%) 0.86 0.88 0.56 0.35 0.45
Tab. 3 Inter-batch repeatability of VDR/GAPDH standards表3 VDR/GAPDH标准品的批间重复性(n=5,±s)
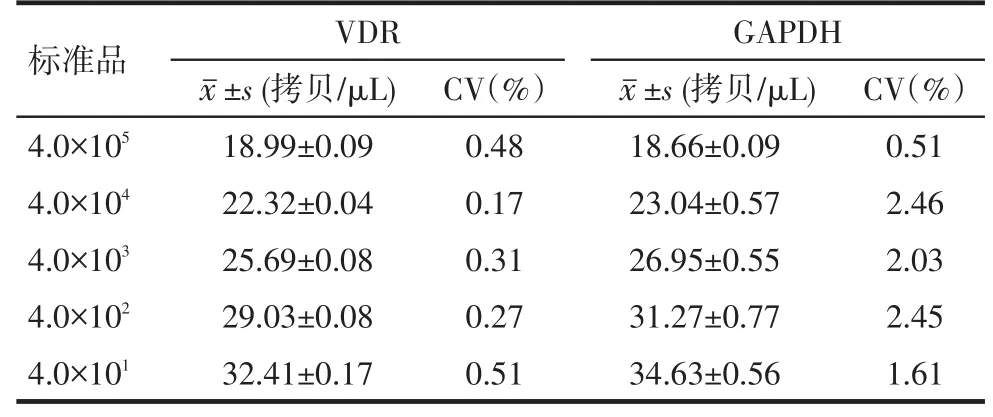
Tab. 3 Inter-batch repeatability of VDR/GAPDH standards表3 VDR/GAPDH标准品的批间重复性(n=5,±s)
标准品4.0×1054.0×1044.0×1034.0×1024.0×101VDR±s (拷贝/μL) 18.99±0.09 22.32±0.04 25.69±0.08 29.03±0.08 32.41±0.17 CV(%)0.48 0.17 0.31 0.27 0.51 18.66±0.09 23.04±0.57 26.95±0.55 31.27±0.77 34.63±0.56 GAPDH±s (拷贝/μL) CV(%)0.51 2.46 2.03 2.45 1.61
3 讨论
VDR具有调节细胞增殖和分化的作用,并参与机体免疫和代谢调节[3]。VDR主要通过介导1,25-(OH)2D3发挥生物效应。有文献报道,1,25-(OH)2D3可诱导外周单核细胞分化成吞噬细胞,诱导单核细胞、巨噬细胞分化成破骨细胞,进而加快骨吸收[4]。VDR在免疫系统方面的调节主要表现为能够加强先天免疫[5]。此外,VDR还可以介导1,25-(OH)2D3抑制肿瘤细胞增殖、促进肿瘤细胞分化[6]。有研究报道,VDR基因敲除小鼠的耗氧量和产生CO2的量都显著高于野生型小鼠[7],此结果提示VDR可能与能量代谢有关。因此,检测VDR mRNA的表达对深入研究其病理和生理功能及作用机制有非常重要的意义。
实时荧光定量PCR把扩增、分子杂交、酶动力学和光化学巧妙地结合在一起,克服了传统PCR的缺点,使PCR处于全封闭条件下进行,并通过计算机实时动态检测PCR产物,与传统终末法PCR相比具有灵敏度高、特异性好和反应速度快等优点[8]。但是,单荧光通道实时定量PCR方法检测多种基因RNA表达水平,需配制多管体系(如靶基因和内参基因),存在耗时长、费用高的缺点。
本研究结果显示,VDR与GAPDH检测灵敏度均较高,最低检测限为101数量级,线性范围广,在1×101~1×105拷贝/μL范围内具有良好线性,扩增效率高,批内及批间重复性较好。
该方法实现了一次加样同时检测靶基因和内参基因的目的,有效避免了两次PCR间起始模板的加样误差,可以更精确地研究靶基因的相对表达水平。同时,该方法还有效克服了单荧光通道PCR的缺点,无需增加特殊试剂和材料,显著简化了实验程序,缩短了检测周期并降低了实验费用,可以比较准确地测定人VDR基因的表达,具有高效、经济、稳定和准确的优势,成为深入探讨VDR病理和生理功能及作用机制有效的方法。
参考文献
[1] Gonzalez-Parra E, Rojas-Rivera J, Tunon J, et al. Vitamin D recep⁃tor activation and cardiovascular disease [J]. Nephrol Dial Trans⁃plant, 2012, 27(Suppl 4):iv17-21. doi: 10.1093/ndt/gfs534.
[2] Gao L, Tao Y, Zhang L, et al. Vitamin D receptor genetic polymor⁃phisms and tuberculosis: updated systematic review and meta-anal⁃ysis [J]. Int J Tuberc Lung Dis, 2010, 14 (1):15-23.
[3] Cui J, Chen H, Huang BR. The recent progress in the studies of vita⁃min D receptor [J]. Progress in Physiological Sciences, 2011, 42 (2): 95-99. [崔健,陈虹,黄秉仁.维生素D受体最新研究进展[J].生理科学进展, 2011, 42 (2):95-99].
[4] Pike JW, Lee SM, Meyer MB. Regulation of gene expression by 1, 25-dihydroxyvitamin D3 in bone cells: exploiting new approaches and defining new mechanisms [J]. Bonekey Rep, 2014, 3:482. doi: 10.1038/bonekey.2013.216. eCollection 2014.
[5] Ooi JH, Chen J, Cantorna MT. Vitamin D regulation of immune func⁃tion in the gut: why do T cells have vitamin D receptors [J]. Mol As⁃pects Med, 2012, 33 (1):77-82. doi: 10.1016/j.mam.2011.10.014.
[6] Gandini S, Gnagnarella P, Serrano D, et al. Vitamin D receptor poly⁃morphisms and cancer [J]. Adv Exp Med Biol, 2014, 810:69-105.
[7] Wong KE, Szeto FL, Zhang W, et al. Involvement of the vitamin D receptor in energy metabolism: regulation of uncoupling proteins[J]. Am J Physiol Endocrinol Metab, 2009, 296 (4):E820- 828. doi: 10.1152/ajpendo.90763.2008.
[8] Aithal MG, Rajeswari N. Validation of housekeeping genes for gene expression analysis in glioblastoma using quantitative real- time polymerase chain reaction[J]. Brain Tumor Res Treat, 2015, 3(1): 24-29. doi: 10.14791/btrt.2015.3.1.24.
(2015-06-15收稿2015-08-27修回)(
本文编辑魏杰)
药物临床观察
作者单位:苏州大学附属第三医院综合实验室,常州市个性化诊疗高技术研究重点实验室(邮编213003)
Establishing a method for detection of human vitamin D receptor using dual real-time fluorescence quantitative PCR
YU Miaomei,YU Yang,ZHANG Jun,YAO Shuang,PAN Lili,LUO Guanghua△
Comprehensive Laboratory,The Third Affiliated Hospital of Soochow University,Changzhou Key Lab of Individualized
Diagnosis and Treatment Associated with High Technology Research,Changzhou 213003,China
△Corresponding Author E-mail: shineroar@163.com
Abstract:Objective To establish a dual real-time fluorescence quantitative polymerase chain reaction (dual realtime PCR) assay to detect human vitamin D receptor (VDR) and glyceraldehyde-3-phosphate dehydrogenase (GAPDH). Methods GAPDH gene was used as the internal control. The specific primers and TaqMan probes were designed by Primer Premier 5.0 software, which were applied to detect the VDR/GAPDH mRNA levels. The obtained PCR products were puri⁃fied to construct the VDR/GAPDH recombinant plasmid, which was taken as the standard to analyze the sensitivity and re⁃peatability of the method. Results The amplification products were confirmed as the specific fragment of VDR/GAPDH by DNA sequencing instrument. The results showed that the sensitivity, linear range, the determinate coefficient, the amplifica⁃tion efficiency, the intra-assay and inter-assay coefficient of variation were 40 copies/μL, 4.00×101-4.00×105copies/μL, 0.998, 96.10%, 0.09%-1.21%, 0.17%-0.51% for VDR, and 40 copies/μL, 4.00×101-4.00×105copies/μL, 0.999, 85.15%, 0.35%-0.88%, 0.51%-2.46% for GAPDH, respectively. ConclusionThese results demonstrate that the dual real-time PCR assay with high sensitivity and specificity can detect the relative expressions of human VDR by single reaction tube, which can effectively shorten the time and reduce the experimental error.
Key words:receptors, calcitriol; polymerase chain reaction; glyceraldehyde-3-phosphate dehydrogenases; vitamin D receptor; dual real-time fluorescence quantitative PCR
中图分类号:R331
文献标志码:A
DOI:10.11958/59072
作者简介:喻妙梅(1987),女,硕士,主要从事临床分子诊断方面研究
