路易斯安那鸢尾LiNramp2基因克隆与定量表达分析
2016-05-30田松青朱旭东赵沿海顾春笋黄苏珍
田松青 朱旭东 赵沿海 顾春笋 黄苏珍

摘 要 利用RACE技术克隆了路易斯安那鸢尾LiNramp2基因全长cDNA序列,其大小为1 786 bp,预测编码519个氨基酸,蛋白质具有11次跨膜结构域,与其他Nramp蛋白同源性达80%以上,说明LiNramp2同其他同源基因保守性很高。定量表达结果显示,LiNramp2在路易斯安那鸢尾叶片和雄蕊中表达量较高,在雌蕊中表达量最低,根和茎表达量差别不大。随着铅处理时间增加,LiNramp2基因在根系表现缓慢下降,在叶片中表现先升高后下降的趋势,但差异不显著。
关键词 路易斯安那鸢尾;Pb胁迫;LiNramp2;生物信息学分析;实时荧光定量PCR
中图分类号 S682.31 文献标识码 A
Abstract Louisiana iris is a kind of high ornamental value of perennial plants, found to be tolerance and accumulation of heavy metal Pb. However, research on the molecular tolerance mechanism of Pb was limited. Nramp membrane proteins transport many kinds of metal ions. The intermediate fragment of LiNramp2 was obtained by analyzing the Louisiana iris transcriptome. The LiNramp2 gene was cloned by using RACE technology and its length was 1 786 bp, encoding 519 aa. The protein LiNramp2 was with 11 transmembrane domains, and the conservative analysis found that there were more than 80% similar sites with others of the same source Nramps, showing LiNramp2 was highly conservative with other homologous genes. LiNramp2 expressed more in leaf and rhizome and the lowest in pistil, and the expressions in root and rhizome were not significantly different. The gene expression of LiNramp2 in the root decreased slowly as Pb treatment time increased, in the leaf, increased first and then decreased without significance. This study will be beneficial to further studies of the relationship between LiNramp2 and Pb tolerance of Louisiana iris.
Key words Louisiana iris; Pb stress; LiNramp2; Bioinformatics analysis; RT-PCR
doi 10.3969/j.issn.1000-2561.2016.01.024
Nramp蛋白家族(Natural resistance associated macrophage proteins)是广泛存在细菌、真菌和动植物中的一个高度保守的膜蛋白家族,参与如Mn2+、Zn2+、Cu2+、Fe2+、Cd2+、Ni2+和Co2+等多种金属离子运输[1]。Nramp蛋白最初在哺乳动物中发现,造成巨噬细胞的特异蛋白变异,增加了对细胞内细菌病原菌的敏感性,而命名为天然抵抗力相关的巨噬细胞蛋白[2-3]。在酵母中发现的3个Nramp蛋白SMF1~3,具有调节Mn、Cu、Co、Cd、Fe吸收的功能[4-6]。植物中首先发现水稻(Oryza sativa)的3个OsNramps1~3蛋白[3,7],在拟南芥中纯化得到了6种Nramp1~6蛋白[8-9]。植物Nramp蛋白可分成2个亚族:AtNramp1和AtNramp6为一个亚族,AtNramp2~5为另一个亚族[10-11],水稻的OsNramp1和OsNramp3为第一亚族,OsNramp2为第二亚族。植物Nramp蛋白推测有11或12个跨膜结构域(TMs),并在TM-8和TM-9之间存在一个特有的“共有运输基序”,也是高度进化保守的[9,12],在根和地上部分都表达,在质膜或液泡膜上转运金属离子[13]。大多数Nramp 转运蛋白有运输必需元素的能力,如铁(Fe)、锰(Mn),也能运输如镉(Cd)的有毒重金属。在植物中,这个特性最初报道的是AtNrampP3/4转运蛋白[14]。AtNramp3/4具有从液泡存储中再利用Fe和Mn的生理作用,AtNramp3在拟南芥维管束中表达,可能与金属长距离运输有关,其功能的缺失也导致Cd超敏反应[15-18]。AtNramp1是一种高亲和性锰的吸收转运蛋白。AtNramp6基因存在于一个不同于液泡和线粒体的泡状内膜而对镉敏感,AtNramp6的无效等位基因更耐镉[19]。Wei等[20]的试验结果表明,超富集植物遏蓝菜(Thlaspi caerulescens)同类基因TcNramp3/4 可将Cd转运至酵母细胞内,对Ni则相反,TcNrmap3能将Ni外排至酵母细胞外而提高转化子耐性;转基因烟草亚细胞定位分析发现TcNRrmap3/4基因均定位在质膜上。TcNrmap3能转运Fe、Mn、Cd,不能转运Zn,TcNrmap4则能运输4种金属,2个基因均定位在液泡膜上,而蛋白功能上与AtNrmap3/4没有区别[21]。大麦(Hordeum vulgare)在充足氮供应且Cd存在时Nramp转录下调,但当缺少氮时强烈上调[22]。Ni超富集植物Thlaspi japonicum的TjNramp3基因专一转运Ni,但是不转运Zn、Cd和Mn[23]。最近,有研究结果表明,OsNamp1参与对Cd的吸收和在叶中的积累[24-25],OsNamp5轉运蛋白是水稻吸收Mn的基础,也是Cd吸收的主要途径[26-28]。总之,不同的Nramp家族起的作用不同,目前关于Nramp基因家族在高等植物中的功能和其与金属离子吸收的关系尚不明确,还有待于进一步的研究。
路易斯安那鸢尾(Louisiana iris)为鸢尾科鸢尾属(Iris L.)路易斯安那鸢尾系(Iris ser. Hexagonae)的一类观赏湿生植物,原产于美国墨西哥湾沿岸沼泽。朱旭东等[29]研究结果表明,低浓度Pb胁迫下路易斯安那鸢尾可通过自身的抗氧化系统缓解Pb胁迫对机体的毒害作用,从而保证植株的生长和发育,具有一定的吸收和忍耐重金属Pb的能力。该基因在重金属铅毒性等中的研究较少,路易斯安那鸢尾Nramp基因目前尚未见报道。本研究利用转录组序列分析与RACE克隆基因的方法,以路易斯安那鸢尾品种‘Professor Neil的cDNA为模板,克隆Nramp基因家族中的1个同源基因,命名为LiNramp2。同时通过实时荧光定量PCR的方法测定和分析路易斯安那鸢尾不同组织和不同时间铅处理时的LiNramp2基因表达量,从而对路易斯安那鸢尾富集铅的生长、结构[29]和生理生化[30]特性进一步验证,为进一步分析LiNramp2基因的分子机理奠定基础。
1 材料与方法
1.1 材料
基因克隆、组织器官特异性和响应Pb胁迫的表达特性定量分析所用试验材料均为路易斯安那鸢尾(Louisiana iris)主栽品种‘Professor Neil。基因克隆和响应Pb胁迫的表达特性定量分析试验选取在秋季分蘖旺盛时期生长健壮、长势良好的分株苗。组织特异性定量分析试验选用春季盛花期花朵正开的包括花、叶、根状茎和根的完整植株。
1.2 方法
1.2.1 路易斯安那鸢尾LiNramp2基因克隆 (1)提取总 RNA 和合成cDNA。试验于2013年9月在南京中山植物园温室进行。将路易斯安那鸢尾分株苗用1/2 Hoagland 营养液水培预培养30 d后,采集新鲜叶片和根系。利用TaKaRa公司的RNAiso Plus试剂提取新鲜叶片和根系总RNA。通过紫外分光光度计测定OD260/OD280,鉴定总RNA质量。总RNA的第一链cDNA采用Reverse Transcriptase M-MLV(RNase H-)试剂盒(TaKaRa,日本,具体见说明书)合成。
(2)LiNramp2基因中间片段克隆。从路易斯安那鸢尾转录组数据中筛选出LiNramp2基因相关序列片段信息(comp160718_c0_seq1)。利用Primer 5和Oligo 7软件根据转录组中的信息设计中间片段引物(表1),利用已合成的cDNA经PCR反应扩增LiNramp2基因中间片段,PCR扩增程序为:94 ℃ 5 min;94 ℃ 40 s,50 ℃ 40 s,72 ℃ 50 s,32个循环;72 ℃ 10 min。将PCR扩增得到LiNramp2基因的中间片段进行电泳切胶回收,然后连接到T载体上,转化后筛选阳性克隆进行测序。
(3)LiNramp2基因3′端序列克隆。利用 Primer 5和Oligo 7软件,根据测序获得的LiNramp2基因中间片段设计3′端特异PCR引物(表1)。采用Clontech公司的SMARTerTM RACE cDNA Amplification Kit试剂盒获得LiNramp2基因的3′端序列。
(4)LiNramp2基因5′端序列克隆。利用 Primer 5和Oligo 7软件,根据测序获得的中间序列设计 5′端正向PCR引物和反向特异PCR引物(表1)。采用Invitrogen公司的5′RACE System for Rapid Amplification of cDNA Ends, Version 2.0试剂盒获得LiNramp2基因的5′端序列。
(5)序列拼接。采用DNAMAN软件对克隆得到的5′端序列、3′端序列和中间序列进行首尾拼接,得到LiNramp2基因的全序列。
1.2.2 路易斯安那鸢尾LiNramp家族基因编码蛋白和生物信息学分析 使用Oligo 7软件分析LiNramp2基因编码的氨基酸序列。从NCBI数据库中筛选LiNramp2的同源氨基酸序列,通过 AlignX软件分析LiNramp2基因编码的氨基酸序列的保守性,并基于此基因编码的氨基酸序列,利用MEGA 6软件中的泊松分布模式构建同源氨基酸序列的系统树,分析同源氨基酸序列的进化关系。采用SOPMA软件在线分析LiNramp2基因编码的蛋白质的二级结构,并通过TMHMM 2.0软件在线分析该蛋白质的跨膜结构域。LiNramp2蛋白保守结构域的查找通过http:∥www.ncbi.nlm.nih.gov/Blast完成。蛋白质三维结构预测在http://swissmodel.expasy.org上进行,并通过http://www.ebi.ac.uk/InterProScan寻找该类蛋白在不同物种中的分布。
1.2.3 路易斯安那鸢尾LiNramp2基因在不同组织以及响应Pb胁迫的表达特性分析 (1)样品制备。开花季节对路易斯安那鸢尾成年植株的根、茎、叶和花等组织各取样3份,用于LiNramp2基因组织特异性表达分析试验。对分株苗进行0、1、3、6、12、24 h不同时间长度的铅(200 mg/L)胁迫,采集胁迫的根和叶组织各3份,用于LiNramp2基因响应Pb胁迫的表达特性分析试验。采集的样品用无菌水清洗后用锡箔纸包好,立即放入超低温冰箱保存备用。使用TaKaRa试剂盒提取样品总RNA,并将RNA反转录成cDNA,用于实时荧光定量PCR分析。(2)实时荧光定量PCR。根据已克隆的基因序列用Premier 5.0软件设计特异性检测引物(表2)。实时荧光定量PCR采用SYBR GREEN染料法,以UBC为内参基因,做相对定量检测。将上述提取备用样品的cDNA置于定量PCR仪LightCycler3(Roche 公司)中,设定荧光采集通道以及读取荧光步骤。其PCR反应程序为:94 ℃ 30 s;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,45个循环;72 ℃单点检测信号。结束后最后加入溶解曲线程序:95 ℃ 0 s,60 ℃ 15 s,95 ℃ 0 s,連续检测信号。根据数据分析得到各个样品的CT值,假定扩增效率为100%,并假定标准曲线及每次扩增之间的效率保持一致,相对转录水平采用2-△△CT的方法进行计算。
1.3 数据分析
采用Excel和SPSS软件对试验数据进行统计和方差分析。所有数据均为3次重复的平均值。数据用邓肯多重比较进行显著差异性测定。
2 结果与分析
2.1 LiNramp2基因全长及生物学信息分析
2.1.1 基因全长及编码蛋白质 由设计的引物通过PCR扩增到LiNramp2基因的中间片段,长度为1 064 bp(图1-A)。根据获得的中间片段序列,设计特异引物,进行3′RACE扩增得到长度为352 bp的序列(图1-B);5′RACE扩增得到长度为676 bp的序列(图1-C)。将扩增到的LiNramp2中间片段、3′端序列和5′端序列用DNAMAN软件进行拼接,得到LiNramp2基因的完整序列(图2),总长度为1 786 bp,开放阅读框(ORF)为1 557 bp,5′非编码区30 bp,3′非编码区199 bp,预测编码蛋白质含519个氨基酸。
2.1.2 LiNramp2蛋白质二级结构及跨膜结构 通过SOPMA软件在线分析,LiNramp2基因推导的蛋白质LiNramp2中α螺旋(α-Helix)占46.63%,延伸链(Extend strand)占23.51%,不规则螺旋(Random coil)占21.39%(图3),α-螺旋是LiNramp2最主要的二级结构。TMHMM软件在线分析LiNramp2蛋白质具有11次跨膜结构,这与跨膜蛋白特征相符合(图4)。
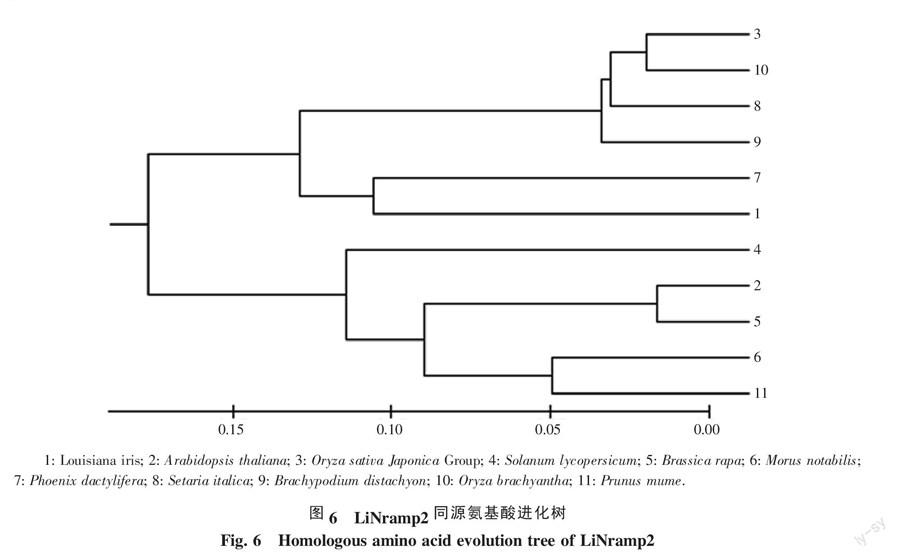
2.1.3 LiNramp2蛋白质保守性及进化树分析 通过NCBI数据库中直接搜索LiNramp2氨基酸序列与利用LiNramp2氨基酸序列blastp的方法,从数据库中筛选出10种同源氨基酸序列:拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa Japonica Group)、Solanum lycopersicum、芸苔(Brassica rapa)、桑树(Morus notabilis)、海枣(Phoenix dactylifera)、狗尾草(Setaria italica)、短柄草(Brachypodium distachyon)、短药野生稻(Oryza brachyantha)和梅(Prunus mume)。利用Clustalw软件分析LiNramp2和这10种同源氨基酸序列,其相似位点占85.8%(图5中彩色部分),相同位点占48.0%(图5中黄色部分),说明LiNramp2同源氨基酸间有较高的保守性。
利用MEGA6分析这11种同源氨基酸序列进化关系(图6),反应了同科间的LiNramp2关系较近,如禾本科(水稻、狗尾草、短柄草、短药野生稻)与十字花科(拟南芥和芸苔)植物。路易斯安那鸢尾LiNramp2与海枣关系最近,再与单子叶植物纲禾本科关系较近,与其他植物关系较远。
2.2 路易斯安那鸢尾LiNramp2在不同组织的表达特性分析
如图7所示,路易斯安那鸢尾基因LiNramp2在不同组织表达量大小顺序为:雄蕊>叶>外花瓣>内花瓣>根>根状茎>雌蕊,其中雄蕊最高,雌蕊最低。总体上LiNramp2在路易斯安那叶片和雄蕊中表达较高,一直在雌蕊中表达最低,根和根状茎中表达量差别不大,根中稍高于根状茎中。
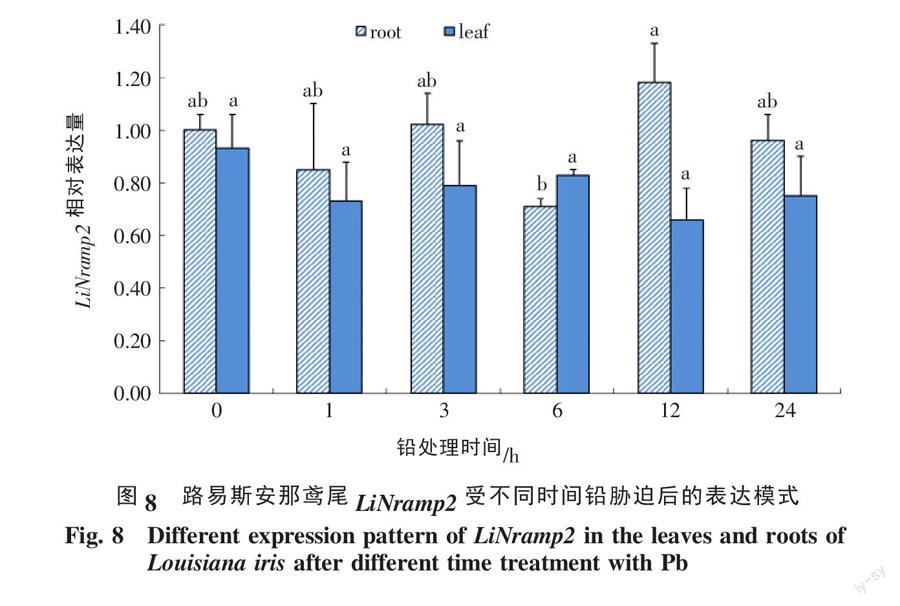
2.3 路易斯安那鸢尾LiNramp2响应Pb胁迫的表达特性分析
不同LiNramp2基因在路易斯安那鸢尾根系和叶片两组织中的转录水平不一样,在根系中表达普遍比在叶片中表达高(图8)。随着铅处理时间增加,LiNramp2基因在根系表现缓慢下降,在叶片中表现出先升高后下降的趋势,总体上没有显著差异(p>0.5)。
3 讨论与结论
植物基本矿质营养吸收与有毒重金属的积累密切相关。通常,有毒重金属进入并分布到植物体内,是通过从环境吸收矿质必需元素的途径来实现的[28]。重金属的毒性原因往往也是矿质必需元素和有毒金属之间竞争产生的。转运蛋白不仅在植物体内矿质必需元素运输过程中发挥重要作用,而且可转运重金属,同时也参与金属稳态的调控。虽然最近已鉴定出很多重金属转运蛋白家族,但只是集中在少数的植物和几种重金属中,且不同蛋白转运金属离子的类型以及在细胞、组织中的定位都不是很清楚。为了进一步解读植物重金属积累能力和对有毒重金属抗性发生机理及机制,本文成功克隆了重金属转运蛋白家族LiNramp2基因,并对其表达部位和对铅胁迫所表达特性进行了探讨。
对于水稻和拟南芥等已完成DNA基因组测序的模式植物或重要作物等来说,可以直接设计特异性引物来克隆所需要的基因。而对于缺乏DNA基因组测序的路易斯安那鸢尾来说,对照转录组所得到的序列,采用RACE方法可以对所需要的基因进行同源克隆。根据这一方法本文从路易斯安那鸢尾品种‘Professor Neil中克隆了LiNrmap基因家族中的这一同源基因。克隆的LiNramp2基因全長为1 786 bp,预测编码蛋白质含519个氨基酸。质膜或液泡膜上转运蛋白Nramp参与重金属胁迫的防御机制[28],这些蛋白的N端通常包含多个跨膜结构域。本研究采用TMHMM软件工具对克隆的基因进行跨膜结构域分析显示,LiNramp2蛋白的N-末端具有11个跨膜结构域,与其他物种Nramp蛋白相一致[9,12]。
路易斯安那鸢尾响应铅胁迫的表达特性分析表明,LiNramp2对铅胁迫不敏感,在铅处理后的24 h时,转录水平有较少提高,而且在叶中表达比根中高。这与OsNamp1参与对Cd的吸收和在叶中的积累相一致[24-25],可能与叶中积累铅有关。对比两者试验结果,初步预测该基因确实编码跨膜运输蛋白,可能在根向茎运输重金属铅中发挥着重要的作用。
当然植物如何适应重金属的胁迫是一个非常复杂的过程,Nramp转运蛋白家族在铅吸收、去毒化和转运等方面研究几乎是空白,本次研究只能初步探讨,下一步将进一步研究在更长的胁迫时间、野外条件、亚细胞定位和转基因功能验证等方面,同时也可根据本次试验经验克隆同家族基因,为进一步研究本家族基因与植物铅吸收、去毒化和转运的关系提供参考。
參考文献
[1] Nevo Y, Nelson N. The NRAMP family of metal-ion transporters[J]. BBA-Mol Cell Res, 2006, 1 763(7): 609-620.
[2] Vidal S M, Malo D, Vogan K, et al. Natural resistance to infection with intracellular parasites-isolation of a candidate for Bcg[J]. Cell, 1993, 73(3): 469-485.
[3] Belouchi A, Cellier M, Kwan T, et al. The macrophage-specific membrane protein Nramp controlling natural resistance to infections in mice has homologues expressed in the root system of plants[J]. Plant Mol Biol, 1995, 29(6): 1 181-1 196.
[4] Supek F, Supekova L, Nelson H, et al. A yeast manganese transporter related to the macrophage protein involved in conferring resistance to mycobacteria[J]. P Natl Acad Sci USA, 1996, 93(10): 5 105-5 110.
[5] Liu X F, Supek F, Nelson N, et al. Negative control of heavy metal uptake by the Saccharomyces cerevisiae BSD2 gene[J]. J Biol Chem, 1997, 272(18): 11 763-11 769.
[6] Chen X Z, Peng J B, Cohen A, et al. Yeast SMF1 mediates H+-coupled iron uptake with concomitant uncoupled cation currents[J]. J Biol Chem, 1999, 274(49): 35 089-35 094.
[7] Belouchi A, Kwan T, Gros P. Cloning and characterization of the OsNramp family from Oryza sativa, a new family of membrane proteins possibly implicated in transport metal ions[J]. Plant Mol Biol, 1997, 33(6): 1 085-1 092.
[8] Maser P, Thomine S, Schroeder J I, et al. Phylogenetic relationships within cation transporter families of Arabidopsis[J]. Plant Physiol, 2001, 126(4): 1 646-1 667.
[9] Williams L E, Pittman J K, Hall J L. Emerging mechanisms for heavy metal transport in plants[J]. BBA-Biomembranes, 2000, 1 465(1-2): 104-126.
[10] Guerinot M L. The ZIP family of metal transporters[J]. BBA-Biomembranes, 2000(1/2), 1 465: 190-198.
[11] Connolly E L, Fett J P, Guerinot M L. Expression of the IRT1 metal transporter is controlled by metals at the levels of transcript and protein accumulation[J]. Plant Cell, 2002, 14(6): 1 347-1 357.
[12] Curie C, Alonso J M, Le J M, et al. Involvement of NRAMP1 from Arabidopsis thaliana in iron transport[J]. Biochem J, 2000, 347(3): 749-755.
[13] Kramer U, Talke I N, Hanikenne M. Transition metal transport[J]. FEBS Lett, 2007, 581(12): 2 263-2 272.
[14] Thomine S, Wang R C, Ward J M, et al. Cadmium and iron transport by members of a plant transporter gene family in Arabidopsis with homology to Nramp genes[J]. P Natl Acad Sci USA, 2000, 97(9): 4 991-4 996.
[15] Thomine S, Lelievre F, Debarbieux E, et al. AtNRAMP3, a multispecific vacuolar metal transporter involved in plant responses to iron deficiency[J]. Plant J, 2003, 34(5): 685-695.
[16] Lanquar V, Lelievre F, Bolte S, et al. Mobilization of vacuolar iron by AtNRAMP3 and AtNRAMP4 is essential for seed germination on low iron[J]. Embo J, 2005, 24(23): 4 041-4 051.
[17] Lanquar V, Ramos M S, Lelievre F, et al. Export of vacuolar manganese by AtNRAMP3 and AtNRAMP4 is required for optimal photosynthesis and growth under manganese deficiency[J]. Plant Physiol, 2010, 152(4): 1 986-1 999.
[18] Molins H, Michelet L, Lanquar V, et al. Mutants impaired in vacuolar metal mobilization identify chloroplasts as a target for cadmium hypersensitivity in Arabidopsis thaliana[J]. Plant Cell Environ, 2013, 36(4): 804-817.
[19] Cailliatte R, Lapeyre B, Briat J F, et al. The NRAMP6 metal transporter contributes to cadmium toxicity[J]. Biochem J, 2009, 422: 217-228.
[20] Wei W, Chai T Y, Zhang Yu X, et al. The Thlaspi caerulescens Nramp homologue TcNramp3 is capable of divalent cation transport[J]. Mol Biotechnol, 2009, 41(1): 15-21.
[21] Oomen R J, Wu J, Lelievre F, et al. Functional characterization of NRAMP3 and NRAMP4 from the metal hyperaccumulator Thlaspi caerulescens[J]. New Phytol, 2009, 181(3): 637-650.
[22] Finkemeier I, Kluge C, Metwally A, et al. Alterations in Cd-induced gene expression under nitrogen deficiency in Hordeum vulgare[J]. Plant Cell Environ, 2003, 26(6): 821-833.
[23] Mizuno T, Usui K, Horie K, et al. Cloning of three ZIP/Nramp transporter genes from a Ni hyperaccumulator plant Thlaspi japonicum and their Ni2+-transport abilities[J]. Plant Physiol Bioch, 2005, 43(8): 793-801.
[24] Uraguchi S, Fujiwara T. Cadmium transport and tolerance in rice: perspectives for reducing grain cadmium accumulation[J]. Rice, 2012, 5(5): 1-8.
[25] Takahashi R, Ishimaru Y, Senoura T, et al. The OsNRAMP1 iron transporter is involved in Cd accumulation in rice[J]. J Exp Bot, 2011, 62(14): 4 843-4 850.
[26] Sasaki A, Yamaji N, Yokosho K, et al. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J]. Plant Cell, 2012, 24(5): 2 155-2 167.
[27] Ishimaru Y, Takahashi R, Bashir K, et al. Characterizing the role of rice NRAMP5 in manganese, iron and cadmium transport[J]. Sci Rep, 2012, 2: 286.
[28] Clemens S, Aarts M G, Thomine S, et al. Plant science: the key to preventing slow cadmium poisoning[J]. Trends Plant Sci, 2013, 18(2): 92-99.
[29] Zhu X D, Tian S Q, Huang S Z, et al. Effects of Pb on the growth and subcellular structure of Louisiana iris, and its localization in the plant[J]. Fresen Environ Bull, 2014, 23(10): 2 395-2 400.
[30] 朱旭東, 原海燕, 黄苏珍, 等. 铅(Pb)胁迫对路易斯安那鸢尾生长和生理生化特性的影响[J].植物资源与环境学报, 2014, 23(4): 62-67.
责任编辑:赵军明
