木薯MeNRT2.1基因的克隆及表达分析
2016-05-30胡春吉邹良平彭明
胡春吉 邹良平 彭明

摘 要 木薯具有产量高、抗贫瘠等特点,为了了解其耐贫瘠的作用机理,提高木薯在贫瘠土壤中对氮素的利用率,以培养20 d的“华南5号”木薯组培苗为实验材料,采用同源克隆和RT-PCR技术,获得一个高亲和硝态氮转运蛋白(NRT2)基因,命名为MeNRT2.1,该基因含有1 593 bp的开放阅读框架,编码530个氨基酸。生物信息学分析结果表明,木薯MeNRT2.1与苜蓿、拟南芥、可可、杨树等物种的NRT2.1同源性高,其中与可可树TcNRT2.1的亲缘关系最近,氨基酸相似性达到90%。实时荧光定量PCR检测结果表明,MeNRT2.1在木薯组培苗的根中表达,并且在NO3-浓度为0.2 mmol/L时,其相对表达量较高,NO3-浓度为10 mmol/L时其相对表达量较低,NO3-浓度为0时几乎不表达;MeNRT2.1在茎、叶中也几乎不表达,即该基因具有诱导型组织特异性表达模式。原生质体瞬时表达发现MeNRT2.1定位在细胞膜上。此研究为进一步通过NRT2基因提高木薯的抗逆性奠定了基础。
关键词 木薯;硝态氮;NRT2;实时荧光定量PCR;亚细胞定位
中图分类号 S533 文献标识码 A
Abstract Cassava(Manihot esculenta Crantz)has several agronomic traits like a high yield combined with low-nutrient soils tolerance. To insight into the molecular basis for tolerance of poor soils and improve the utilization rate of nitrate in cassava,the“Huanan 5”cassava cultivar grown for 20 days in a medium containing different nitrate concentrations was used as the experimental material in this study. The full-length cDNA encoding a high-affinity nitrate transporter gene, designated MeNRT2.1,was isolated from cassava by using homologous cloning and RT-PCR techniques,MeNRT2.1 was 1 899 bp in length and contained an open reading frame of 1 593 bp. Sequence analysis revealed that the ORF of MeNRT2.1 encoded 530 amino acid residues. Phylogeneticanalyses showed that MeNRT2.1 was highly homologous to MtNRT2,AtNRT2,TcNRT2 and PtNRT2. The closest homolog of MeNRT2.1 is Theobroma cacao NRT2.1,with 90% amino acid identity. Quantitative real-time PCR analysis showed that the MeNRT2.1 transcript of root under 0.2 mmol/L NO3-1 treatment was the highest among the three nitrate concentrations,and had a low level on 10 mmol/L in root. However,there was almost no level without nitrate in root. Little MeNRT2.1 mRNA was found in other examinated tissues. Therefore,the expression of MeNRT2.1 is induced and specific pattern. Subcellular localization of the fusion protein of MeNRT2.1 with GFP only appeared in the cytomembrane. It provides an important foundation for future studies of regulation under the condition of poor stress about this gene.
Key words Cassava;Nitrate nitrogen;NRT2;Quantitative real-time PCR;Subcellular localization
doi 10.3969/j.issn.1000-2561.2016.01.020
木薯(Manihot esculenta Crantz)屬于大戟科木薯属植物,起源于热带美洲,既是世界三大薯之一[1],也是全球六大粮食作物之一。木薯具有高光效、高淀粉产量、抗旱、耐贫瘠等特点,即使在非常贫瘠的土地上也能获得一定的产量[2]。而氮素是植物生长发育过程中必需的大量元素之一,同时也是组成植物体内蛋白质、核酸、磷脂、酶类和维生素、生物碱、叶绿素以及其他数千种物质的重要成分之一[3]。植物体内的氮素水平直接或间接影响植物的生理生化过程及生长发育[4],而氮素对木薯产量的贡献率可达50%以上[5]。
NO3-和NH4+是植物根系从土壤中获得氮素的最主要的2种形式。根系中NO3-的吸收与转运是由硝酸盐转运体(Nitrate transporters, NRTs)实现的[6],当外界可利用的NO3-浓度低时(<1 mmol/L),其吸收主要依靠高亲和转运体系(the high-affinity transport system HATS)完成;当外界可利用NO3-浓度高时(>1 mmol/L),其吸收主要依靠低亲和转运体系(the low-affinity transport system LATS)完成[7-8]。
到目前为止,前人已经从拟南芥中鉴定出53个低亲和(NRT1)与7个高亲和(NRT2)NO3-转运蛋白基因[9]。NO3-在100~50 mmol/L时,基因表达量与NO3-吸收量的相关系数说明高亲和与低亲和的转运系统中主要是AtNRT2.1和AtNRT1.1在起作用[10]。AtNRT2.1在根中强烈表达,Wirth等[11]通过绿色荧光蛋白融合和免疫学方法研究发现,AtNRT2.1主要定位于拟南芥根皮层和表皮的质膜上。Hu等[12]研究表明水稻Nrt1.1B定位于细胞膜,对NO3-从根到叶的运输有重要作用,提高了粳稻对硝酸盐的利用率。徐海荣等[13]发现在不同氮源及不同氮浓度条件下,OsNrt2.1在水稻根中的表达均高于叶,表明OsTNrt2.1对根系吸收NO3-可能具有重要作用。Quesada等[14]通过Northern杂交发现,NpNRT2.1在烟草根中强烈表达。Amarasinghe等[15]发现,通过低浓度硝酸盐诱导,GmNRT2基因在大豆根中表达强烈,属于HATS。孔敏等[16]研究表明,白菜BcNRT2在白菜根部的表达量最高,而且在高低2种浓度的NO3-处理下均具有较高水平的表达量。同样,在大麦[17]、玉米[18]等植物中也克隆鉴定出了NRT2基因。而关于木薯中硝态氮转运蛋白基因家族的报道却很少。
本研究成功克隆出了木薯MeNRT2.1基因的编码序列,并对其序列特征及时空表达情况进行了研究分析,为该基因的进一步应用以及木薯NO3-吸收转运积累机制的深入研究提供了理论参考。
1 材料与方法
1.1 材料
1.1.1 植物材料 供试材料“华南五号”木薯(Manihot esculenta Crantz)由中国热带农业科学院热带生物技术研究所提供。
1.1.2 菌种、质粒和试剂 大肠杆菌(E. coli) DH5α、pCAMBIA1302植物表达载体由本实验室保存。PMD18-T载体、限制性内切酶、Taq DNA聚合酶、T4 DNA连接酶、实时荧光定量PCR试剂SYBRR Premix Ex TaqTMⅡ等均购自TaKaRa公司。琼脂糖凝胶DNA回收试剂盒购自中科瑞泰公司。反转录试剂FastQuant RT Kit购自天根生化科技有限公司。其它生化试剂和常规试剂均为进口或国产分析纯。
1.2 方法
1.2.1 木薯组培苗硝态氮诱导处理 将发育状态基本一致的木薯组培苗在KNO3梯度培养基中进行处理,培养基KNO3浓度依次为0、0.2、10 mmol/L。植株幼苗生长条件为光周期12 h/12 h,温度25 ℃,相对湿度50%。幼苗培养20 d后,采集各處理根、茎、叶作为试验材料,用液氮速冻后将其储存于-80 ℃冰箱内,备用。
1.2.2 RNA的提取纯化及cDNA的合成 参照阮孟斌等[19]提取总RNA的方法提取“华南5号”木薯组培苗样品根、茎、叶的总RNA,并使用1.0%琼脂糖凝胶对RNA质量进行电泳检测。使用FastQuant RT Kit对RNA进行纯化,并将其反转录成cDNA。
1.2.3 木薯MeNRT2.1基因编码序列的克隆 根据已报道的拟南芥AtNRT2.1基因,利用BioEdit与木薯全基因组进行BLAST检索,初步获得木薯NRT2基因,根据JGI(http://www.phytozome.net/search.php)中收录的MeNRT2.1(cassava4.1_031095m)
DNA序列为参考,采用Primer Premier 5引物设计软件设计MeNRT2.1基因的上下游引物,在上游引物5′端引入保护碱基、BglⅡ酶切位点和补充碱基G,在下游引物5′端引入保护碱基和SpeⅠ酶切位点。引物序列如下:
P1 5′-GGAAGATCTGATGGCTGATATTGAGG
GTTCTC-3'(Bgl Ⅱ)
P2 5′-GGACTAGTGACATGGACTGGTGTAGTG
TTCG-3′(SpeⅠ)
以低浓度KNO3诱导的木薯组培苗根部cDNA 第一链为模板进行扩增。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 110 s,共35个循环;72 ℃ 10 min。反应结束后将PCR产物移至1%的琼脂糖凝胶中,电泳检测是否有特异条带出现,对特异条带进行回收。依照PMD18-T Vector Cloning Kit,将PCR回收产物与pMD18-T载体进行连接,采用热激法将连接产物转化大肠杆菌DH5α感受态细胞,挑取单菌落摇菌,进行菌液PCR检测,将获得的PCR阳性克隆命名为pMD18T-MeNRT2.1,送往上海生工生物工程有限公司测序。
1.2.4 木薯MeNRT2.1基因序列特点及其氨基酸序列进化分析 根据JGI公布的MeNRT2.1基因DNA序列及cDNA序列,利用NCBI Spidey (http://www.ncbi.nlm.nih.gov/spidey/)分析基因结构。利用DNAMAN绘制基因结构图,推导出氨基酸序列。基因编码蛋白的理化性质预测采用ExPASy Proteomics Server 提供的在线工具Protpar-
am(http://www.expasy.ch/tools/protparam.html)。采用在线工具(http://www.predictprotein.org/)进行二级结构分析。利用PSORT(http://psort.hgc.jp/form.html)进行亚细胞定位预测。利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白质的跨膜区。利用MEGA 5.1软件,以邻位相近法(Neighbor-Joining)构建进化树。
1.2.5 绿色荧光蛋白(GFP)融合载体的构建及鉴定 将序列正确的含有pMD18T-MeNRT2.1的大肠杆菌抽取质粒,用BglⅡ/SpeⅠ双酶切对重组质粒进行酶切鉴定;将MeNRT2.1基因的全长CDS连接到含有GFP的植物表达载体pC1302,把连接产物转入大肠杆菌DH5α感受态细胞,经Kan抗性筛选,挑取单克隆,再次用基因特异引物进行菌落PCR鉴定[20],抽取质粒并进行双酶切鉴定,构建出正确的GFP融合载体pC1302- MeNRT2.1(图1)。以pC1302空载体作为对照。
1.2.6 烟草原生质体的分离和转化 取健康烟草叶片用无菌水洗净,使用刀片将叶片切成1 mm左右的细条,将其置于酶解液中,抽真空10 min,于23 ℃ 暗培养6 h。烟草叶肉原生质体的分离、酶解液及W5反应液的配制参照Sheen[21]的方法。原生质体转化参考Yoo等[22]的PEG转化拟南芥原生质体的方法。待转化细胞暗培养24 h左右,用OLYMPU激光共聚焦显微镜(FV1000)观察原生质体中的荧光分布。
1.2.7 木薯MeNRT2.1基因实时定量PCR分析
利用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)的方法检测木薯MeNRT2.1基因在不同浓度KNO3中根部的表达情况。根据荧光定量引物设计规则,在此基因非保守区域内设计MeNRT2.1的定量引物,以木薯MeACT基因作为目标基因定量表达的内参基因,引物序列见表1,以反转录cDNA为模板进行Real-time PCR,样本和内参分别设置3个重复。依据TaKaRa公司SYBR Premix Ex TaqTMⅡ(Perfect Real Time)说明书进行,扩增程序为:第一步预变性,95 ℃ 30 s;第二步,95 ℃ 5 s,60 ℃ 30 s,循环45次。
1.3 数据分析
试验数据通过Excel进行分析,获得MeNRT2.1的相对表达量。RNA-seq高通量测序由北京诺和致源生物信息科技有限公司完成。
2 结果与分析
2.1 MeNRT2.1基因cDNA的克隆
以JGI(http://www.phytozome.net/search.php)中收录的MeNRT2.1(cassava4.1_031095m)DNA序列为参考设计引物,以反转录的cDNA为模板进行PCR扩增,结果见图2,经测序可知获得1 593 bp含有完整编码序列的cDNA序列,命名为MeNRT2.1。
2.2 MeNRT2.1编码蛋白特性分析
MeNRT2.1基因全長1 899 bp,含有2个外显子,1个内含子(图3),含有1 593 bp的开放式阅读框架(Open reading frame,ORF),编码530个氨基酸(图4)。基因编码蛋白的理化性质预测采用ExPASy Proteomics Server提供的在线工具Protparam,推测其蛋白相对分子质量为57.26 ku,等电点为9.28。在组成 NRT2.1蛋白的20种氨基酸中,Gly所占比例最高,为10.6 %;His所占比例最低,为1.5%。带正电残基(Arg+Lys)为39,负电残基(Asp+Glu)为27。该蛋白的不稳定系数为40.61,脂肪系数为89.11,亲水性系数为0.402。亚细胞定位预测结果表明,该蛋白很可能是位于质膜上的膜蛋白。
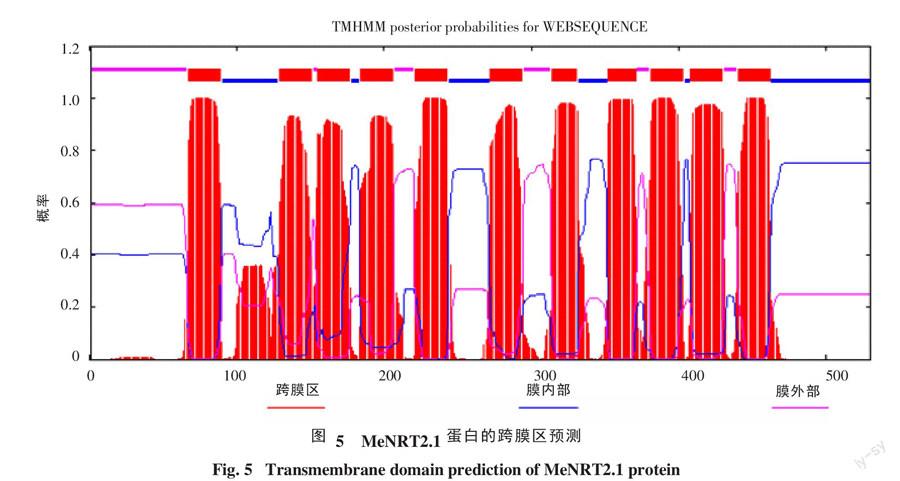
二级结构在线预测结果表明,氨基酸参与形成的α-螺旋(alpha helix)占63.21%,β-折叠(beta sheet)占3.4%,无规则卷曲(random coil)占33.4%。MeNRT2.1蛋白含有MFS蛋白保守结构域,属于MFS超级家族。通过TMHMM软件进行预测,依据氨基酸序列预测的NRT2.1拓扑图(图5)可以看出,该蛋白具有NRT2家族共有的结构特征,有12个跨膜结构域,属于NRT2蛋白,并且木薯NRT2.1蛋白氨基酸N-末端和C-末端分别位于细胞膜外和细胞膜内。
2.3 MeNRT2.1蛋白序列比对及进化分析
将MeNRT2.1氨基酸序列与其它植物的NRT2.1进行比较,结果发现MeNRT2.1与苜蓿(Medicago truncatula)、 拟南芥(Arabidopsis thaliana)、可可(Theobroma cacao)、 杨树(Populus trichocarpa)等物种的NRT2.1的同源性分别为88%、81%、90%、89%。进化树分析表明,木薯MeNRT2.1氨基酸序列与可可树TcNRT2.1的亲缘关系最近(图 6)。
2.4 MeNRT2.1在烟草原生质体细胞中的瞬时表达
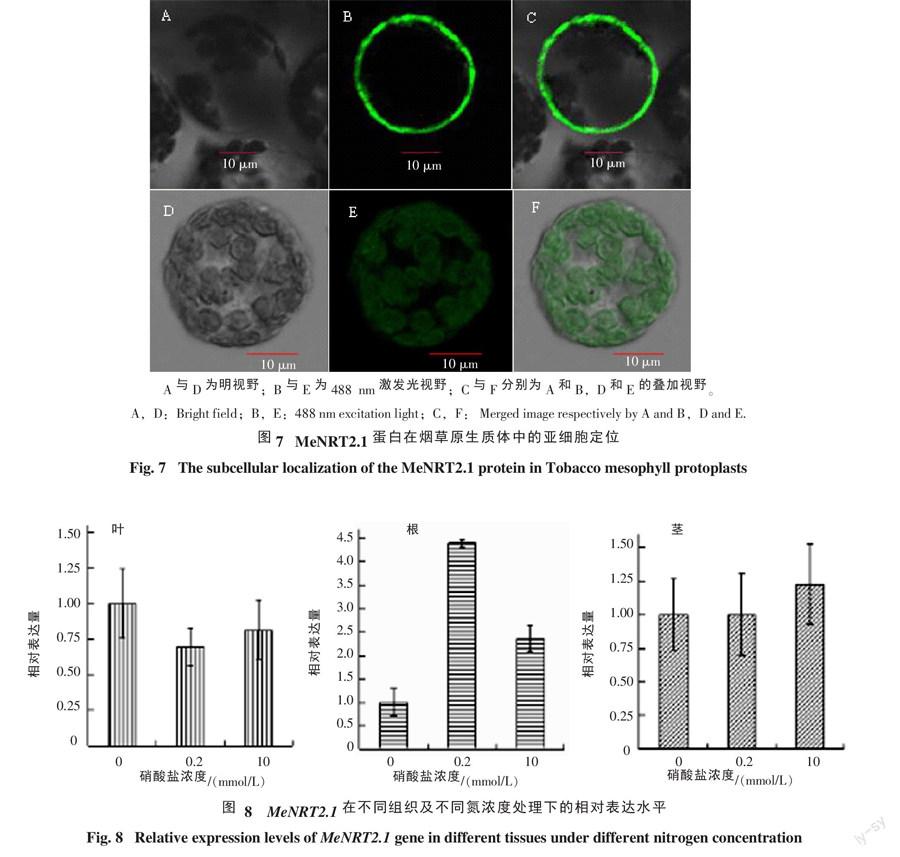
本研究构建了以GFP为标记的pC1302-MeNRT2.1载体,通过PEG介导的烟草原生质体瞬时表达系统观察目的基因融合蛋白的亚细胞定位,在激光共聚焦显微镜绿色荧光下观察GFP荧光。如图7所示,对照(空载体pC1302)的原生质体细胞充满绿色荧光,而pC1302-MeNRT2.1仅在细胞膜上出现GFP绿色荧光。结果表明该基因编码的蛋白主要定位于细胞膜上,属于跨膜转运蛋白。
2.5 MeNRT2.1在木薯中的表达分析
为了研究在MeNRT2.1在木薯中的表达模式,采用实时荧光定量PCR对不同浓度硝酸盐下木薯根、茎、叶中基因的表达量进行分析,结果见图8。由图8可知,MeNRT2.1在组培苗的根中表达,在茎、叶中几乎不表达,并且在NO3-浓度为0.2 mmol/L时表达量最高,NO3-浓度为10 mmol/L时其相对表达量较低,无NO3-时几乎不表达,即该基因具有诱导型组织特异性表达模式。同时,RNA-seq高通量测序结果与本研究qRT-PCR的结果相一致。
3 討论与结论
本研究根据拟南芥中已知的NRT2.1基因,利用同源克隆和RT-PCR技术,获得木薯中一个高亲和硝态氮转运蛋白基因MeNRT2.1。该基因含有1 593 bp的CDS序列,编码530个氨基酸。生物信息学分析结果表明,NRT2.1基因核苷酸及氨基酸序列与其他植物NRT2.1有较高的同源性,MeNRT2.1与可可树[23]、杨树[24]和苜蓿[25]的同源性分别高达90%、89%和88%,这与聚类分析的结果相一致,表明该基因可能为木薯NRT2.1基因,与其他植物中报道的NRT2.1基因具有相似的功能[11,13-16]。
研究已表明拟南芥AtNRT2.1基因对硝态氮信号反应较快,在低浓度下短时间内表达量可能达到峰值,然后恢复正常水平[26],并且AtNRT2.1的表达具有阶段性,低浓度NO3-处理2、4、10 d时均有最大峰值出现[27],在木薯中可能具有类似的表达模式。但因木薯长期生长于贫瘠土壤中,本研究将木薯幼苗在不同浓度硝态氮中处理20 d,既保证了苗期植株发育的完整性,又符合木薯生理特征及自然生长环境。通过qRT-PCR、RNA-seq(另文发表)的表达模式分析可知,木薯MeNRT2.1基因能够被低浓度的硝态氮(0.2 mmol/L NO3-)在根中诱导表达,与已经报道的烟草[14]、大豆[15]、平邑甜茶[28]等植物中的NRT2表达模式相似。MeNRT2.1在低浓度(0.2 mmol/L)的NO3-中相对表达量较高,在10 mmol/L的NO3-中相对表达量较低,可能受到高浓度NO3-的抑制,这与高亲和转运体系NRT2基因功能基本相似。不同环境中基因发挥不同的功能,有利于植物长期适应氮贫瘠环境。
跨膜结构预测显示该蛋白具有12个跨膜区,符合NRT2家族蛋白共有的跨膜结构特征,原生质体瞬时表达结果表明该蛋白位于质膜上,为膜结构蛋白。有研究结果表明,AtNRT2.1主要定位于拟南芥根皮层和表皮的质膜上[11],孔敏等[16]也发现BcNRT2 定位于白菜细胞膜上。膜上的蛋白质主要有载体蛋白、通道蛋白、蛋白受体以及与细胞活动有关的离子泵等,说明MeNRT2.1的编码产物对于细胞质膜的稳定性或控制蛋白转运具有一定的作用[29]。需进一步优化实验条件,利用转基因、蛙卵异源表达系统等技术对有关该基因编码蛋白亲和NO3-的分子机制及编码蛋白在质膜上发挥的转运功能进行深入研究。
本研究成功克隆木薯MeNRT2.1基因,并对其序列结构和表达模式进行了初步分析,为深入认识木薯耐低氮和氮素高效利用的理论机制提供了相关依据,也为木薯NO3-吸收转运积累机制的深入研究提供了理论参考。
参考文献
[1] 黄 洁, 李开绵, 叶剑秋, 等. 中国木薯产业化的发展研究与对策[J]. 中国农学通报, 2006, 22(5): 421-426.
[2] Nguyen H, Schoenau J J, Nguyen D, et al. Effects of long-term nitrogen,phosphorus, and potassium fertilization on cassava yield and plant nutrient composition in north Vietnam[J]. Journal of Plant Nutrition, 2002, 25(3): 425-442.
[3] 鲜开梅, 王彦波, 苑育文, 等. 氮素在甜椒等蔬菜作物方面的研究进展[J]. 现代农业科技, 2006(7): 6-9.
[4] 吴 巍, 赵 军. 植物对氮素吸收利用的研究进展[J]. 中国农学通报, 2010(13): 75-78.
[5] 谭丽霞, 曾建华, 吴宇佳, 等. 木薯氮磷钾肥优化施用技术研究[J]. 广东农业科学, 2012, 39(12): 66-68.
[6] Chapman N, Miller T. Nitrate transporters and root architecture[M]//Geisler M,Venema K. Transporters and pumps in plant signaling. Berlin: Springer, 2011: 165-190.
[7] Lee R B, Clarkson D T. Nitrogen-13 studies of nitrate fluxes in barley roots. Compartmental analysis from measurements of 13N efflux[J]. The EMBO Journal, 1986, 37(185): 1 753-1 767.
[8] Tsay Y F, Chu C C, Tsai C B, et al. Nitrate transporters and peptide transporters[J]. Febs Letters, 2001, 581(12): 2 290-2 300.
[9] Crawford N M, Glass A D M. Molecular and physiological aspects of nitrate uptake in plants[J]. Trends in Plant Science, 1998, 3(10): 389-395.
[10] Okamoto M, Vidmar J J, Glass A D M. Regulation of NRT1 and NRT2 gene families of Arabidopsis thaliana responses to nitrate provision[J]. Plant Cell Physoil, 2003, 44(3): 304-317.
[11] Wirth J, Franck Chopin, Véronique Santoni, et al. Regulation of root nitrate uptake at the NRT2.1 protein level in Arabidopsis thaliana[J]. Journal of Biological Chemistry, 2007, 282(32): 23 541-23 552.
[12] Hu B, Wang W, Ou S, et al. Variation in NRT1.1B contributes to nitrate-use divergence between rice subspecies[J/OL]. Nature Genetics, 2015, doi: 10.1038/ng. 3337.
[13] 徐海荣, 谷俊涛, 路文静, 等. 水稻硝酸盐转运蛋白基因OsTNrt2.1的编码蛋白特征和表达[J]. 作物学报, 2007, 33(5): 723-730.
[14] Quesada A, Krapp A, Trueman L J, et al. PCR-identification of a nicotiana plumbaginifolia cDNA homologous to the high-affinity nitrate transporters of the crnA family[J]. Plant Molecular Biology, 1997, 34(2): 265-274.
[15] Amarasinghe B H, de Bruxelles G L, Braddon M, et al. Regulation of GmNRT2 expression and nitrate transport activity in roots of soybean(Glycine max)[J]. Planta, 1998, 206(1): 44-52.
[16] 孔 敏, 杨学东, 候喜林, 等. 白菜NRT2基因的克隆及表达模式分析[J]. 园艺学报, 2011, 38(12): 2 309-2 316.
[17] Vidmar J J, Zhuo D G, Siddiqi M Y, et al. Regulation of high-affinity nitrate transporter genes and high-affinity nitrate influx by nitrogen pools in roots of barley[J]. Plant Physiology, 2000, 123(1): 307-318.
[18] Quaggiotti S, Ruperti B, Borsa P, et al. Expression of aputative high-affinity NO3- transporter and of an H+-ATPasein relation to whole plant nitrate transport physiology in two maize genotypes differently responsive to low nitrogen availability[J]. Journal of Experiment Botany, 2003, 54(384): 1 023-1 031.
[19] 阮孟斌, 李文斌, 于晓玲, 等. 一种适用于多糖多酚植物的高质量RNA快速提取方法[J]. 热带作物学报, 2011, 32(9): 1 704-1 707.
[20] Earley K W, Haag J R, Pontes O, et al. Gateway-compatible vectors for plant functional genomics and proteomics[J]. The Plant Journal, 2006, 45(4): 616-629.
[21] Sheen J. Signal transduction in maize and Arabidopsis mesophyll protoplasts[J]. Plant Physiology, 2001, 127(4): 1 466-1 475.
[22] Yoo S D, Cho Y H, Sheen J. Arabidopsis mesophyll protoplasts: A versatile cell system for transient gene expression analysis[J]. Nature Protocols, 2007, 2: 1 565-1 572.
[23] Motamayor J C, Mockaitis K, Schmutz J, et al. The genome sequence of the most widely cultivated cacao type and its use to identify candidate genes regulating pod color[J]. Genome Biology, 2013, 14(6): r53.
[24] Bai H, Euring D, Volmer K, et al. The nitrate transporter (NRT)gene family in poplar[J]. Plos One, 2013, 8(8): e72-126.
[25] Pellizzaro A, Clochard T, Planchet E, et al. Identification and molecular characterization of Medicago truncatula NRT2 and NAR2 families[J]. Physiologia Plantarum, 2015, 154(2): 256-269.
[26] Laugier E, Bouguyon E, Mauriès A, et al. Regulation of high-affinity nitrate uptake in roots of Arabidopsis depends predominantly on posttranscriptional control of the NRT2.1/NAR2.1 transport system[J]. Plant Physiology, 2012, 158(2): 1 067-1 078.
[27] Krapp A, Berthom E R, Orsel M, et al. Arabidopsis roots and shoots show distinct temporal adaptation pattern towards N starvation[J]. Plant Physiol, 2011, 157(3), 1 255-1 282.
[28] 王新亮. 果樹根系硝态氮信号响应关键基因的克隆与功能分析[D]. 泰安: 山东农业大学, 2012.
[29] 邢浩然, 刘丽娟, 刘国振. 植物蛋白质的亚细胞定位研究进展[J]. 华北农学报, 2006, 21(增刊): 1-6.
责任编辑:林海妹
